Эпидемиология
Герминогенные опухоли яичников (ГОЯ) – это группа опухолей, состоящая из производных примитивных зародышевых клеток эмбриональных гонад, то есть клеток, участвующих в формировании половых желез и процессах гаметогенеза. Источник этих опухолей – первичная половая клетка (ППК, primordial germ cell, примордиальная герминогенная клетка) [1, 2].
ГОЯ составляют по разным данным до 20–30% среди всех новообразований яичника, причем только 5% из них являются злокачественными. Остальные 95% являются доброкачественными и представлены зрелой кистозной тератомой [2–5]. В структуре всех злокачественных новообразований яичника злокачественные ГОЯ составляют примерно 3% [2, 6–10].
Пик заболеваемости приходится на женщин молодого возраста и подростков (15–20 лет). В структуре злокачественных новообразований яичника у детей злокачественные ГОЯ составляют до 70% [8, 11].
Морфологическая классификация
Морфологическая диагностика ГОЯ достаточно трудна в связи многообразием гистологических вариантов этих опухолей. Современная классификация герминогенных опухолей представлена в табл. 1 [12].
Клиническая картина
Наиболее характерными симптомами злокачественных ГОЯ являются боли в животе различной интенсивности и длительности. По данным различных авторов, подобные симптомы встречаются у 85% больных с пальпируемым объемным образованием в брюшной полости и малом тазу [9, 13, 14].
Приблизительно 10% больных поступают в стационар с картиной «острого живота», что чаще всего связано с разрывом капсулы, кровоизлиянием или перекрутом ножки опухолевого образования яичников с нарушением трофики тканей.
Приблизительно у 5% пациенток со злокачественными ГОЯ наблюдаются первичная аменорея, вирилизация или аномалии развития наружных половых органов. Это связано с развитием дисгерминомы на фоне чистой формы дисгенезии гонад (синдром Свайера, кариотип 46 XY, двусторонние гонадные тяжи) или смешанной формы дисгенезии гонад (хромосомный мозаицизм 45X/46XY, односторонний гонадный тяж, контрлатеральное яичко) [2].
Методы диагностики герминогенных опухолей яичника
При наличии у молодой женщины образования в малом тазу в первую очередь следует исключать ГОЯ. Это позволяет своевременно начать лечение и в ряде случаев сохранить репродуктивную функцию женщины.
Первичное обследование больной с подозрением на злокачественные ГОЯ должно включать: сбор анамнеза; физикальное обследование; гинекологическое исследование; общий и биохимический анализы крови; определение опухолевых маркеров (α-фетопротеин (АФП), β-субъединица хорионического гонадотропина человека (β-ХГЧ), лактатдегидрогеназа (ЛДГ), СА-125) в сыворотке крови; кариотипирование (при подозрении на дисгенезию гонад); рентгенологическое исследование органов грудной клетки; ультразвуковое исследование (УЗИ) органов малого таза, брюшной полости и забрюшинного пространства; проведение магнитно-резонансной томографии (МРТ) или компьютерной томографии (КТ) – по показаниям.
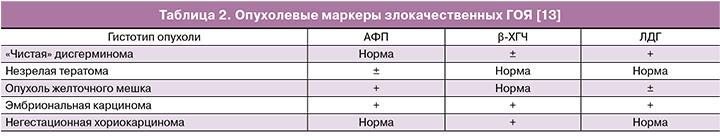
Простым и информативным методом дифференциальной диагностики является определение опухолевых маркеров в сыворотке крови (табл. 2). Способность продуцировать специфические опухолевые маркеры является уникальной особенностью злокачественных ГОЯ. Они позволяют уточнить диагноз, правильно определить тактику лечения, провести всесторонний мониторинг в процессе лечения и вовремя выявить рецидив заболевания [2, 9, 13, 14].
Примерно у 95% больных с дисгерминомой яичника отмечается повышение ЛДГ в сыворотке крови. Как правило, уровень ЛДГ коррелирует с размерами опухоли, степенью распространенности процесса, эффективностью проводимого лечения и появлением рецидива [8]. Обычно для «чистой» дисгерминомы не характерно увеличение АФП. Наличие повышенного уровня АФП в сыворотке крови свидетельствует о смешанной структуре, как правило, при сочетании с опухолью желточного мешка [15]. При наличии в дисгерминоме гигантских клеток синцитиотрофобласта, что наблюдается примерно в 5–8% случаев, отмечается повышение уровня β-ХГЧ [14, 15].

Опухоли желточного мешка продуцируют АФП, его значения могут достигать более 1000 нг/мл. Данный маркер используется для определения прогноза заболевания и мониторинга эффективности лечения. Так, уровень АФП более 10 000 нг/мл свидетельствует о неблагоприятном прогнозе. Низкие сывороточные уровни АФП могут наблюдаться и при других опухолях, встречающихся у молодых женщин, например, при незрелой тератоме [2, 6, 8].
При наличии негестационной хорикарциномы в крови повышается уровень ХГЧ, который может достигать более 2 000 000 мМЕ/мл [5].
Смешанные герминогенные опухоли могут секретировать АФП, ХГЧ или оба маркера, что зависит от тех типов опухоли, которые имеются в ее составе. Повышение уровня СА-125 для злокачественных ГОЯ, как правило, не характерно.
Визуализационные методы диагностики ГОЯ
Зрелая тератома. Отличительной особенностью зрелых тератом является наличие высокодифференцированных тканей при отсутствии незрелых или эмбриональных элементов в их структуре [6, 9].
Зрелая кистозная тератома – наиболее распространенный тип ГОЯ (95%) и составляет до 20% среди всех новообразований яичника; чаще всего диагностируется в репродуктивном периоде, но в отличие от других герминогенных опухолей имеет широкий возрастной диапазон – от периода младенчества до пожилого возраста. Опухоль, как правило, односторонняя, медленно растущая, в 8–15% случаев являются двусторонними [5, 6, 9, 15]. Зрелая солидная тератома встречается крайне редко и поражает преимущественно детей и подростков [15].
УЗИ. Выделяют три основных типа ультразвуковой структуры.
Кистозная форма (дермоидная киста). Встречается в 47–60% случаев. Внутреннее содержимое ан-/гипоэхогенное, что характерно для серозной жидкости или жира низкой плотности. В жидкостном содержимом встречаются точечные и линейные гиперэхогенные включения (признак «дермоидной сетки»), которые могут являться волосами или мелкими комочками жира [16]. В ряде случаев определяется пристеночное внутрипросветное образование – дермоидный бугорок (бугор Рокитанского), а также уровень жир-жидкость [17–20]. Еще один редкий признак, патогномоничный для дермоидной кисты – множественные плавающие глобулы, сферулы или шарики внутри кистозного образования, которые характерны для кист больших размеров (более 10 см в диаметре): имеют примерно одинаковый размер, повышенную эхогенность [16–19, 21, 22]. Чувствительность УЗИ в диагностике зрелой кистозной тератомы составляет 77–86%, специфичность 94–100% [19–23].
Преобладание плотного компонента. Встречается в 20–43% случаев. Внутреннее содержимое представлено включениями различной формы и размеров, которые могут являться хрящевой, костной тканью или зубами, с четкими или нечеткими контурами, высокой эхогенности, вплоть до появления акустической тени за некоторыми фрагментами (так называемый признак «верхушки айсберга») [16, 23].
Тератомы этого типа, как правило, не превышают 4 см в диаметре и наиболее часто правильно диагностируются при УЗИ.
Смешанное строение. Встречается в 9–20% случаев. В исследованиях показано, что этот тип тератом наиболее часто подвергается малигнизации. Опухоль имеет неоднородную внутреннюю структуру, характерную для большинства опухолей яичников за исключением серозных. При цветовом допплеровском картировании и энергетической допплерографии отмечается полная аваскуляризация зрелой тератомы или единичные цветовые локусы. При наличии васкуляризации необходимо исключить процесс малигнизации [24, 25].
МРТ. Около трети наблюдений по различным данным имеют предоминантно кистозную структуру. Как правило, четко визуализируется эндофитный солидный бугорок Рокитанского или древовидные, ветвящиеся структуры, которые лоцируются в контактной со стромальным компонентом части капсулы. Наружный контур, в большинстве случаев, четкий, ровный, без признаков инвазивного роста. Толщина капсулы равномерная и не превышает 1–2 мм (максимально 3 мм). В редких случаях, как правило, при крупных опухолях, в структуре визуализируются гладкие неутолщенные (1–2 мм) перегородки. Поскольку образования, чаще всего, имеют эктодермальное происхождение, они содержат десквамированный кератин с характерной себорейной секрецией, что определяет интенсивность сигнала, характерную для жировой ткани во всех последовательностях: гиперинтенсивный сигнал на Т1- и Т2-ВИ, гипоинтенсивный в режимах с подавлением сигнала от жира (FatSat), что является основой для дифференциальной диагностики между зрелыми тератомами и эндометриоидными кистами [8, 14, 20]. Наличие перечисленных признаков позволяет диагностировать кистозную тератому в 98% случаев.
КТ — наличие жира, уровень жир-жидкость, кальцинаты (иногда в виде зуба), бугорок Рокитанского и пучки волос.
При размере более 10 см, наличии участков мягких тканей или разрастаний в виде цветной капусты необходимо исключить злокачественную трансформацию зрелой кистозной тератомы.
Незрелые тератомы (син. злокачественные тератомы, тератобластомы или эмбриональные тератомы) составляют менее 1% среди всех злокачественных опухолей яичника. Чаще возникают в молодом возрасте (до 20 лет), у детей и подростков. Характерно одностороннее поражение, двустороннее наблюдается менее чем в 5% случаев [2, 15].
УЗИ. Ультразвуковые признаки не специфичны. Как правило, опухоль представлена солидным образованием неправильной формы, с неровным, нечетким контуром, гетерогенной структурой и рассеянными мелкими кальцинатами. Также могут иметь кистозные включения. При допплерографии отмечается гиперваскуляризация стромы преимущественно в центральных отделах с мозаичным типом кровотока. Индекс резистентности ниже 0,4 [24 – 28].
МРТ, КТ. Незрелые тератомы определяются преимущественно в виде солидной структуры, содержащие элементы жира, неправильной формы кальцинаты и многочисленные кисты различного размера. Солидный компонент имеет, как правило, низкую интенсивность сигнала, характерную для мягких тканей, в режиме Т2-ВИ показывает большое разнообразие интенсивности сигналов. В режиме FatSat определяются локусы жира, которые намного меньше, чем наблюдаются при зрелой кистозной тератоме. В кистозных участках может определяться муцинозное содержимое. Определяемые кальцинаты имеют малый размер, неправильную форму, разбросаны по всей опухоли, в то время как в зрелой кистозной тератоме кальцинаты грубые, зубовидные, расположенные в пристеночном бугорке или стенке кисты. По результатам исследований значительной корреляции между количеством солидной ткани и степенью злокачественности опухоли выявлено не было [8, 14, 19].
Дисгерминомы относятся к редким новообразованиям и, по данным различных авторов, составляют всего 1–3% среди всех злокачественных новообразований яичника. Пик заболеваемости отмечается в подростковом и раннем репродуктивном периоде (c 10 до 30 лет), и в данной возрастной группе дисгерминомы диагностируются в 75% случаев. Локализация опухоли чаще всего односторонняя, в 10–15% случаев отмечается двустороннее поражение. Опухоль, как правило, быстрорастущая и достигает больших размеров [2, 5, 15].
УЗИ. Эхографическое описание этих опухолей в литературе представлено единичными сообщениями. Чаще всего, опухоль полностью замещает ткань яичника, прорастает капсулу и срастается с окружающими тканями и органами в единый конгломерат. Определяется преимущественно в виде солидного образования, имеющего дольчатое строение, четкие, волнистые края. Эхоструктура гетерогенная с наличием участков высокой и средней эхогенности и с высокой звукопроводимостью, которая сопоставима с жидкостными структурами [18]. Данные литературы по применению допплерографии противоречивы. По одним источникам, определяются только единичные цветовые локусы венозного кровотока, по другим – в 100% случаев при цветовом допплеровском картировании и энергетической допплерографии имеется гиперваскуляризация с мозаичным типом кровотока [8, 14, 29].
В.Н. Демидов и соавт. выделяют следующие наиболее характерные признаки дисгерминомы: молодой возраст женщины (до 30 лет); признаки общего и генитального инфантилизма; наличие аномалий развития половых органов; нарушения менструального цикла; как правило, одностороннее поражение яичника; солидное строение образования; средняя эхогенность опухоли в сочетании с различной формы и размеров участками повышенной эхогенности; высокая звукопроводимость опухоли; неровные контуры образования. Точность ультразвуковой диагностики дисгерминомы при использовании указанных критериев составила 72,7% [30].
МРТ. Наиболее характерное проявление – опухоль солидной структуры, разделенная на доли фиброваскулярными перегородками. На Т1-ВИ имеет гипоинтенсивный сигнал по отношению к мышцам, на Т2-ВИ изо- или высокоинтенсивный сигнал. Как правило, перегородки имеют гипо- или изоинтенсивный сигнал на Т2-ВИ, в режиме Т1-ВИ диагностируются трудно, необходимо использование динамического внутривенного контрастирования для адекватной оценки перфузионных характеристик опухоли. Перегородки также могут быть и гиперинтенсивными на Т2-ВИ при наличии выраженного отека в строме. Фокусы некроза или геморрагические участки встречаются редко [14, 19]. Кроме того, в литературе описаны многокамерные кистозные образования с папиллярными разрастаниями, имитирующие эпителиальные опухоли яичников [8, 14].
КТ. Определяется дольчатое солидное строение опухоли, с контрастными перегородками и участками кистозных изменений, которые могут представлять собой кровоизлияние или некроз. Также могут присутствовать кальцинаты, создавая пятнистый рисунок.
Опухоль желточного мешка (опухоль эндодермального синуса), как и дисгерминома, поражает женщин молодого возраста, детей и подростков. Средний возраст при первичной диагностике составляет 18 лет. Опухолевый процесс практически всегда имеет односторонний характер (чаще поражается правый яичник). Опухоли желточного мешка являются агрессивными и быстрорастущими опухолями [5, 9, 15].
УЗИ. Определяется в виде кистозно-солидного образования с ровным наружным контуром. Солидный компонент имеет гетерогенную эхоструктуру, кистозные полости разделены перегородками.
МРТ, КТ. При перфузионной МРТ часто обнаруживается признак «яркой точки» (bright dot sign), который представляет собой усиленные фокусы в стенке образования или его солидном компоненте. Это свидетельствует о высокой васкуляризации образования. Несмотря на частоту встречаемости данного признака, он не является патогномоничным для опухоли желточного мешка, так как может встречаться при других герминогенных опухолях, имеющих сходную структуру. На Т1-ВИ солидный компонент имеет преимущественно гипоинтенсивный сигнал, иногда в сочетании с высокоинтенсивным сигналом, представляющий геморрагические участки. При T2-ВИ опухоль имеет гетерогенный высокоинтенсивный сигнал, с участками гиперинтенсивного сигнала, представляющий геморрагические участки или участки некроза. Также могут присутствовать множественные сигналы от пустотных структур [8, 14].
Негестационная хориокарцинома является чрезвычайно редкой и очень злокачественной опухолью, которая развивается до начала пубертатного периода. Чаще всего хориокарцинома встречается как компонент в смешанных герминогенных опухолях.
УЗИ. Патогномоничных признаков нет, представлена солидно-кистозной опухолью с обильной васкуляризацией. УЗИ позволяет исключить маточную или эктопическую беременность у женщин с повышенным уровнем β-ХГЧ.
МРТ, КТ. Определяется как солидное образование с обильной васкуляризацией. На Т2-ВИ в солидном компоненте опухоли могут отмечаться участки гиперинтенсивного сигнала, представляющие собой сосудистые структуры и небольшие кистозные полости, на Т1-ВИ отмечаются высокоинтенсивные фокусы, представленные геморрагическими участками [14, 19].
Заключение
Основным скрининговым методом диагностики является УЗИ органов малого таза, которое позволяет обнаружить опухоль яичника на ранних стадиях, а в сочетании с допплерометрией определить в большинстве случаев характер патологического процесса.
МРТ является методом выбора в уточняющей дифференциальной диагностике при неудовлетворительной ультразвуковой визуализации или наличии сомнительного образования (согласно критериям IOTA). Дополнительное применение современных технологий (диффузионно-взвешанная МРТ и МРТ с динамическим контрастированием) к стандартному протоколу МРТ позволяет повысить диагностическую точность до 95%. КТ используется преимущественно для диагностики отдаленных метастазов и стадирования злокачественных новообразований. Согласно рекомендациям ESUR и ACR, проведение МРТ как основного диагностического метода в стадировании злокачественных новообразований яичника показано пациентам, имеющим противопоказания к введению контрастного препарата или воздействию ионизирующего излучения (беременные и молодые женщины).
Важную роль в диагностике также играют опухолевые маркеры, которые являются уникальной особенностью злокачественных ГОЯ. Определение в сыворотке крови АФП, β-ХГЧ и ЛДГ позволяет уже на этапе обследования предположить гистологический вариант опухоли, правильно определить тактику лечения, провести всесторонний мониторинг в процессе лечения и вовремя выявить рецидив заболевания. Таким образом, современная диагностика ГОЯ требует целого комплекса диагностических мероприятий, что позволяет определить индивидуальную тактику ведения пациента, объем и доступ оперативного вмешательства.



