Проблема привычного невынашивания беременности остается актуальной, так как 3–5% супружеских пар страдают этой патологией, и в настоящее время нет тенденции к снижению [1]. По определению ВОЗ привычным невынашиванием беременности считаются последовательные потери трех и более беременностей в одном браке. В нашей стране, как и в некоторых европейских странах, принято уже после двух последовательных гестационных потерь проводить более углубленное обследование супружеской пары для своевременного проведения предгестационной подготовки.
Этиология привычного невынашивания беременности мультифакторна, часто имеет место воздействие сразу нескольких факторов – генетических, эндокринных, иммунологических (аутоиммунных и аллоимунных), инфекционных, тромбофилических, анатомических [2–4].
По данным литературы в 50% случаев ранних выкидышей имеют место хромосомные аномалии и только в 1–2% случаев хромосомные аномалии выявляются при гестационных потерях после 12 недель [5].
В современном мире планирование беременности происходит в более позднем репродуктивном возрасте, в связи с чем реализация генетически обусловленного риска потерь беременностей имеет место с большей частотой. В этой связи актуален поиск генетических маркеров, предрасполагающих к прерыванию беременности на ранних и поздних сроках.
В последнее время большое внимание уделяется углубленному изучению генетических аспектов в невынашивании беременности, особенно случаев потерь беременности с неясной этиологией, в связи с чем исследование генетических полиморфизмов представляет большой научный и практический интерес.
В этой связи целью данного исследования было изучить роль генетических факторов в реализации привычных потерь беременности неясного генеза на ранних и поздних сроках в сравнении с женщинами с ненарушенной репродуктивной функцией.
Материал и методы исследования
Нами были обследованы 100 женщин. I группу составили пациентки с привычным невынашиванием беременности (n=70), которые были разделены на подгруппы в зависимости от срока и генеза гестационных потерь: Ia – пациентки с ранними гестационными потерями (до 22 недель беременности, n=30), Ib – пациентки с очень ранними и ранними преждевременными родами (c 22 до 32 недель беременности, n=30), Ic – пациентки с антенатальной гибелью плода в анамнезе (после 22 недель беременности, n=10). Группу контроля (II) составили пациентки с неосложненным течением беременности и наличием не менее двух своевременных родов в анамнезе (n=30).
Средний возраст обследуемых составил 35±3,6 года; среднее число беременностей в анамнезе в I группе составило 4,8±0,7, во II группе – 3,1±0,5.
Критерием включения пациенток в I группу исследования было наличие в анамнезе не менее 2 самопроизвольных последовательных потерь беременности, не связанных с аномалиями развития или хромосомной патологией плода.
Критериями исключения из исследования были: наличие анатомических причин привычных потерь беременности (врожденные пороки развития половой системы, наличие миомы матки больших размеров или с центрипетальным ростом узла, значительно деформирующего полость матки, наличие внутриматочных синехий), аномалии кариотипа родителей, наличие совместимости супругов по системе HLA II класса по 3 и более аллеям, наличие высоких титров антифосфолипидных антител, наличие выраженных признаков тромбофилии по данным лабораторных исследований.
В работе проводилось исследование полиморфизмов генов различных типов коллагена: COL1A1 (rs1800012, rs1107946), COL2A1 (rs1635529), COL3A1 (rs1800255), COL4A1 (rs16975492), COL4A3 (rs1882435); генов, кодирующих интерлейкины, их рецепторы и рецепторные антагонисты: IL1α (Interleukin 1α – rs1800587), IL1B (Interleukin 1B – rs1143634, rs1143627, rs16944), IL1R1 (Interleukin 1 receptor, type I – rs2234650), IL1RN (Interleukin 1 receptor antagonist – rs315952), IL4 (Interleukin 4 – rs2243250, rs2070874), IL4R (Interleukin 4 receptor – rs1801275), IL6 (Interleukin 6 – rs1800795), IL6R (Interleukin 6 receptor – rs2228145), IL8 (Interleukin 8 – rs4073), IL10 (Interleukin 10 – rs1800872, rs1800896), IL12B (Subunit beta of interleukin 12 -rs3212227), IL15RA (interleukin-15 receptor antagonist – rs2296135), IL18 (Interleukin 18 – rs1946519, rs187238, rs1946518); генов, кодирующих матриксную металлопротеиназу-2 и ее ингибитор: MMP2 (matrix metalloproteinase 2 – rs243865, rs2285053), TIMP2 (tissue inhibitor of metalloproteinases 2- rs2277698); генов, кодирующих фибронектин 1 – FN1 (fibronectin 1 – rs2304573, rs3796123) и фактор роста фибробластов 1 – FGF1 (fibroblast growth factor 1- rs34003).
Выделение ДНК проводили по методу Higuchi (R. Higuchi, H. Erlich, 1989) с некоторыми модификациями. 0,5 мл крови, взятой на EDTA в качестве антикоагулянта, смешивали в 1,5 мл микроцентрифужных пробирках типа Эппендорф с 0,5 мл лизирующего раствора, состоящего из 0,32М сахарозы, 10 мМ Трис-HCl рН 7,5, 5 мМ MgCl, 1% Тритона Х-100, центрифугировали в течение 1 мин при 10 000 об/мин, супернатант удаляли, а осадки клеточных ядер два раза отмывали указанным буфером. Последующий протеолиз проводили в 50 мкл буферного раствора, содержащего 50мМ KCl, 10 мМ Трис-HCl рН 8,3, 2,5мМ MgCl, 0,45% NP40, 045% Твина 20 и 250 мкг/мл протеиназы К при 37°С в течение 20 мин. Инактивировали протеиназу К при 98°С в течение 20 мин. Полученные образцы ДНК до типирования хранили при -20°С. Концентрация ДНК определенная на ДНК-минифлуориметре (Ноеfer, США) составляла в среднем 50–100 мкг/мл.
Определение замен одиночных нуклеотидов проводили модифицированным методом «примыкающих проб» (adjacent probes, kissing probes), используя оригинальные олигонуклеотиды [6, 7]. Использованы коммерческие тест-системы производства ООО «НПО ДНК-Технология» (Россия).
При идентификации замен одиночных нуклеотидов вначале проводили полимеразную цепную реакцию (ПЦР) с праймерами, общими для обоих вариантов нуклеотидной последовательности, затем понижали температуру реакционной смеси для гибридизации полученной матрицы с олигонуклеотидными пробами. Для определения варианта последовательности использовали два типа олигонуклеотидов, гибридизующихся на матрицу рядом. Первый тип олигонуклеотидов был помечен флуорофором, второй – гасителем флуоресценции.
Для предотвращения неспецифического отжига праймеров и повышения чувствительности тест-систем использовали Taq-полимеразу, блокированную специфическими антителами.
В ходе генотипирования использовали один общий олигонуклеотид с гасителем флуоресценции и два сиквенс-специфичных олигонуклеотида, несущих различные флуорофоры. Олигонуклеотидные пробы, соответствующие тому или иному варианту последовательности, метили различными флуорофорами, что позволило определять оба варианта в одной пробирке. После поведения ПЦР и гибридизации измеряли уровень флуоресценции в ходе температурной денатурации дуплексов олигонуклеотидов и полученных матриц в режиме реального времени. Определение генотипа проводили путем анализа кривых плавления. Если анализируемый образец содержал только один вариант нуклеотидной последовательности гена, то есть был гомозиготен по данному полиморфизму, температура плавления для пробы, образующей совершенный дуплекс, была существенно выше, нежели для пробы, образующей несовершенный дуплекс. Если же анализировали гетерозиготный образец, содержащий оба варианта нуклеотидной последовательности, каждый из вариантов проб мог образовать совершенный дуплекс, поэтому температуры их плавления были практически одинаковы.
ПЦР и определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия).
Результаты исследования и обсуждение
На первом этапе исследования мы сравнили распределение генотипов и аллелей вышеописанных полиморфных генов в группе женщин с привычным невынашиванием беременности (I группа) и в группе женщин с физиологическим течением не менее 2 беременностей и не имеющих в анамнезе репродуктивных потерь (II группа). Достоверные различия получены в распределении генотипов и аллелей гена COL1A1: -1997 C>A (rs1107946) и распределении генотипов гена IL8: -251 A>T (rs4073).
По данным литературы, наибольшее число мутаций в гене коллагена I типа связаны с проявлениями несовершенного остеогенеза и чаще связаны с заменой в одном из участков концевой аминокислоты глицин на любую другую [8–12]. Также в редких случаях мутации в гене коллагена I типа обнаруживают при синдроме Эллерса–Данло [12, 13] и Кэффи [14, 15]. Мутации II типа коллагена в основном связаны с офтальмоартропатией [16, 17] и хондродисплазией [18].
Мутации III типа коллагена наиболее изучены при синдроме Эллерса–Данло – наследственном системном заболевании соединительной ткани, вызванным дефектом в синтезе коллагена. В зависимости от отдельной мутации, серьезность синдрома может измениться от умеренного до опасного для жизни. При беременности такие пациентки относятся к группе высокого риска преждевременных родов в связи с излитием околоплодных вод. В связи с тем, что данное заболевание далеко не всегда диагностируется своевременно, представляло интерес изучение полиморфизмов генов коллагена в группе пациенток с развитием истмико-цервикальной недостаточности, преждевременным излитием околоплодных вод, что привело к развитию очень ранних преждевременных родов.
Однако в нашем исследовании достоверные различия мы получили именно в группе женщин с ранними гестационными потерями.
Так, частота генотипа C/С COL1A1: -1997 C>A (rs1107946) при расчете по аутосомно-рецессивной модели была статистически значимо выше в группе контроля (76%), чем в основной группе (51%) (p=0,02, OR=0,32, CI=0,12-0,85), генотип А/А был выявлен лишь в основной группе, где его частота составила 7,1%, но значимых отличий не выявлено, возможно, из-за небольшой выборки. Частота аллеля С в основной группе составила 88%, в контрольной – 72%, частота аллеля А – соответственно 12% и 28% (р=0,01).
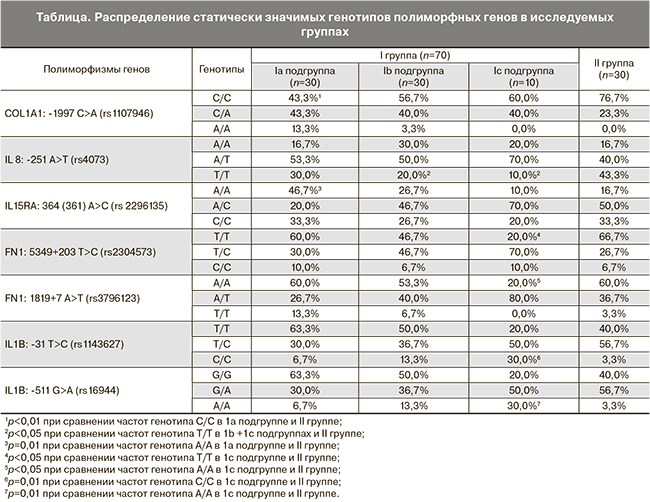
Таким образом, вероятно, генотип С/С COL1A1: -1997 C>A (rs1107946) является протекторным, а генотип А/А, возможно, фактором риска привычных ранних потерь беременности. В связи с тем, что достоверные значения были получены при расчете по аутосомно-рецессивной модели, генотип С/А не является фактором риска невышашивания беременности.
Интерлейкин-8 (IL8) известен как провоспалительный цитокин, индуцирующий хемотаксис фагоцитов и других гранулоцитов в очаг воспаления, а также являющийся промотером ангиогенеза. При беременности IL8 совместно с интерлейкином-6 (IL6) влияет на процессы ремоделирования спиральных артерий и инвазию трофобласта. По данным литературы, уровень этих цитокинов в децидуальной оболочке женщин с гестационными потерями был ниже, чем при физиологическом течении беременности, также изменялась концентрация этих цитокинов и их рецепторов в строме миометрия, клетках трофобласта, эндотелии и гладкомышечных клетках сосудов [19]. Однако полиморфизм гена IL8: -251 A>T (rs4073) изучен лишь при таких заболеваниях, как рак легких и простаты, периодонтит. Мы не встретили данных об исследовании полиморфизма этого гена при привычном невынашивании беременности.
В нашей работе генотип Т/Т IL8: -251 A>T (rs4073) в 2 раза чаще встречался в группе с физиологическим течением беременностей, чем в группе женщин с привычным невынашиванием беременности (43,3 против 22,9%; p=0,04, OR=0,39, CI 0,16–0,97), частота аллеля Т составила соответственно 63 и 50%. Вероятно, генотип Т/Т IL8: -251 A>T (rs4073) может иметь протективное значение при оценке риска невынашивания беременности.
На следующем этапе исследования для проведения более точного анализа мы разделили I группу на подгруппы в зависимости от срока и генеза репродуктивных потерь. Распределение генотипов полиморфных генов, имеющих статистически значимые различия в нашем исследовании, приведены в таблице.
При сравнении распределения генотипов и аллелей гена COL1A1: -1997 C>A (rs1107946) в группе женщин с физиологическим течением беременностей с распределением генотипов и аллелей данного гена во всех остальных подгруппах достоверные отличия выявлены лишь при сравнении с Ia подгруппой. Так частота генотипа С/С в Ia подгруппе была значительно ниже и составила 43,3 против 76,7% в группе контроля (p=0,0084, OR=0,23, CI=0,08–0,71), а генотип А/А выявлялся только у пациенток с ранними потерями беременности (13,3%), но достоверности при расчете не получено, возможно, в связи с небольшой выборкой. Частота аллеля С составила в Ia подгруппе 65%, в группе контроля – 88%, частота аллеля А – 35 и 12% соответственно (p=0,0025). Следовательно, выявленный ранее генотип А/А COL1A1: -1997 C>A (rs1107946), возможно, является фактором риска только ранних гестационных потерь.
IL-15 – цитокин, влияющий на активацию и пролиферацию Т-клеток, подобно IL-2. Показано усиление лимфопролиферативного эффекта при наличии комплекса IL-15/IL-15RA (то есть связанного с растворимым α-рецептором IL-15) [20]. В литературе встречаются данные об исследовании гена IL-15 в гастроэнтерологии (у больных целиакией). Мы не встретили данных об исследовании этого полиморфизма при невынашивании беременности.
Согласно полученным данным, при сравнении Ia подгруппы с контрольной группой были выявлены достоверные различия в распределении генотипов и аллелей гена рецептора интерлейкина-15 – IL15RA: 364 (361) A>C (rs2296135).
В нашем исследовании генотип А/А IL15RA: 364 (361) A>C (rs2296135) почти в 3 раза чаще встречался у женщин с привычными ранними потерями беременности по сравнению с контрольной группой (46 против 16,7%) (p=0,01, OR=4,38, CI 1,32-14,5). Частота аллеля А в Ia подгруппе составила 57%, в группе контроля – 42%, но в распределении аллелей достоверности не получено. Аналогичные данные получены при сравнении с группой с поздними гестационными потерями (Ib и Ic подгруппы). Таким образом, генотип А/А IL15RA: 364 (361) A>C (rs2296135), возможно, является генетическим фактором, предрасполагающим к привычным ранним потерям беременности.
При сравнении распределения генотипов и аллелей полиморфных генов у женщин с поздними репродуктивными потерями (Ib и Ic подгруппы) и женщин с физиологическим течением беременности достоверные отличия получены для генов фибронектина FN1: 5349+203 T>C (rs2304573), IL8: -251 A>T (rs4073).
Фибронектины взаимодействуют с другими белками внеклеточного матрикса и клеточными лигандами, такими как коллаген, фибрин, и интегрины, участвуют в процессах адгезии и миграции клеток. Существуют в виде двух основных форм: нерастворимой – в виде фибриллярной сети на клеточной поверхности и во внеклеточном матриксе и растворимой формы в крови [21]. Нерастворимая форма также участвует в механизмах адгезии и миграции хориона [22]. Также отмечено протекторное действие фибронектина в отношении индуцированной фактором некроза опухоли-α цитотоксичности на трофобласт [23].
По нашим данным генотип Т/Т FN1: 5349+203 T>C (rs2304573) достоверно чаще встречался в контрольной группе, чем в группе с поздними потерями – 66,7 против 40% (p=0,03, OR=0,33, CI=0,12-0,9), частота аллеля T составила соответственно 80 и 0,66%.
Вероятно, генотип Т/Т FN1: 5349+203 T>C (rs2304573) является протективным генотипом при оценке риска поздних репродуктивных потерь.
В группе с поздними потерями частота генотипа Т/Т IL8: -251 A>T (rs4073) была статистически значимо ниже – 17,5 против 43,3% (p=0,018, OR=0,28, CI=0,09-0,82), в то время как частота генотипа А/А была выше практически вдвое и составила 27,5% по сравнению с 16,7% в контрольной группе (результаты близки к достоверным). Частота аллеля А составила 55 против 73% в группе контроля. Следовательно, вероятно, носительство генотипа А/А полиморфного гена IL-8: -251 A>T (rs4073) следует рассматривать в качестве фактора, предрасполагающего к поздним репродуктивным потерям, а генотип Т/Т – как протекторный фактор.
При сравнении распределения аллелей полиморфных генов в подгруппе женщин, имеющих в анамнезе антенатальную гибель плода (Ic подгруппа), с группой контроля были выявлены достоверные отличия в FN1: 5349+203 T>C (rs2304573), FN1: 1819+7 A>T (rs3796123), IL1B: -31 T>C (rs1143627), IL1B: -511 G>A (rs16944).
Генотип Т/Т FN1: 5349+203 T>C (rs2304573) у женщин с антенатальной гибелью плода встречался более чем в 3 раза реже по сравнению с группой контроля и составил 20 против 66,7% (p=0,01, OR=0,13, CI=0,02–0,7), частота аллеля Т в Ic подгруппе составила 55%, в контрольной группе – 80% (p=0,02). Та же тенденция прослеживалась при сравнении Ic подгруппы с подгруппой женщин с ранними гестационными потерями (Ia подгруппа). Вероятно, генотип Т/Т FN1: 5349+203 T>C (rs2304573) может играть роль протекторного генотипа для оценки риска антенатальной гибели плода.
Также генотип А/А FN1: 1819+7 A>T (rs3796123) встречался у женщин с антенатальной гибелью плода в 3 раза реже по сравнению с контрольной группой – 20 против 60% (p=0,02, OR=0,17, CI=0,03–092), частота аллеля А составила соответственно 60 и 78%. Это также свидетельствует о возможном протекторном значении генотипа А/А FN1: 1819+7 A>T (rs3796123) при оценке риска антенатальной гибели плода.
IL1B был открыт Igal Gery в 1972 году и назван ЛАФ (фактор, активирующий лимфоциты), так как обладал митогенной активностью в отношении лимфоцитов; позже, в 1985 г., доказали, что IL-1 состоит из двух отдельных белков – IL-1A и IL-1В [24].
Этот цитокин продуцируется активированными макрофагами и является важным медиатором воспалительного ответа и принимает участие во многих клеточных механизмах, включая пролиферацию, дифференцировку и апоптоз клеток [25–27].
В литературе имеются противоречивые данные по поводу связи полиморфизмов гена IL1B с невынашиванием беременности. Так, британские ученые не выявили значимых различий в полиморфизме гена IL1B: -511 G>A [28], как и индийские ученые, которые не нашли достоверных отличий в распределении генотипов генов IL-1 (а и В), а также гена IL1RA [29]. Однако в исследовании американских ученых доказана роль гомозиготных генотипов IL1B -511C/С и -31T/Т при привычном невынашивании беременности [30].
В нашем исследовании генотип С/С IL1B: -31 T>C (rs1143627) был почти в 10 раз выше в группе с антенатальной гибелью плода в анамнезе – 30 против 3,3% (p=0,01, OR=12,43, CI=1,12–138), частота аллеля С соответственно составила 55 и 32%.
Генотип А/А IL1B: -511 G>A (rs16944) почти в 10 раз чаще встречался в Ic подгруппе по сравнению с контролем – 30 против 3,3% (p=0,01, OR=12,43, CI=1,12–138), частота аллеля А составила 55 и 32% соответственно (данные близки к достоверным). Таким образом, видно, что генотипы Т/Т FN1: 5349+203 T>C (rs2304573), А/А FN1: 1819+7 A>T (rs3796123) могут являться протекторными, а генотипы С/С IL1B: -31 T>C (rs1143627) и А/А IL1B: -511 G>A (rs16944) – факторами риска антенатальной гибели плода.
Заключение
При анализе результатов исследования выявлены возможные протекторные генотипы, а также генотипы, наличие которых может свидетельствовать о предрасположенности к невынашиванию беременности на различных гестационных сроках.
Так, вероятно, наличие генотипа С/С COL1A1: -1997 C>A (rs1107946) является протективным, а генотип А/А этого гена, возможно, является фактором риска привычных ранних потерь беременности, как и носительство генотипа А/А IL15RA: 364 (361) A>C (rs2296135).
Генотип А/А IL8: -251 A>T (rs4073), возможно, является фактором риска поздних репродуктивных потерь, в то время как генотип Т/Т этого гена – протекторным фактором, как и генотип Т/Т FN1: 5349+203 T>C (rs2304573).
Генотипы С/С IL1B: -31 T>C (rs1143627) и А/А IL1B: -511 G>A (rs16944), возможно, предрасполагают к антенатальной гибели плода во II и III триместрах, а генотипы Т/Т FN1: 5349+203 T>C (rs2304573) и А/А FN1: 1819+7 A>T (rs3796123), вероятно, являются протекторными.
Необходимо дальнейшее проведение исследований для определения роли генетических полиморфизмов в предрасположенности к привычным потерям беременности. Выявление индивидуальных причинных факторов и патогенетических механизмов, лежащих в основе привычных потерь беременности, в будущем позволит прогнозировать гестационные осложнения, своевременно проводить превентивные мероприятия на основании индивидуализированного подхода к терапии.



