Все фетальные вмешательства можно разделить на лечебные, к которым относятся фетоскопические процедуры при осложненной монохориальной многоплодной беременности, и паллиативные операции при пороках развития плода, когда вмешательство не приводит к радикальному лечению порока, а лишь позволяет предотвратить развитие необратимых нарушений. Эффективность последних требует дальнейшего изучения, как непосредственных, так и отдаленных результатов. Однако фетальная хирургия быстро развивается, что может улучшить исход лечения отдельных пациентов и изменить естественное течение заболевания.
Акушерские эндоскопические вмешательства при осложненной монохориальной многоплодной беременности
Монохориальные двойни составляют 20% всех многоплодных беременностей. В сравнении с дихориальными, при монохориальной многоплодной беременности имеется больший риск потери плода, преждевременных родов, перинатальной заболеваемости и смертности. Некоторые осложнения можно лечить хирургически в антенатальном периоде [1–4].
Фето-фетальный трансфузионный синдром и фетоскопическая лазерная коагуляция сосудистых анастомозов плаценты
Синдром близнецовой трансфузии развивается у 8–15% монохориальных двоен [4]. Состояние проявляется трансфузией крови от близнеца-донора, у которого развиваются гиповолемия, олигурия и маловодие, к близнецу-реципиенту, у которого развиваются гиперволемия, полиурия и многоводие. У последнего формируются перегрузка объемом и водянка. Это приводит к появлению некоторых характерных эхографических признаков, которые используют в диагностике данного состояния. Диагноз требует обнаружения маловодия (максимальный вертикальный карман менее 2 см) у плода-донора, а также многоводия у плода-реципиента. Последнее в Европе определяют как максимальный вертикальный карман >8 см в 20 недель или ≥10 см при сроке более 20 недель [5]. В США используется критерий в 8 см независимо от срока беременности. Большинство случаев диагностируют между 16-й и 26-й неделями беременности. Наличие фето-фетального синдрома требует лечения сразу после обнаружения, но процедура эффективна и в более позднем сроке [6]. Заболевание считают прогрессирующим с очень плохим исходом (85% потери беременности) при отсутствии лечения.
Поскольку считается, что состояние развивается из-за формирования артерио-венозных анастомозов плаценты, наиболее обоснованным подходом лечения является коагуляция анастомозов. Имеются различия в технике выполнения операции, вмешательство также выполняют с различной степенью селективности [7–9]. Коагуляция может нарушить состояние плода из-за повреждения котиледонов, а селективная аблация может быть причиной воздействия не на все поврежденные сосуды, что предопределяет рецидив, антенатальную гибель и анемию плода [10]. Идеально плацента после аблации должна стать «бихориальной» [11]. Фетоскопическая лазерная процедура выполняется трансабдоминально под местной или местно-региональной анестезией. Троакар диаметром 2,3–3,3 мм вводят под эхографическим контролем в амниотическую полость плода-реципиента, одновременно вводят 2 мм эндоскоп с проводником лазерной энергии (400–600 μm). Коагуляцию осуществляют бесконтактно, процедуру завершают амниоредукцией до достижения нормального количества околоплодных вод. К осложнениям лазерной коагуляции анастомозов плаценты относятся: кровотечение (2%), отслойка плаценты (1%) [12], инфекционные осложнения [13], прерывание беременности, преждевременное излитие околоплодных вод (8–28%) (таблица). Другим нехарактерным осложнением является развитие у матери зеркального синдрома (синдрома Ballantyne) с отеком легких. Укорочение шейки матки к моменту окончания операции является признаком угрозы преждевременных родов [14].
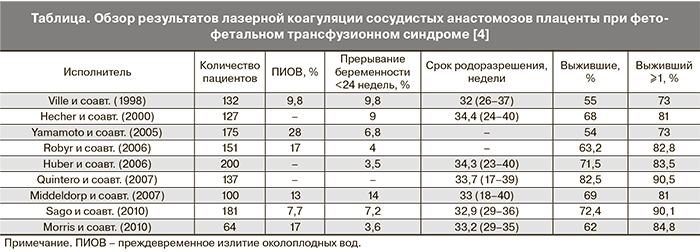
При оценке результата учитывают выживаемость хотя бы одного близнеца к возрасту 6 месяцев и неврологический статус детей. Срок родоразрешения после проведенной лазерной коагуляции составил в среднем 33,3 недели гестации, роды после серийной амниоредукции происходили в сроке 29 недель [15]. Выживаемость после аблации также была выше (76,4 против 51,4%; RR=1,49) [15]. Риск гибели плода после амниоредукции – 49% для двух близнецов и 26% для одного. Гибель плодов после лазерной коагуляции происходила в 10% случаев, гибель одного плода (чаще реципиента) – в 18% случаев [15]. Частота смерти плода после аблации коррелирует с нарушением плодово-плацентарного кровотока до момента операции [16]. G. Chalouhi и соавт. показали, что исходы зависят от опыта врача, что говорит в пользу концентрации пациенток в специализированных клинических центрах [4]. Несмотря на то что лазерная коагуляция эффективна при любом сроке беременности, имеется четкая корреляция выживаемости плодов со степенью выраженности синдрома. Выживание обоих плодов составляет 76% для I степени (классификация Quintero), 60% – для II степени, 54% – для III степени и 50% – для IV степени. Один плод выживает в 93% случаев при I степени, в 83% – при II степени, в 83% – при III степени и в 70% – при IV степени [17]. Превращение плаценты в «бихориальную» и более поздние сроки родоразрешения могут защищать от неврологических осложнений у плодов. В неконтролируемом исследовании было показано, что 6% детей на 3-м году жизни имеют неврологический дефицит после аблации и 20–25% – после амниотического дренажа [18]. Недавнее исследование, проведенное в Париже, сравнивало 137 детей после аблации или амниодренажа, в контрольную группу вошли бихориальные двойни [19]. Плохие исходы (смерть или повреждение центральной нервной системы) чаще имели место после амниоредукции по сравнению с группой, в которой использована лазерная коагуляция, и в сравнении с контролем.
Эндоскопическая окклюзия пуповины под контролем эхографии
Дети из монохориальных двоен чаще имеют пороки развития и чаще дискордантны по ним (80%). Они также могут быть дискордантны по анеуплоидии [20]. С целью предотвращения прерывания беременности и рождения детей с летальными аномалиями развития предпочтительно выполнять фетоцид больного плода. Другим осложнением у двоен является синдром «плода без сердца» или синдром обратной артериальной перфузии. Функционально кровоток у аномального плода осуществляется за счет сердечной деятельности здорового, при этом есть риск развития сердечной недостаточности у последнего и водянки примерно в 50% случаев. Процедура редукции обычно включает внутрикардиальное введение раствора хлорида калия, что невозможно у монохориальных двоен. Поэтому артериальный и венозный кровоток прекращают путем коагуляции сосудов пуповины акардиального плода. Фетоскопия может быть использована, но оптимальнее выполнять процедуру под эхографическим контролем. Процедура выполняется через иглы диаметром 18 g. Выживаемость при коагуляции пуповины достигает 78–84% [21, 22]. Перинатальная потеря здорового ребенка может происходить из-за ущемления пуповины в искусственно созданном отверстии в оболочках или из-за дородового излития вод и рождения недоношенного ребенка. В том же исследовании показано значение опыта врача (значительное уменьшение числа осложнения после выполнения врачом 40-й операции) [23–25].
Другие осложнения у двоен и фетоскопические операции
Другим осложнением монохориальных двоен является синдром селективной задержки роста одного из плодов, что имеет место у 7–20% близнецов, который характеризуется разницей в предполагаемой массе плодов более 25% и изменениями кровотока по данным эхографии. Такие плоды имеют более высокий риск внутриутробной гибели и неврологической заболеваемости [26–28]. Риск перинатальных осложнений коррелирует со степенью нарушения фето-плацентарного кровотока, которая обусловлена особенностями строения плаценты [29]. В случае ухудшения состояния плода с задержкой роста, наличия реверсного кровотока в венозном протоке, отсутствия динамики роста, нарастания маловодия и отсутствия визуализации мочевого пузыря риск антенатальной гибели крайне высок. В такой ситуации с целью профилактики неврологических осложнений второго плода некоторые авторы рекомендуют проведение фетоцида близнеца с задержкой роста путем коагуляции сосудов пуповины [30]. В настоящее время отсутствует определенность относительно показаний к такого рода вмешательствам.
Эндоскопические операции при аномалиях развития плода
Изолированная врожденная диафрагмальная грыжа
Одним из наиболее грозных пороков развития плода является врожденная диафрагмальная грыжа. Этот дефект возможно исправить оперативно в постнатальном периоде, но проблема состоит в том, что во внутриутробном периоде происходит развитие тяжелой гипоплазии легочной ткани, которая в 30–40% приводит к гибели ребенка из-за вентиляционных нарушений и легочной гипертензии [31]. Диагноз чаще ставят во втором триместре, при этом проводят обследование на сопутствующие аномалии развития и генетическое тестирование. Для визуализации применяют ультразвуковое исследование с целью оценки размеров поражения и особенностей васкуляризации. Наиболее информативным показателем для прогнозирования исхода является так называемое легочно-головное соотношение, для вычисления которого используют определение размеров контралатерального легкого в стандартном сечении грудной клетки при эхографии [32]. Коэффициент вычисляют как соотношение реально полученного числа с должным, при этом показатель не зависит от срока гестации и применяемой техники визуализации [33]. При соотношении реальное/ожидаемое (O/E LHR) <15% плод имеет предельно тяжелую гипоплазию легочной ткани, при которой случаев выживания в литературе не описано. При соотношении в интервале 15–25% можно говорить о тяжелой гипоплазии, при которой выживаемость составляет около 15%. При лучших показателях выживаемость составляет 60% и более.
Первый успешный случай фетальной хирургии при врожденной диафрагмальной грыже был описан в 1990 г. и заключался в непосредственной пластике дефекта [34]. Учитывая хороший исход, в последующем проводились активные разработки по внутриутробной коррекции порока и совершенствованию технических возможностей на моделях животных. Однако последующие исследования не продемонстрировали снижения неонатальной заболеваемости и смертности [34]. В частности, при варианте врожденной диафрагмальной грыжи с пролабированием печени в грудную полость, высок риск осложнений (перегиб пупочной вены и смерть плода). Среди вариантов врожденной диафрагмальной грыжи без вовлечения печени пренатальная коррекция не повысила уровень выживаемости, и такая тактика не нашла должного распространения. Следующий шаг в развитии внутриутробной терапии для врожденной диафрагмальной грыжи – это обратимая окклюзия трахеи плода [34]. На животных было продемонстрировано, что обструкция трахеи приводит к задержке секреции и растяжению легочной ткани и в последующем к росту самих легких, воздухоносных путей и трахеи. Фетальная окклюзия трахеи проводилась открытым способом – гистеротомия, визуализация и растяжение шеи плода, срединная секция шеи для выделения трахеи и окклюзия ее 2 полуклипсами в разных направлениях [35]. Эта техника сопровождалась большим количеством преждевременных родов и необратимым повреждением (кровоизлиянием) гортанного нерва и трахеи. Выживаемость плодов без хирургического лечения была нулевой, а после хирургии составила 33%. Для минимизации риска беременной и плода в конце 90-х годов перешли к эндоскопической технике [36, 37], для чего стали использовать баллон внутри просвета трахеи, который менял форму и мог быть удален пренатально [38, 39].
Рост легких после фетального вмешательства в экспериментальных исследованиях на животных обеспечивал адекватную оксигенацию при рождении, объем легких увеличивался на 2,5 перцентиля через 2 и 7 дней после процедуры [40]. Также увеличивалось соотношение легкие/голова от 0,7 (до эндоскопии) до 1,8 через 2 недели после процедуры. Эхогенность легких повышалась в течение 48 ч после операции [41]. Однако результаты такого вмешательства были противоречивы применительно к человеческим плодам. В 2003 г. Harrison и соавт. опубликовали рандомизированное исследование, в котором 11 женщин подверглись окклюзии трахеи плодов, а 13 других велись консервативно [42]. Выживаемость в пролеченной во внутриутробном периоде группе составила 73%, среди нелеченных – 77%. Трое детей контрольной группы погибли, в том числе двое – до операции, а все, кто был пролечен внутриутробно, дожили до хирургической коррекции в постнатальном периоде. Авторы сделали вывод, что окклюзия трахеи плода не приводит к улучшению выживаемости и заболеваемости. В 2004 г. J. Deprest и соавт. опубликовали данные об операциях чрескожной фетоскопической трахеальной окклюзии через естественные отверстия (Fetoscopic Endoluminal Tracheal Occlusion (FETO)) [41]. Выбор пациенток был ограничен случаями изолированной грыжи у плодов с соотношением O/E LHR <27% и смещением печени. Для размещения баллона между кариной и голосовыми связками при фетоскопии применяли инструмент диаметром 3,3 мм, под эхографическим контролем, в сроке беременности от 26 до 28 недель. Баллон удаляли на 34-й неделе при фетоскопии, или при пункции под контролем эхографии, что стимулировало созревание легкого и создавало условия для родоразрешения через естественные родовые пути. В случае преждевременных родов необходимо ускорить процесс удаления баллона (процедура экстракции FETO). Выживаемость на момент выписки составила 50–57%, что соответствует аналогичному показателю для случаев тяжелой гипоплазии легочной ткани [43]. Материнских осложнений отмечено не было, за исключением наблюдений дородового излития околоплодных вод. В таких случаях пациентки транспортируются в специализированный̆ центр, в котором есть условия для извлечения баллона при первой необходимости. Большинство пациенток рожали после 34-й недели беременности (в среднем на 36-й неделе). В 2009 г. был описан опыт лечения 210 плодов с врожденной диафрагмальной грыжей [44]. Показаниями для операции было пролабирование печени и соотношение легкие/голова <1. Успешная установка баллона выполнена в 97% случаев. В остальных случаях были осложнения, которые касались положения плода или его состояния, а также разрыв трахеи в одном случае. У 8% плодов в последующем баллон не был визуализирован из-за его спонтанной дислокации. Маточное кровотечение и хориоамнионит возникли у 1 из 6 пациенток. Выживаемость составила 48% (на момент выписки из роддома). Авторы пришли к выводу, что фетоскопическая трахеальная окклюзия приводит к значительному улучшению выживаемости. Важным аспектом процедуры является дородовое удаление окклюдера из трахеи плода. Выживаемость детей выше при дородовом извлечении баллона по сравнению со случаями извлечения баллона после родов (83 против 33%).
Обструкция нижних отделов мочевыделительного тракта
Наиболее частая причина обструкции мочевыводящих путей – это патология клапана задней уретры, который представлен складкой слизистой оболочки и возникает в 1% всех беременностей и у 1:8000–25000 живорожденных [45]. Эта патология приводит к обструкции мочевого пузыря, пузырно-мочеточниковому рефлюксу, дисфункции почек и хронической почечной недостаточности. Фетальные вмешательства представлены центезом мочевого пузыря, шунтированием мочевого пузыря в амниотические воды и лазерной аблацией этого клапана.
Пузырно-амниотическое шунтирование было впервые выполнено в 1982 г. [46]. Цель операции – сохранить функцию почек, восстановить нормальную продукцию амниотической жидкости и улучшить развитие легких. В 16 исследованиях были продемонстрированы результаты таких операций [46]. Выживаемость в отдаленные сроки составила 88%. В 75% исследований была доступна информация о возможных осложнениях подобных операций. Так, в 4 из 210 (2%) случаев попытка дренирования мочевого пузыря не была успешной. В 28 из 206 успешных операций возникли осложнения, наиболее грозное из них – послеоперационная гибель плода, хориоамниониит, фистулы и ятрогенный гастрошизис. Редко возникала дислокация шунта мочевого пузыря, что приводило к развитию асцита. Нормализовалась функция почек у 73% выживших, а 12% потребовали дополнительного хирургического вмешательства после рождения. Выживаемость в исследуемой группе была сравнимой с контрольной группой (66% у оперированных и 62% у контрольной группы).
Следующим методом внутриутробной хирургической коррекции обструкции нижних отделов мочевыводящих путей является аблация клапана задней уретры фетоскопическим доступом. Фетоскопическая аблация клапана позволяет напрямую визуализировать место обструкции. Эта операция не требует постановки цистостомы и минимизирует такие осложнения, как окклюзия шунта, его смещение, асцит и гастрошизис. Однако возможны кровоизлияния в предстательную железу и повреждения сфинктера. Основным ограничением данной операции является определение группы пациентов, у которых она будет эффективной, и недостаточно подготовленная техническая база [47].
Не менее важны отдаленные результаты. Они представлены у 20 мальчиков, перенесших внутриутробную операцию пузырно-амниотического шунтирования в течение 5,83 года после операции [48]. У 45% обследованных пациентов в отдаленные сроки была отмечена нормальная функция почек, у 22% – умеренная дисфункция, 33% потребовали диализа и пересадки почек.
Оптимального метода ведения пациентов с обструкцией нижних отделов мочевыводящих путей (хирургия разных видов или консервативное лечение) на сегодняшний день не найдено [49]. В любом случае родители должны быть предупреждены, что хирургия имеет лишь временный эффект, целью которого является поддержание адекватного объема околоплодных вод, но проблема радикально не устраняется.
Заключение
Подводя итоги, следует отметить, что хирургия плода достаточно безопасна и все больше входит в клиническую практику. Нерешенными проблемами являются определение оптимальных сроков вмешательства, показаний и доступ к мультицентровым рандомизированным клиническим исследованиям. Фетоскопия дает стимул к развитию новых методов лечения. Фетальная хирургия очень прогрессивна, что заставляет клинические центры внедрять ее все шире. Существуют методы хирургии плода, доказавшие свою эффективность, тогда как фетоскопические вмешательства при другой патологии (диафрагмальная грыжа, обструкция мочевыводящих путей) нуждаются в дополнительном изучении эффективности и оптимизации хирургической тактики.



