Всемирная организация здравоохранения (ВОЗ) два десятилетия назад определила общемировую Глобальную стратегию по сдерживанию употребления антибактериальных препаратов: «…без согласованных и незамедлительных действий в глобальных масштабах мир приблизится к “пост-антибиотической” эре, когда самые обычные инфекции снова станут смертельными» [1, 2].
Поводом для этого послужило массовое «увлечение» антибиотиками, которое, подобно эпидемии, запустило неуправляемый процесс формирования антибиотикорезистентности – нечувствительности или устойчивости возбудителей инфекционных болезней к назначаемым для борьбы с ними антибактериальным препаратам.
Стратегия ВОЗ определила схему вмешательств, препятствующих распространению микроорганизмов, стойких к антибактериальным препаратам:
- снизить заболеваемость и распространение инфекций;
- улучшить доступ к соответствующим противомикробным препаратам;
- улучшить применение противомикробных препаратов;
- усилить системы здравоохранения и их способности к наблюдению;
- укрепить регулирование законодательства;
- поддерживать развитие соответствующих новых медикаментов и вакцин.
Спустя 15 лет результаты оказались неутешительными – систематическое нерациональное применение антибиотиков в медицине человека и производстве пищевых продуктов не только не остановилось, а привело к селекции и распространению бактерий с множественной лекарственной устойчивостью – мультирезистентных суперпатогенов, эффективно «спасающихся» от действия практически всех антибактериальных препаратов [3–5].
Обеспокоенная этим кризисом, Всемирная ассамблея здравоохранения в мае 2015 г. приняла Глобальный план действий по борьбе с устойчивостью к противомикробным препаратам, в котором пять целей были направлены на обеспечение профилактики и лечения инфекционных болезней с помощью безопасных и эффективных лекарств [6].
Актуальность сохраняющегося нерационального применения противомикробных препаратов подчеркивают сегодняшние реалии. Глобальную ежегодную смертность от самых распространенных лекарственно-устойчивых штаммов инфекций оценивают минимум в 700 000 человек. Предупреждения ВОЗ еще более тревожны: если ситуация не изменится, то 100 млн человек к 2030 г. умрут преждевременно, а через 35 лет эта цифра достигнет 300 млн. Мировая ежегодная смертность из-за последствий антибиотикорезистентности достигнет к 2050 г. 10 млн человек [7–9].
Антибиотикоустойчивость представляет собой междисциплинарную и межгосударственную проблему, для эффективного решения которой как на госпитальном, так и на амбулаторном уровнях необходимо объединение врачей разных специальностей для разработки совместных мер по ее преодолению [10].
Рост устойчивости микроорганизмов к антибиотикам на фоне относительной стагнации в создании новых препаратов ставит перед акушером-гинекологом достаточно сложную клиническую задачу. Большинство заболеваний, сопровождающихся патологическими выделениями из половых путей, инициированы несколькими типами условно-патогенных возбудителей, нередко включая и грибы-комменсалы. Лекарственное средство для местной терапии вульвовагинитов должно «перекрывать» весь спектр вероятных возбудителей за счет комбинации в его составе нескольких разнонаправленно действующих веществ.
Нередко при первом посещении врача по поводу зуда, обильных выделений, жжения во влагалище лечение назначают лишь половине обратившихся. Остальным пациенткам приходится либо испытывать мучительный дискомфорт в ожидании результатов обследования, либо самостоятельно применять противомикробные средства, от которых их состояние не только не улучшается, а приводит к формированию лекарственной устойчивости условно-патогенных и сапрофитных представителей влагалищной микробиоты.
С учетом роста общего уровня резистентности патогенов к антимикробным препаратам с особой остротой встает вопрос выбора адекватной эмпирической терапии, с оптимальным профилем безопасности, которую можно назначить женщине с патологическими выделениями из половых путей на основании только клинических данных и быть уверенным в ее целенаправленном действии на большинство возбудителей в очаге поражения.
С целью получения новых данных об эффективности эмпирической терапии острого неспецифического вульвовагинита у женщин репродуктивного возраста препаратом «Тержинан» в рутинной клинической практике проведено многоцентровое пострегистрационное наблюдательное исследование «ТЕРРА».
Материалы и методы
В исследование были включены 430 пациенток репродуктивного возраста от 18 до 44 лет (средний возраст 28,4±0,5 года), наблюдавшихся в медицинских центрах из 17 регионов России с диагнозом «острый вульвовагинит».
Пациентки, включенные в исследование, отвечали нижеперечисленным критериям: возраст от 18 до 44 лет включительно; клинически верифицированный диагноз «вульвовагинит»; письменное информированное согласие пациентки на участие в исследовании.
Критериями исключения были следующие: гиперчувствительность к одному или нескольким компонентам препарата «Тержинан»; прием антисептиков, антимикотиков, антибиотиков и бактериофагов на момент включения и менее чем за 30 дней до начала исследования; необходимость системного применения глюкокортикоидов, цитостатиков и системных антибиотиков; состояния, ограничивающие приверженность проводимой терапии (деменция, психоневрологические заболевания, наркомания, алкоголизм и т.д.); документально подтвержденная ВИЧ-инфекция, сифилис и другие инфекции, передаваемые половым путем (хламидийная инфекция, гонорея, трихомониаз), выявленные на этапе скрининга, инфицирование вирусом простого герпеса 1 и 2 типов; острые и хронические соматические заболевания, которые, по мнению исследователя, могут оказывать влияние на общее состояние пациентки в период исследования, общий прогноз, результаты проводимого лечения, а также на приверженность пациентки к проводимому лечению; одновременное участие в другом клиническом исследовании; период беременности или грудного вскармливания.
Наблюдение за пациентками включало последовательные визиты. На 1-м визите/1-й день (скрининг, включение в исследование) получали письменное информированное согласие пациентки; осуществляли проверку соответствий критериям включения; оценивали критерии исключения. Фиксировали исходные антропометрические, социальные, клинико-анамнестические данные. После осмотра и взятия материала для анализов (бактериоскопия и рН-метрия влагалищной жидкости, анализ методом полимеразно-цепной реакции (ПЦР) в режиме реального времени (Фемофлор-16)) на основании жалоб, клинических симптомов пациенткам сразу же назначали эмпирическую терапию комплексным антимикробным препаратом «Тержинан» (тернидазол + неомицин + нистатин + преднизолон), согласно утвержденной инструкции (1 раз в сутки во влагалище на протяжении 10 дней).
На 2-м визите/10-й (+5) день (последующее наблюдение, контроль излеченности в течение 5 дней после завершения 10-дневной терапии препаратом «Тержинан») проводили повторное гинекологическое обследование, оценивали динамику клинических симптомов, показатель рН и микробный пейзаж отделяемого влагалища. Регистрировали фактическую длительность применения препарата «Тержинан»; удовлетворенность и комплаентность терапии; нежелательные явления (НЯ), связанные с приемом Тержинана, долю пациенток с полным излечением, а также случаи неэффективности терапии, общие результаты удовлетворенности пациенток по шкале IMPSS.
Пациентки с нормоценозом влагалища после 10-дневного лечения препаратом «Тержинан» завершали участие в исследовании.
Пациентки с диагностированным кандидозным вульвовагинитом (количественное определение Candida albicans в отделяемом из влагалища ≥105 КОЕ/мл) на 2-м визите продолжали локальную терапию антимикотическим препаратом с последующей оценкой излеченности на 3-м визите/18-й день (+14–21).
Все выполняемые медицинские процедуры в рамках проведения исследования являлись рутинными, используемыми в повседневной клинической практике, что определило неинтервенционный (наблюдательный) характер исследования.
Результаты и обсуждение
Средний возраст исследуемых пациенток составил 28,4±0,5 года. Больше половины женщин – 262/430 (60,9%) были незамужними.
Перенесенные заболевания органов репродуктивной системы отметили 311 (72,3%) пациенток: на доброкачественные состояния шейки матки указали 235 (75,5%) женщин, на дисменорею – 89 (28,6%). Эпизоды острого воспаления органов малого таза, в том числе сексуально-трансмиссивные инфекции в анамнезе, зарегистрированы у 146 (46,9%) исследуемых, дисбиотические нарушения влагалищной микробиоты – у 194 (62,4%).
Заболеваниями мочевой системы страдали 122 (28,4%) пациентки, желудочно-кишечного тракта – 75 (17,4%), дыхательных путей – 44 (10,2%).
На момент обращения за медицинской помощью характер жалоб и клинических симптомов острого вульвовагинита были типичными: влагалищные выделения с неприятным запахом отмечали 320 (74,5%) пациенток, зуд и жжение во влагалище – 289 (68,0%).
Гиперемия и отек слизистой влагалища, серый налет на его стенках при объективном осмотре выявлены у большинства – 412 (96,0%) пациенток. Пенистые выделения диагностированы у 218 (50,7%) больных, творожистые – у 93 (21,6%), гноевидные – у 83 (19,3%). Умеренными выделения были у 180 (41,9%) исследуемых, обильными – у 135 (31,4%), скудными – у 111 (25,8%).
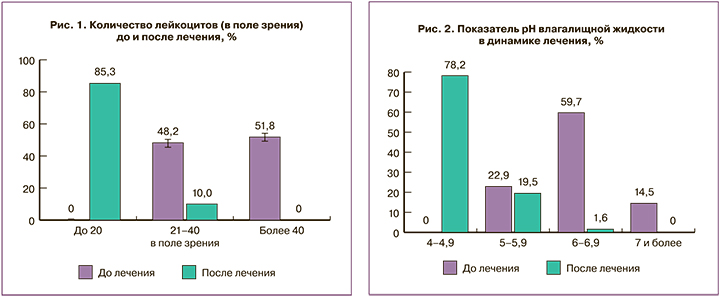
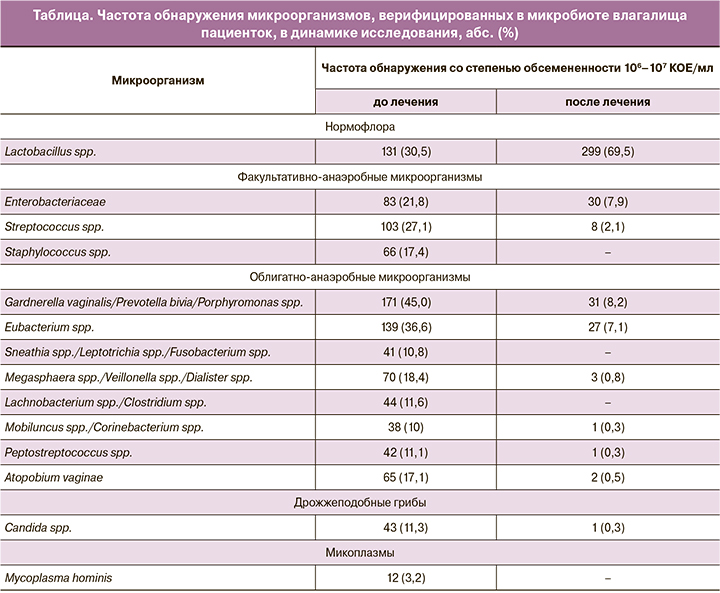
Бактериоскопия влагалищных выделений до лечения показала выраженную воспалительную реакцию, характеризующуюся высоким количеством лейкоцитов, у 223 (51,8%) больных, наличие ключевых клеток выявлено у 288 (67,1%) исследуемых, а смещение значений pH влагалищной среды в щелочную сторону диагностировано у 311 (74,2%) пациенток.
Результаты ПЦР в режиме реального времени продемонстрировали превалирование во влагалищной микробиоте условно-патогенных микроорганизмов в клинически значимых концентрациях (таблица). Структуру дисбиоза представляли в основном облигатно-анаэробные микроорганизмы, среди которых наибольшей этиологической значимостью в развитии воспалительного процесса обладали ассоциации Gardnerella vaginalis, Prevotella bivia, Porphyromonas spp. (45,0%), а также Eubacterium spp. (36,6%). У 11,3% пациенток в спектр микробного пейзажа были вовлечены дрожжеподобные грибы рода Candida в концентрациях, превышающих физиологическую норму. Нормальные симбионты – Lactobacillus spp. влагалищной микробиоты в титрах 106–107 КОЕ/мл были идентифицированы только в 30,5% случаев.
Анализ эффективности эмпирической терапии острого неспецифического вульвовагинита препаратом «Тержинан» показал отсутствие жалоб на патологические влагалищные выделения на 2-м визите/10-й (+5) день у 100,0% пациенток. На значительное уменьшение объема влагалищных выделений указали 415 (96,5%) женщин, на полное исчезновение неприятного запаха, ощущений зуда и жжения во влагалище – соответственно 320 (74,5%) и 289 (67,2%) пациенток.
При объективной оценке нормализация окраски стенок влагалища, умеренный объем и «слизистый» характер выделений отмечены у 100,0% женщин.
У большинства пациенток бактериоскопия влагалищных мазков после проведенной эмпирической терапии выявила существенное снижение количества лейкоцитов в поле зрения (рис. 1). Состояния «нормоценоз» и «промежуточный тип» отмечены у большинства женщин (у 147 (34,2%) и 245 (57,0%) соответственно).
Показатель pH влагалищной жидкости значимо снизился и соответствовал диапазону от 4,0 до 4,9 Ед у 336 (78,2%) женщин (рис. 2).
Результаты ПЦР (Фемофлор-16) по итогам эмпирической терапии острого неспецифического вульвовагинита препаратом «Тержинан» показали значительное снижение концентраций условно-патогенных микроорганизмов влагалищной микробиоты, в основном за счет облигатно-анаэробных представителей (см. таблицу). Частота верификации клинически значимого уровня ассоциаций Gardnerella vaginalis+Prevotella bivia+Porphyromonas spp., а также Eubacterium spp. снизилась после лечения в 5 раз. Доля клинически значимого уровня факультативно-анаэробных бактерий (Enterobacteriaceae и Streptococcus spp.) в исследуемом локусе сократилась в 3 раза, дрожжеподобных грибов рода Candida – в 2 раза. Микоплазмы после лечения не выявлены ни в одном наблюдении (см. таблицу).
Эмпирическая терапия препаратом «Тержинан» не вызвала нежелательных явлений, была безопасной и отличалась высокой комплаентностью.
Определяющим в решении проблемы антибиотикорезистентности является рационализация их использования. Комплекс необходимых для этого мероприятий обозначен как управление антибиотикотерапией (Antibiotic Stewardship) и представлен в рекомендациях ВОЗ [11].
Заключение
Проведенное исследование «ТЕРРА» продемонстрировало клиническую (96,5%) и микробиологическую (97,3%) эффективность препарата «Тержинан» в качестве эмпирической терапии острого неспецифического вульвовагинита – одной из наиболее частых причин обращения за амбулаторной гинекологической помощью. В результате проведенной терапии отмечено значительное уменьшение объема влагалищных выделений (у 96,5% пациенток), полное исчезновение неприятного запаха, ощущений зуда и жжения во влагалище (у 74,5% и 67,1% исследуемых соответственно). В результате объективного осмотра у 100,0% женщин диагностирована нормализация окраски стенок влагалища, умеренный объем и «слизистый» характер выделений.
Принимая во внимание уникальность микробиоты влагалища (вариабельность состава эндогенной микрофлоры в течение всей жизни, способность комменсальных представителей защищать регион от вторжения собственной микрофлоры из других биотопов и микрофлоры полового партнера, непосредственную роль в развитии тяжелых акушерских осложнений), рациональное применение антимикробных препаратов в амбулаторной гинекологической практике приобретает особую актуальность.



