Аутоиммунные синдромы занимают важное место в развитии различных форм акушерской патологии. Среди аутоиммунных нарушений, приводящих к потере беременности, ведущее место занимает антифосфолипидный синдром (АФС) [1, 2]. Патогенез практически всех клинических проявлений антифосфолипидного синдрома реализуется в результате нарушений микроциркуляции, гемостаза и патологии сосудистой стенки [3]. При этом одним из самых уязвимых мест являются эндотелиальные клетки [4]. Занимая уникальное положение на границе между циркулирующей кровью и тканями, эндотелиальные клетки подвергаются воздействию различных факторов, находящихся в системном и тканевом кровотоке [5]. При действии на сосудистый эндотелий антифосфолипидных антител, компонентов комплемента, гипоксии, повышенного артериального давления, наблюдаемых в патогенезе АФС, преэклампсии, атеросклероза, происходит гиперэкспрессия клеточных молекул адгезии [6], увеличивается высвобождение вазоконстрикторных субстанций, повышающих сосудистый тонус, агрегацию тромбоцитов и свертывание крови, таких как эндотелин-1, тромбоксан и др. [7]. Параллельно развивается системная эндотелиальная дисфункция, которая характеризуется дисбалансом между различными эндотелиальными медиаторами (вазодилататоры – вазоконстрикторы, анти- и прокоагуянты) [8], происходит нарушение функции эндотелия, приводящее к усиленной адгезии и агрегации тромбоцитов, внутрисосудистому тромбозу в маточно-плацентарном комплексе, что является интегральным этиопатогенетическим фактором большинства акушерских патологий [9].
Оптимальным для профилактики повторных потерь плода, а также венозных и артериальных тромбозов считается сочетанное применение низких доз ацетилсалициловой кислоты и низкомолекулярных гепаринов [10]. Но даже при проведении такой терапии, неблагоприятные исходы беременности у женщин с АФС до сих пор варьируют в пределах 20–30% случаев [11]. Наиболее эффективным методом терапии АФС при беременности является использование иммуноглобулинов для внутривенного введения (ВВИГ) [12, 13], поскольку использование других препаратов, в частности, подавляющих синтез аутоантител ограничено. Следует отметить, что ВВИГ могут быть использованы и при других заболеваниях, связанных с повреждением эндотелия и формированием эндотелиальной дисфункции [14].
АФС на сегодняшний день не включен в список показаний к применению ВВИГ, их использование при данной нозологии находится за пределами инструкций («off-label») [15], так как имеющиеся данные пока еще не дают однозначного ответа на вопрос об использовании этих препаратов при данном виде патологии [16, 17]. Требуются дополнительные исследования, обосновывающие их использование в акушерской и терапевтической практике.
Целью настоящего исследования явилась оценка цитопротективного эффекта ВВИГ в отношении эндотелиальных клеток линии EA.Hy926.
Материал и методы исследования
Проведена оценка цитотоксических эффектов сывороток 45 беременных женщин на сроке до 12 недель, которых разделили на группы: беременные женщины с диагнозом привычное невынашивание и выявленными антифосфолипидными антителами; беременные женщины с диагнозом привычное невынашивание без повышенного уровня антифосфолипидных антител; женщины с физиологической беременностью.
Критериями включения в исследование были: репродуктивный возраст женщин с антифосфолипидными антителами; наличие в анамнезе невынашивания беременности; I триместр беременности. Критериями исключения были: почечная, печеночная недостаточность; пороки развития и доброкачественные новообразования матки; наличие эндокринных, генетических или инфекционных факторов невынашивания.
У пациенток забирали кровь из локтевой вены. Кровь центрифугировали, сыворотки отбирали в стерильных условиях и замораживали при температуре -20ºС.
В сыворотках периферической крови определяли уровень антифосфолипидных антител (к кардиолипину, фосфатидилсерину, фосфатидилинозитолу, фосфатидиловой кислоте), антител к β2-гликопротеину-I, антител к аннексину V, к протромбину методом твердофазного иммуноферментного анализа с использованием коммерческих тест-систем фирмы Orgentec Diagnostika GmbH (Германия).
Объектом исследования явились эндотелиальные клетки линии EA.Hy926, полученные путем гибридизации первичной эндотелиальной линии HUVEC с клетками карциномы легкого A-549. Клетки линии EA.Нy926 воспроизводят все основные морфологические, фенотипические и функциональные характеристики, присущие эндотелию. Клетки культивировали в полной среде DMEM/F12 (Sigma, США) с добавлением 10% инактивированной эмбриональной телячьей сыворотки (ЭТС) (Sigma, США), 10 мг/мл стрептомицина (Sigma, США), 1х105 ЕД/мл пенициллина (Sigma, США), 2 мМ L-глютамина (Sigma, США) и раствора гипоксантина–аминоптерин–тимидина (HAT) (Sigma, США), при 37˚С во влажной атмосфере с 5% содержанием СО2.
Для оценки токсичности ВВИГ «Интратект» (Biotest, Германия) в отношении эндотелиальных клеток, клетки линии EA.Hy926 культивировали в лунках 96-луночного плоскодонного планшета в концентрации 35000 клеток на лунку с ВВИГ в разведениях от 1:1 до 1:65536 при 37˚С во влажной атмосфере с 5% содержанием СО2 в течение 24 часов. Затем лунки отмывали раствором Хенкса с последующей окраской 0,2% кристаллическим фиолетовым (Sigma, США), содержащим 5% метанола. После окраски четырежды отмывали лунки дистиллированной водой, высушивали. Затем проводили экстракцию красителя 10% раствором уксусной кислоты. Учет оптической плотности проводили на микропланшетном фотометре (Biotek, США) при длине волны 540 нм. Снижение оптической плотности полученных растворов в лунках в присутствии разведений препарата по сравнению с оптической плотностью растворов в лунках, где клетки инкубировали в обычной среде, считали цитотоксическим эффектом препарата в отношении эндотелия. Минимальной токсической дозой ВВИГ явилась 6,250 мг/мл. Поэтому дальнейшие эксперименты проводили, используя препарат ВВИГ в концентрации 3,125 мг/мл.
Для оценки экспрессии Fc-рецепторов эндотелиальные клетки линии EA.Hy926 обрабатывали моноклональными антителами к CD16, CD32, CD64, (BD, США) в соответствии с рекомендациями производителя. Оценку экспрессии Fc-рецепторов проводили с использованием проточного цитофлуориметра FacsCanto II (BD, США).
Для оценки связывания с эндотелиальными клетками иммуноглобулинов класса G, входящих в состав препарата ВВИГ, клетки линии EA.Hy926 культивировали в присутствии ВВИГ в 24-луночном планшете. Затем клетки снимали с планшета раствором версена и обрабатывали антителами к иммуноглобулинам человека (Anti-Human IgG (H+L)FITC) в соответствии с рекомендациями производителя. Оценку связывания иммуноглобулинов с эндотелиальными клетками проводили с использованием проточного цитофлуориметра FacsCanto II (BD, США).
Для оценки влияния ВВИГ на изменение чувствительности эндотелиальных клеток к цитотоксическому эффекту сыворотки крови беременных женщин, клетки линии EA.hy926 культивировали в лунках 24-луночного плоскодонного планшета в концентрации 180000 клеток на лунку в 1 мл полной среды с добавлением ВВИГ. Клетки культивировали при 37˚С во влажной атмосфере с 5% содержанием СО2 в течение 6 часов. Затем клетки отмывали 1 мл питательной средой DMEM/F12 и на них наслаивали сыворотки крови. Для исключения влияния комплемента на цитотоксический эффект, использовали инактивированные при 56°С в течение 40 минут сыворотки крови. Затем клетки инкубировали 22 часа при 37˚С во влажной атмосфере с 5% содержанием СО2, снимали раствором версена, и окрашивали Propidium iodide в концентрации 3,6 нг/мл. В качестве контроля использовали клетки линии EA.Hy926 обработанные только сыворотками крови тех же пациентов, а также интактные клетки линии EA.Hy926. Оценку жизнеспособности эндотелиальных клеток проводили с использованием проточного цитофлуориметра FacsCanto II (BD, США).
Статистическую обработку полученных данных проводили при помощи программы Statistica for Windows 7.0, используя методы параметрической (критерий Стьюдента) и непараметрической (критерий Манна–Уитни) статистики.
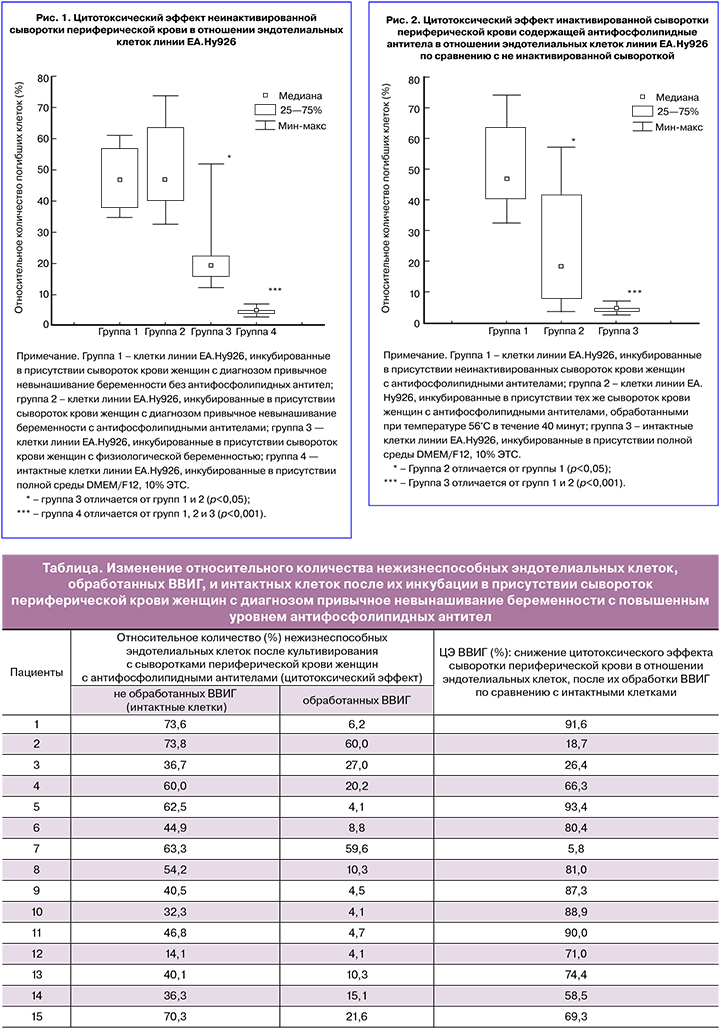
Результаты исследования
В группе женщин с привычным невынашиванием и выявленными антифосфолипидными антителами (n=15) частота выявления аутоантител к кардиолипину составила 73,3%, антител к β2-гликопротеину-I – 73,3%, антител к эндотелиальным клеткам – 40%, антител к аннексину – 5–20%, антител к протромбину – 0%. Сочетанное выявление антител к кардиолипину и β2-гликопротеину-I отмечали у 53,3% женщин. Представленные данные показывают, что с наибольшей частотой при привычном невынашивании беременности выявляются антитела к кардиолипину и к β2-гликопротеину-I, что соответствует литературным данным [18, 19].
Нами установлено, что более 80% эндотелиальных клеток связывают на своей поверхности иммуноглобулины, входящие в препараты ВВИГ. Для оценки специфичности связывания иммуноглобулинов с эндотелиальными клетками мы опирались на данные источников литературы о том, что при физиологических условиях на поверхности эндотелия Fc-рецепторов нет, но под воздействием медиаторов воспаления, циркулирующих иммунных комплексов, токсинов, гемодинамической перегрузки, индуцируется экспрессия Fc-рецепторов эндотелиальными клетками [20, 21]. Нами также была проведена оценка экспрессии Fc-рецепторов эндотелиальными клетками линии EA.Hy926 без стимуляции и после стимуляции через 24 и 72 часа следующими активаторами в различных концентрациях: TNF-α (50Ед/мл, 100Ед/мл, 400Ед/мл.), INF-γ (100Ед/мл, 500Ед/мл, 1000Ед/мл.), INF-γ / TNF-α (15/100Ед/мл, 500/250Ед/мл, 1000/250 Ед/мл.) LPS (0,1Ед/мл; 1Ед/мл; 10Ед/мл; 100Ед/мл), а также сыворотками, содержащими повышенный уровень антифосфолипидных антител. При этом экспрессии Fc-рецепторов (CD16, CD32, CD64) на эндотелиальных клетках линии EA.Hy926 мы не наблюдали.
В результате проведенного исследования установлено, что нативные сыворотки крови женщин с физиологической беременностью оказывают меньшее токсическое действие на эндотелиальные клетки по сравнению с сыворотками крови беременных женщин с диагнозом привычное невынашивание с антифосфолипидными антителами и с сыворотками крови беременных женщин с диагнозом привычное невынашивание без антифосфолипидных антител (рис. 1). Наличие таких различий подтверждается данными о том, что при невынашивании беременности и АФС, в системном кровотоке имеются агрессивные факторы, такие как антифосфолипидные антитела [22], компоненты комплемента [19], окисленные липопротеиды низкой и очень низкой плотности [14], провоспалительные цитокины и другие субстанции способные вызывать повреждение эндотелиальных клеток.
Установлено, что сыворотки периферической крови, содержащие антифосфолипидные антитела, после инактивации комплемента оказывают меньший цитотоксический эффект в отношении эндотелиальных клеток линии EA.Hy926 по сравнению с сыворотками крови с неинактивированным комплементом (рис. 2). Таким образом, система комплемента, участвуя в повреждении эндотелия и развитии эндотелиальной дисфункции, является патогенетическим звеном в формировании тромбогенного эффекта при АФС [23].
В ходе экспериментов по оценке влияния ВВИГ на изменение чувствительности эндотелиальных клеток линии EA.Hy926 к цитотоксическому эффекту сыворотки крови беременных женщин установлено, что ВВИГ обладает цитопротективным эффектом в отношении эндотелиальных клеток. Отмечено снижение цитотоксического влияния сывороток крови на эндотелиальные клетки после их обработки ВВИГ, в отличие от эндотелиальных клеток, необработанных ВВИГ. При анализе данных, полученных в контрольной группе женщин с физиологической беременностью у всех пациенток (n=15) наблюдали снижение цитотоксического эффекта сыворотки крови после обработки клеток ВВИГ (4,7 {2,9;6,8}; полученные данные указаны в виде медианы {верхний квартиль; нижний квартиль}) по сравнению с цитотоксическим эффектом сывороток крови в отношении эндотелиальных клеток не обработанных ВВИГ (19,0 {51,8;12,2}, p<0,001). Для указанной группы женщин мы рассчитали цитопротективный эффект (ЦЭ), который показывает, насколько уменьшилась цитотоксичность сыворотки крови в отношении эндотелиальных клеток после обработки клеток ВВИГ по сравнению с интактными клетками, рассчитанный по формуле: ЦЭ(%) = 100 – 100Х / Х1, где Х – относительное количество (%) нежизнеспособных эндотелиальных клеток, обработанных иммуноглобулином, после культивирования с сывороткой периферической крови; Х1 – относительное количество (%) нежизнеспособных эндотелиальных клеток, не обработанных иммуноглобулином, после культивирования с сывороткой периферической крови.
Используя процентильное определение нормы, мы получили референсное значение для ЦЭ ВВИГ в отношении эндотелиальных клеток, равное 55%. При этом ЦЭ оценивался нами как положительный, если он был более 55%.
При анализе данных, полученных в группе женщин с привычным невынашиванием беременности без антифосфолипидных антител установлено, что у всех пациенток (n=15) цитотоксический эффект сыворотки периферической крови в отношении эндотелиальных клеток, не обработанных препаратом (46,6 {34,6;61,0}) снижался после обработки клеток препаратом ВВИГ (10,5 {5,1;17,6}, p<0,001). При этом в среднем ЦЭ составил 77,6±8,5.
При анализе данных, полученных в группе женщин с антифосфолипидными антителами показано, что цитотоксический эффект сыворотки периферической крови в отношении эндотелиальных клеток необработанных препаратом (46,8 {14,1;73,8}) снижался после обработки клеток препаратом ВВИГ (10,3 {4,1;60,0}, p<0,001). При этом в среднем ЦЭ составил 66,8±27,9. Следует отметить, что у трех пациенток снижение цитотоксического эффекта сыворотки крови после обработки клеток ВВИГ было менее чем на 55% (таблица). Скорее всего, у таких пациентов использование ВВИГ было бы малоэффективным и в клиническом плане.
Полученные данные позволяют предложить модель оценки ЦЭ ВВИГ в отношении клеток у беременных женщин с АФС. Предлагаемая модель позволит принимать решение о целесообразности использования препарата у конкретного пациента как при терапии женщин с привычным невынашиванием беременности и диагностированным АФС, так и при терапии других заболеваний, связанных с повреждением эндотелия и формированием эндотелиальной дисфункции.
Обсуждение результатов
Имеющиеся в настоящее время в литературе сведения по использованию ВВИГ в терапии женщин с привычным невынашиванием носят противоречивый характер. Имеются данные об эффективном и безопасном применении ВВИГ у женщин с привычным невынашиванием [24, 25]. С другой стороны, говорится о незначительном положительном эффекте иммунотерапии в отличие от плацебо, что отражено в Кокрановском систематическом обзоре, проведенном в 2014 году, включавшем 20 рандомизированных плацебо-контролируемых исследований, в которых оценивались различные методы иммунотерапии, такие как иммунизация лейкоцитами отца, донорскими лейкоцитами, мембранами трофобласта и ВВИГ у женщин с привычным невынашиванием беременности неясной этиологии [26].
Ранее нами показано, что проведенные курсы терапии ВВИГ у женщин с привычным невынашиванием способствуют нормализации показателей гемостаза. При оценке иммунного статуса пациентов, после терапии ВВИГ было отмечено повышение уровня Т-регуляторных лимфоцитов, играющих важную роль в индукции толерантности к аллоантигенам плода. Параллельно, у таких пациенток отмечали снижение уровня цитотоксических Т-лимфоцитов и В-лимфоцитов [27].
В настоящем исследовании мы оценили эффект ВВИГ как цитопротекторов в отношении эндотелиальных клеток. Эндотелий является источником целого ряда продуктов, участвующих в регуляции сосудистого тонуса, свертывающей системы, функции тромбоцитов, выполняет барьерную, секреторную, гемостатическую, вазотоническую функции, играет важную роль в процессах воспаления, ремоделирования сосудистой стенки, пролиферации, миграции клеток крови через сосудистую стенку [28].
Сохранение его функциональной активности необходимо для предотвращения развития патологических состояний связанных с повреждением эндотелия и развитием эндотелиальной дисфункции. В наших экспериментах продемонстрирована способность иммуноглобулинов оказывать протективный эффект. Так, после обработки эндотелиальных клеток ВВИГ происходило снижение цитотоксического эффекта сыворотки крови женщин с привычным невынашиванием беременности в отношении эндотелиальных клеток.
Данные эффекты обусловлены тем, что иммуноглобулины, входящие в состав ВВИГ способны адсорбироваться [29] на клеточной мембране за счет ковалентных взаимодействий [30], интернализоваться в клетку и вызывать модификации фенотипа эндотелиальных клеток с ингибированием их прокоагулянтной активности [31]. За счет своих достаточно крупных размеров и конфигурации, иммуноглобулины также способны «прикрывать» отрицательно заряженные фосфолипиды мембран клеток («зонтичное» прикрытие), препятствуя связыванию фосфолипидов с антифосфолипидными антителами и последующей активацией системы комплемента [32]. ВВИГ способны предупреждать комплемент-зависимое повреждение эндотелия за счет связывания С-3 и С-4 компонентов комплемента [31].
Заключение
Таким образом, проведенное нами исследование, оценивающее протективную роль иммуноглобулинов на модели in vitro, является основанием для дальнейшего их исследования в клинической практике и расширения спектра показаний к применению данного препарата.



