Термином «фиброзно-кистозная мастопатия» (ФКМ) обозначают группу дисгормональных доброкачественных заболеваний молочной железы с гиперплазией ее ткани. ФКМ является доброкачественным заболеванием, которое распространено среди женщин репродуктивного возраста [1, 2]. Тем временем данные эпидемиологических исследований указывают на связь предшествующей мастопатии и рака молочной железы (РМЖ) [3]. У мастопатии и РМЖ общие причины и механизмы развития [4]. Молочные железы являются мишенью действия различных гормонов и биологически активных веществ, поэтому нарушения гормонального статуса сопровождаются изменениями морфологической структуры тканей молочной железы [5].
Диффузная мастопатия – наиболее часто встречающееся заболевание у пациенток репродуктивного возраста. Данное заболевание является актуальным предметом исследования специалистов различных стран, в том числе и российских. Постоянная циклическая смена пролиферативных и регрессивных процессов в железистой и эпителиальной тканях молочной железы при неблагоприятных условиях может привести к появлению структурных морфологических изменений. Эти изменения наиболее часто представляют собой диффузные и диффузно-узловые образования [6].
При этом симптоматика заболевания бывает довольно разнообразной, что представляет собой определенную сложность диагностики. Проявления патологического состояния клинически могут выражаться в виде болевого синдрома в молочных железах различной степени выраженности, увеличения плотности и объема, появления чувства распирания и неоднородности структур тканей молочных желез. Таким образом, столь широкий спектр клинических проявлений требует особой дифференциальной диагностики. Очень часто эти клинические симптомы встречаются в лютеиновую фазу менструального цикла. Данный факт можно связать именно с действием прогестерона (а именно – его дефицита), наблюдаемого во вторую фазу цикла. Выраженность степени клинических симптомов может колебаться от слабого предменструального напряжения в молочных железах до очень выраженного проявления болевого синдрома, а также формирования узловых образований [7, 8].
В соответствии с принятой классификацией выделяют различные формы диффузных мастопатий, которые определяются при морфологическом исследовании и на рентгенограммах: диффузная ФКМ с преобладанием фиброзного, кистозного и железистого (аденоз) компонентов, а также склерозирующий аденоз и смешанные формы [9].
Выраженность этих процессов по результатам маммографического исследования условно определяется соотношением жирового и соединительнотканно-железистого комплексов [10]. В патогенезе мастопатий, как правило, лежит нарушение гормонального равновесия центральной гормональной регуляции, приводящее к дисбалансу эстрогенов и прогестерона, поэтому назначаемая терапия должна быть патогенетической [11].
Физиологическое функционирование молочной железы прежде всего зависит от концентрации прогестерона и эстрадиола в ее ткани. Дисбаланс этих гормонов ведет к функциональным нарушениям, а в дальнейшем обязательно приводит к морфологическим изменениям [12]. Следовательно, основная роль в патогенетической терапии должна сводиться к восстановлению данного гормонального баланса. Как правило, не абсолютная, а относительная гиперэстрогения в результате дефицита эндогенного прогестерона играет главную роль в патогенезе ФКМ. Дефицит концентрации прогестерона способствует морфофункциональной перестройке, что приводит к гипертрофии внутридольковой соединительной ткани и отеку. Клинически это проявляется в увеличении объема ткани и образовании кист в результате обструкции протоков молочной железы [13].
Наиболее патогенетически обоснованным подходом к терапии диспластических гормонозависимых доброкачественных заболеваний молочной железы в настоящее время является устранение патологического дисбаланса между эстрогенами и прогестероном [14, 15].
Механизм действия микронизированного прогестерона для трансдермального использования в виде геля основывается на увеличении концентрации прогестерона в молочной железе. При местном нанесении на кожу молочной железы препарат действует локально, корректируя относительную гиперэстрогению и нормализуя дисгормональные нарушения, не оказывая системного эффекта. Одним из таких препаратов микронизированного прогестерона является «Прожестожель». Он отличается от большинства остальных гормональных препаратов тем, что его активное вещество (микронизированный прогестерон) доставляется в ткани молочной железы путем аппликации [16]. Таким образом, в молочных железах достигается необходимая терапевтическая концентрация прогестерона при минимальном количестве действующего вещества, которое не оказывает влияния на основной профиль половых стероидов. Следовательно, местное применение препарата не оказывает системного влияния и минимизирует возможные нежелательные побочные эффекты [17].
Микронизированный прогестерон уменьшает экспрессию эстрогеновых рецепторов в тканях молочной железы и снижает местную концентрацию эстрогенов через стимуляцию синтеза ферментов (эстронсульфотрансферазы и 17b-гидроксистероиддегидрогеназы), преобразующих эстрадиол в менее активную форму (эстрон) и далее превращающих последний в неактивный эстрона сульфат. Таким образом, прогестерон тормозит пролиферативную активность эстрогенов в тканях молочной железы. Прогестерон оказывает натрийуретический эффект за счет снижения канальцевой реабсорбции и повышения клеточной фильтрации, способствуя при этом предотвращению задержки лишней жидкости и последующего развития болевого синдрома молочной железы (мастодинии или масталгии). Кроме этого, трансдермальное применение препарата микронизированного прогестерона, воздействуя на состояние сосудистой сети и железистого эпителия, позволяет снизить проницаемость капилляров, уменьшить отек молочной железы и купировать болевые симптомы [16].
При местном способе применения микронизированный прогестерон таргетно проникает в ткани молочных желез, не подвергаясь метаболизму в печени и, следовательно, не оказывая системных эффектов. Оценка плазменной концентрации прогестерона, эстрадиола и пролактина подтвердила, что через 1 ч после применения препарата, когда его концентрация в ткани максимальна, уровень гормонов достоверно не изменяется. При местном трансдермальном применении абсорбция прогестерона составляет около 10% дозы. Данный метод позволяет снизить используемую дозу при высокой концентрации в терапевтической зоне его действия (в 10 раз больше по сравнению с системным кровотоком) [16].
Проведенные ранее исследования доказали эффективность применения препарата «Прожестожель» при различных формах мастопатии и масталгии в качестве монотерапии. Терапевтический эффект в виде исчезновения и уменьшения болей достигался уже на 2-е сутки применения препарата и сохранялся до 6 месяцев [16, 18]. Кроме того, было показано уменьшение количества гиперэхогенных и гипоэхогенных структур молочной железы по данным маммографии и УЗИ на фоне монотерапии препаратом трансдермального микронизированного прогестерона. По результатам проведенного в 2018 г. наблюдательного исследования БРЕСТ среди акушеров-гинекологов, через 3–6 месяцев (в течение 3–6 менструальных циклов) непрерывного применения препарата «Прожестожель» при УЗИ отмечено достоверное уменьшение числа выявленных участков уплотненной структуры, в том числе размерами 1–2 см и более 2 см (гиперплазированные дольки, кисты), а согласно анализу рентгенмаммографических заключений сократилась доля пациенток с диффузной ФКМ с преобладанием кистозного компонента [16].
По мнению NCCN (National Comprehensive Cancer Network), к общим факторам риска РМЖ (возраст, женский пол, семейная история РМЖ в молодом возрасте, генетические мутации – BRCA 1/2, длительная менопаузальная гормональная терапия, поздние первые роды, поздняя менопауза и раннее менархе, повышенная маммографическая плотность, лучевая терапия грудной клетки в анамнезе) были также отнесены доброкачественные пролиферативные заболевания молочной железы. По данным метаанализа и систематического обзора 2015 г., пролиферативные формы мастопатии без атипии повышают риск РМЖ почти в 2 раза, а с атипией – почти в 4 раза [5]. Следовательно, своевременная диагностика и патогенетическая терапия доброкачественных заболеваний молочной железы способны повлиять на снижение риска РМЖ в будущем [19].
В настоящее время представляется важным оценить скорость купирования симптомов ФКМ при использовании лекарственного препарата «Прожестожель» в непрерывном режиме в течение 3 и, при принятии решения врачом о продолжении терапии, до 6 месяцев (3–6 менструальных циклов) с целью изучить эффективность и безопасность, а также подтвердить данные наблюдений за пациентками в рутинной клинической практике, принятой в лечебных учреждениях, лечения диффузной ФКМ препаратом трансдермального микронизированного прогестерона («Прожестожель», «Безен Хелскеа СА», Бельгия) в условиях монотерапии.
Современные данные подтверждают, что мастопатия является междисциплинарной проблемой и требует повышенного внимания со стороны акушера-гинеколога и онколога, так как избыточная пролиферация на фоне относительной гиперэстрогении в условиях дефицита прогестерона является общим доказанным фактором риска не только пролиферативных форм мастопатии, но и РМЖ [20].
Материалы и методы
Проведено проспективное когортное исследование БРЕСТ-2 с целью документально подтвердить данные наблюдений за пациентками в рутинной клинической практике, принятой в лечебных учреждениях, лечения диффузной ФКМ препаратом трансдермального микронизированного прогестерона («Прожестожель», «Безен Хелскеа СА», Бельгия) в условиях монотерапии. Условием для проведения данного исследования являлось одобрение исследования межвузовским Комитетом по этике (выписка из протокола №11-18 от 20.12.2018). В программу наблюдения были включены пациентки старше 18 лет с сохраненной менструальной функцией с диагнозом «диффузная фиброзно-кистозная мастопатия». Набор и лечение пациентов проводились специалистами-онкологами в 65 исследовательских центрах России (лечебных организациях, оказывающих специализированную медицинскую помощь пациенткам с диффузной ФКМ) с января по декабрь 2019 г. (Приложение). При проведении исследования применялись критерии включения/невключения пациентов.
Критерии включения:
- подписанное информированное согласие пациентки на участие в исследовании;
- возраст старше 18 лет и сохраненный менструальный цикл;
- напряжение и/или боли в молочных железах;
- диффузная мастопатия с преобладанием железистого компонента (аденоз) или диффузная ФКМ с преобладанием кистозного компонента с клиническим и ультразвуковым подтверждением и/или маммографией;
- назначение лечащим врачом препарата «Прожестожель». Решение врача о применении данной терапии, а также о тактике дальнейшего лечения должно быть принято до включения женщины в исследование и независимо от него.
Критерии невключения (все противопоказания, указанные в текущей инструкции по применению препарата «Прожестожель»):
- индивидуальная повышенная чувствительность к любому из компонентов препарата;
- беременность;
- узловые формы ФКМ;
- рак молочной железы и половых органов;
- опухоли (опухолевидные образования) молочной железы неясной этиологии.
Период наблюдения за каждой пациенткой охватывал период непрерывного применения препарата, который составлял около 3 месяцев (3 циклов) или, при необходимости проведения повторного курса, до 6 месяцев (6 циклов). Лечащие врачи собирали данные каждой пациентки, формировали индивидуальные регистрационные карты при первичном и заключительном визитах через 3 месяца непрерывного применения препарата. Для тех пациенток, для которых врачом было принято решение о необходимости проведения повторного курса терапии препаратом «Прожестожель», данные анализировались еще через 3 месяца (суммарно через 6 месяцев после первичного визита включения в программу наблюдения). Препарат применялся в соответствии с локально одобренной инструкцией по медицинскому применению – 1 аппликация (2,5 г геля), содержащая 0,025 г прогестерона, на кожу молочных желез аппликатором-дозатором до полного всасывания 1–2 раза ежедневно.
В рамках выполненных процедур наблюдательного исследования были проанализированы антропометрические и демографические данные пациенток, акушерско-гинекологический и соматический анамнез, наличие симптомов и жалоб, данные проведенных рентгенографического и ультразвукового исследований молочных желез, результаты оценки шкалы BI-RADS в динамике проводимого лечения и интенсивность болевого синдрома при помощи визуально-аналоговой шкалы (ВАШ) боли, тяжесть состояния пациенток оценивалась по шкале общего клинического впечатления. Также анализировались все нежелательные явления, зафиксированные в течение всего времени терапии и наблюдения. Выполняемые медицинские исследования и процедуры в рамках данного исследования были рутинными, используемыми в повседневной клинической практике, что позволило определить неинтервенционный характер исследования.
Первичная конечная точка данного исследования – динамика состояния молочной железы (среднее количество анэхогенных, гипо- и гиперэхогенных образований на фоне диффузной ФКМ) по результатам УЗИ через 3 и (при пролонгации длительности лечения) 6 месяцев.
Вторичные критерии эффективности: оценка через 3 и (при пролонгации лечения) через 6 месяцев динамики состояния молочной железы (размер образований) по результатам УЗИ; динамики выраженности болевого синдрома молочной железы, связанного с диффузной ФКМ, по данным ВАШ боли (представляет собой непрерывную шкалу в виде горизонтальной или вертикальной линии длиной 10 см (100 мм) и расположенных на ней двух крайних точек: «отсутствие боли» и «сильнейшая боль, какую можно только представить»); динамики состояния молочной железы по результатам рентгенографической маммографии; тяжести состояния пациентки в динамике проводимой терапии по результатам измерения шкалы общего клинического впечатления (Clinical Global Impression Scale – CGI – состоит из 3 субшкал, отражающих оценку тяжести состояния, общую степень улучшения заболевания по 7-балльной системе и субшкалу индекса эффективности, который рассчитывается по совокупности одной из четырех степеней терапевтического эффекта (заметный, умеренный, минимальный, без изменений) и степени выраженности побочного эффекта препарата (отсутствует, незначительный, значительный, нивелирующий терапевтический эффект)). Безопасность анализировалась по данным всех нежелательных явлений, выявленных с момента подписания участницей исследования информированного согласия до окончания участия пациентки в исследовании.
Статистический анализ
Анализ данных проводили с помощью пакета статистических программ IBM SPSS Statistics 23.0. Проверка нормальности распределения выполнена с помощью критериев Колмогорова–Смирнова и Шапиро–Уилка. Поскольку данные подчинялись закону нормального распределения, данные представляли в виде средних значений и стандартного отклонения. Качественные признаки представлены абсолютными (n) и относительными (%) частотами. Сравнение групп по количественным признакам осуществлялось с использованием t-критерия Стьюдента для независимых групп и парного t-критерия Стьюдента – для зависимых. Сравнение групп по качественным признакам осуществлялось путем анализа таблиц сопряженности с использованием критерия χ2 для независимых групп и критерия МакНемара – для зависимых. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Результаты и обсуждение
Анализ эффективности терапии выполнялся среди всех включенных в исследование пациенток, соответствующих критериям включения, применивших хотя бы 1 дозу препарата и прошедших 1 визит после исходного. Общее число пациенток в исследуемой популяции составило 722 человека.
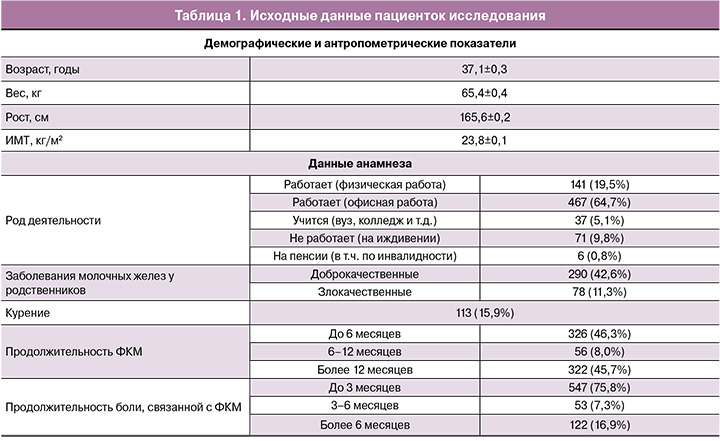
Демографические и антропометрические показатели пациенток исследования (средние значения и стандартная ошибка среднего), а также анамнестические данные представлены в таблице 1.
Оценка динамики состояния молочных желез по результатам главного критерия эффективности (среднее количество ан-, гипо- и гиперэхогенных образований при УЗИ на фоне диффузной ФКМ) показала значимое уменьшение количества образований в процессе проводимого лечения: 5,09±0,15 (до начала лечения), 2,97±0,13 (через 3 месяца терапии), 2,29±0,16 (через 6 месяцев терапии), p<0,001.
Также было показано достоверное клиническое улучшение признаков заболевания при ультразвуковой оценке средних размеров образований различной эхогенности молочных железах в динамике проводимой терапии, p<0,001 (рис. 1).
Оценка динамики состояния молочной железы по результатам рентгенографической маммографии показала значимое улучшение при анализе данных по системе интерпретации и протоколирования визуализации молочной железы (BI-RADS), p<0,001 (табл. 2).
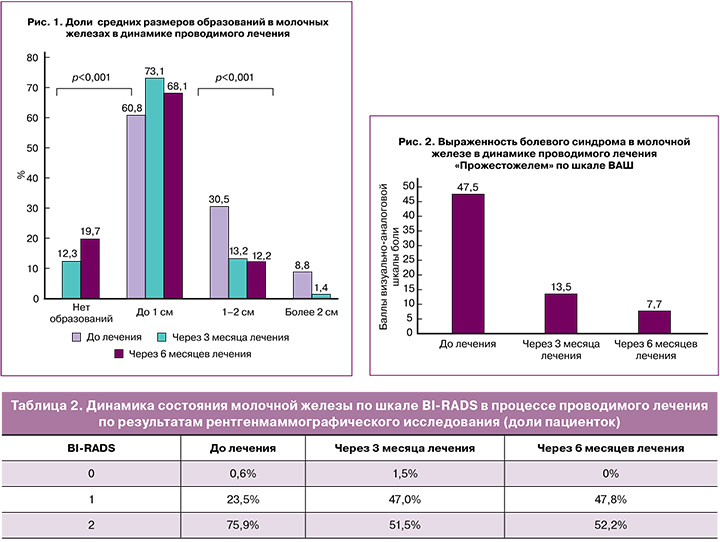
Анализ показателей выраженности болевого синдрома в молочных железах с использованием ВАШ продемонстрировал достоверное снижение в динамике на фоне проводимого лечения: 47,5±0,8 (до начала лечения), 13,5±0,6 (через 3 месяца терапии), 7,7±0,8 (через 6 месяцев терапии), p<0,001 (рис. 2).
Анализ данных о тяжести состояния пациенток в динамике проводимой терапии проводился при помощи полученных данных шкалы общего клинического впечатления (Clinical Global Impression), которую заполнял исследователь на последнем визите. Динамика состояния пациентов показала улучшение состояния по критериям: тяжесть заболевания (p<0,001), общее улучшение (p<0,001), индекс эффективности – 638 (88,7%) и 228 (94,2%) пациенток указали на значительный и умеренный терапевтический эффект (p<0,001) через 3 месяца и через 6 месяцев в случае пролонгации терапии соответственно. Следовательно, можно заключить, что исследуемая терапия демонстрирует высокий профиль эффективности.
За период проведения данного исследования были зарегистрированы нежелательные явления у 15 (2,1%) пациенток, все они были классифицированы по степени тяжести как легкие и разрешились в 100% случаев. У 12 пациенток нежелательные явления были связаны с местными кожными реакциями, и 3 пациентки отметили боли в молочных железах. Таким образом, анализ выявленных нежелательных явлений продемонстрировал достаточно хороший профиль безопасности использования монотерапии «Прожестожелем» (качество нежелательных явлений, выявленных в исследовании, было сопоставимо с имеющимися данными, указанными в инструкции по применению лекарственного препарата «Прожестожель»).
Заключение
Анализ представленных результатов проведенного многоцентрового когортного исследования продемонстрировал снижение болевых ощущений в молочных железах, уменьшение среднего количества образований различной степени эхогенности, зарегистрированных по УЗИ и рентгенмаммографическому исследованию, в ходе исследования был подтвержден достаточный профиль эффективности и благоприятный профиль безопасности патогенетической терапии ФКМ препаратом трансдермального прогестерона «Прожестожель».
Своевременная диагностика и патогенетическое лечение мастопатии трансдермальным прогестероном не только улучшают качество жизни пациенток, но и являются, безусловно, важными задачами в аспектах выявления и профилактики РМЖ.
Приложение