Послеродовые воспалительные заболевания матки представляют актуальную проблему для современного акушерства, что обусловлено их высокой частотой (5–26%) и ролью в структуре материнской заболеваемости и смертности [1–3]. Значительное увеличение частоты оперативных родоразрешений в последние годы привело к заметному снижению перинатальной смертности, но одновременно вызвало рост инфекционных осложнений пуэрперия [4–7].
Использование антибактериальных средств в акушерских стационарах привело к снижению послеродовых воспалительных заболеваний. Но в последние 10 лет зарегистрирован рост послеродовых метроэндометритов (ПМЭ), в том числе и в связи с антибиотикорезистентностью [8, 9]. Состояние иммунной защиты, безусловно, имеет важное значение в реализации инфекционного процесса в послеродовом периоде. Большую роль в данном процессе играют цитокины, являющиеся посредниками в развитии воспалительных и иммунных реакций [10, 11]. В настоящее время в литературе приводятся различные данные по содержанию этих молекул при ПМЭ, а вопросы патогенеза, диагностики и лечения ПМЭ постоянно обсуждаются [12, 13].
Одним из ключевых цитокинов иммунной системы является фактор некроза опухолей альфа (TNFα, или ФНОα). TNFα оказывает влияние на пролиферацию, дифференцировку и гибель различных клеток, воспалительные реакции, врожденный и приобретенный иммунитет. Чрезмерный, неконтролируемый синтез ФНОα играет роль в развитии септического шока [14–16]. Интерлейкин-10 (ИЛ-10) – наиболее важный противовоспалительный цитокин. Макрофаги продуцируют ИЛ-10 под влиянием экзогенных и эндогенных факторов, таких как эндотоксины, катехоламины и др. ИЛ-10 принимает участие в иммунных реакциях при воспалительных заболеваниях, препятствует синтезу провоспалительных цитокинов, антигенов MHC 2 класса и др. [11, 14].
Цель настоящего исследования – оценить лабораторные показатели и клинико-морфологические особенности течения ПМЭ у женщин.
Материалы и методы
Под нашим наблюдением находились 174 женщины: из них основная группа – 124 с ПМЭ (после операции кесарева сечения (КС) – 40 и после самопроизвольных родов (СР) – 84) и группа сравнения – 50 здоровых родильниц (25 – после КС и 25 – после СР).
В основной группе больных, согласно клиническим рекомендациям [17], мы выделили 2 подгруппы: с легким (n=88) и тяжелым (n=36) течением ПМЭ.
Критериями включения в основную группу были клинические и лабораторные данные, позволяющие подтвердить диагноз «послеродовый эндометрит»: послеродовый период, не превышающий 42 дня; повышение температуры тела у родильниц до 38°С и выше; тазовая боль или болезненность матки при пальпации; гнойные лохии; субинволюция матки по УЗИ.
Критерии исключения для проведения иммунологических исследований: системные аутоиммунные заболевания матери, преэклампсия, многоплодные беременности, беременности после экстракорпорального оплодотворения, инфекционные генитальные и экстрагенитальные заболевания, доброкачественные и злокачественные опухоли у родильниц; тяжелые формы экстрагенитальной патологии.
Оценка акушерского и гинекологического анамнеза, экстрагенитальных заболеваний, результаты обследования свидетельствовали о том, что группы женщин были сходны по данным признакам.
Обследование родильниц проводилось в соответствии с действующим на тот период времени приказом МЗ РФ № 572н от 01.11.2012 г. [18] и включало: клинико-статистические, общеклинические, бактериологические (посевы отделяемого из полости матки на флору), лабораторные, ультразвуковые, гистологические методы исследования, ретроспективный анализ всех историй родов. Уровни ИЛ-10 и ФНОα в сыворотке крови женщин определяли методом иммуноферментного анализа с помощью тест-систем «Вектор-БЕСТ» (Россия). Для оценки уровня ИЛ-10 и ФНОα мы проводили обследование женщин только после операции кесарева сечения на 4-е сутки после родов: у женщин группы сравнения – перед выпиской домой, а у женщин основной группы – при переводе в гинекологическое отделение с диагнозом ПМЭ.
Статистический анализ
Статистическую обработку данных проводили с использованием пакета программ статистической обработки STATISTICA for Windows 10.0. Количественное описание величин представляли в виде среднего арифметического (М) и стандартного отклонения (SD). Учитывая нормальное распределение данных, определение достоверности различий между количественными показателями было выполнено с использованием t-критерия Стьюдента. Для определения наличия или отсутствия линейной связи между двумя количественными показателями использовали критерий корреляции Пирсона (r). За критический уровень значимости принималось значение p<0,05.
Результаты и обсуждение
Средний возраст пациенток в группе сравнения составил 27,5 (1,3) года, в основной – 28,9 (1,3) года (р>0,05). У почти всех обследованных в анамнезе обнаружены детские инфекции, инфекционные заболевания дыхательных путей, почек, мочевого пузыря, нарушения жирового обмена, анемии: 109/124 (87,9%) – основная группа и 36/50 (72%) – группа сравнения. Гинекологическая патология выявлена у 42/124 (33,8%) и у 16/50 (32%) обследованных соответственно. Каждая пятая пациентка основной группы имела раннее коитархе, каждая вторая – перенесла бактериальный вагиноз и вагинальный кандидоз, которые являются общепризнанными факторами риска развития пуэрперальных осложнений и в группе сравнения встречались в 2 раза реже. Самопроизвольные аборты, неразвивающиеся беременности, а также угроза прерывания настоящей беременности, многоводие были сопутствующим неблагоприятным фоном к развитию ПМЭ у каждой 3-й пациентки, в то время как в группе сравнения – у каждой 10-й. У родильниц с послеродовой инфекцией матки часто отмечались дородовое излитие околоплодных вод и длительный безводный период (23/124 (18,5%) против 5/50 (10%) в группе сравнения), аномалии родовой деятельности (29/124 (23%) против 3/50 (6%) в группе сравнения), травмы мягких тканей (15/124 (12%) против 4/50 (8%) в группе сравнения), кровопотеря в родах более 500 мл (41/124 (33%) против 4/50 (8%) в группе сравнения). При оценке степени тяжести ПМЭ мы отметили, что после самопроизвольных родов эндометрит, как правило, протекал в легкой форме, для которой были характерны относительно позднее начало (на 5–12-е сутки послеродового периода), повышение температуры тела до 38–38,5°С, умеренно увеличенная скорость оседания эритроцитов (СОЭ) (30–35 мм/ч), лейкоцитоз в пределах 9–12×109/л с незначительным нейтрофильным сдвигом лейкоцитарной формулы крови влево, отсутствие значимых изменений в биохимических показателях крови. Тяжелый эндометрит, как правило, развивался после операции кесарева сечения и часто начинался на 2–3-и сутки после родов. При тяжелом ПМЭ почти у всех родильниц отмечались тазовая боль, снижение аппетита, слабость, фебрильная температура с ознобами, тахикардия, признаки субинволюции и болезненность матки, гнойные выделения из половых путей. В гемограмме выявляли анемию, лейкоцитоз (от 14×109/л до 36×109/л), увеличение числа палочкоядерных лейкоцитов и СОЭ (табл. 1). Подчеркнем, что признаки системного воспалительного ответа (два и более) и субинволюция матки встречались у всех родильниц с ПМЭ. Известно, что одним из самых чувствительных индикаторов при воспалении является С-реактивный белок (СРБ) [19], концентрация которого удваивается каждые 8 ч и, согласно литературным данным, может увеличиваться в 1000 раз больше нормы. СРБ был положителен у всех женщин с ПМЭ. Содержание его при легком течении ПМЭ составило 19,99 мг/л, при тяжелом – 106,4 мг/л, в тяжелых случаях, осложненных перитонитом, повышалось до 175 мг/л (табл. 2).
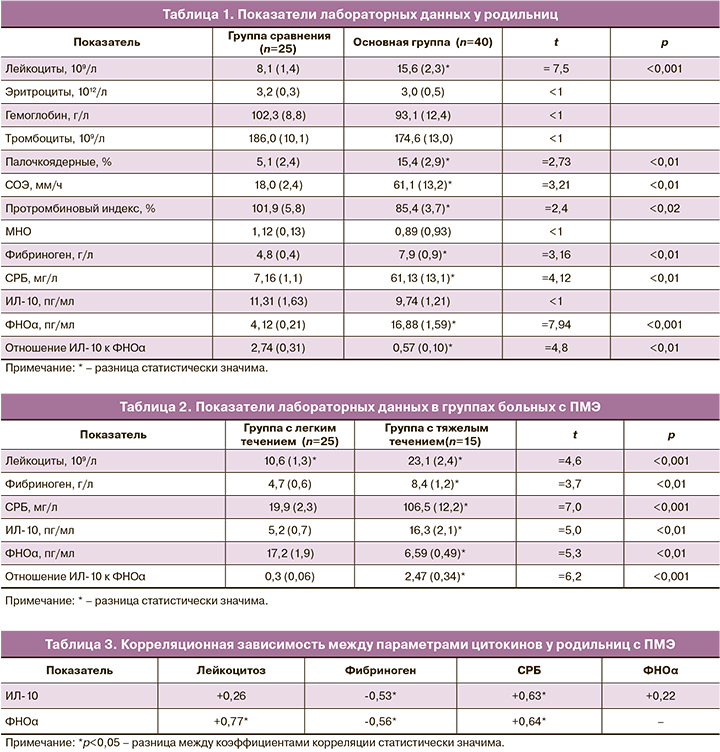
Анализируя данные гемостазиограммы у женщин с тяжелым ПМЭ, мы отметили более выраженное гиперкоагуляционное состояние: укорочение активированного частичного тромбопластинового времени до 18,1 с, укорочение тромбинового времени до 12,1 с, повышение уровня фибриногена до 8,9–11,2 г/л, снижение международного нормализованного отношения (МНО) до 0,81. Как известно, почти все эти системные эффекты могут быть обусловлены действием цитокинов, в частности ФНОα. Стержневая роль TNFα в развитии септических осложнений связана с его биологическими эффектами: повышением тромбогенности на поверхности эндотелия, усилением активации нейтрофилов, индукцией острой фазы системной воспалительной реакции, индукцией синтеза химических медиаторов и «острофазных» белков, каковыми в первую очередь являются СРБ и фибриноген [20].
Среднее содержание ФНОα у здоровых родильниц составило 4,12 (0,21) пг/мл. При развитии метроэндометрита уровень ФНОα был повышен в 4 раза по сравнению со здоровыми родильницами и составил в среднем 16,88 (1,59) пг/мл (табл. 1). При легкой форме ПМЭ содержание данного цитокина было выше средних значений, а при тяжелой – в отдельных случаях снижалось до 4,3 пг/мл. Среднее содержание ИЛ-10 у здоровых родильниц составило 11,31 (1,63) пг/мл. У здоровых женщин после родов относительно преобладал противовоспалительный цитокин, и отношение ИЛ-10 к уровню ФНОα оказалось в 2,74 раза больше. При развитии метроэндометрита уровень ИЛ-10 был ниже, чем у здоровых, и отношение его к ФНОα уменьшилось до 0,57. При легкой форме ПМЭ содержание данного цитокина уменьшалось по сравнению со здоровыми почти на 50% (табл. 1, 2).
Хотелось бы подчеркнуть, что при тяжелой форме ПМЭ, осложнившейся несостоятельным швом на матке и перитонитом, уровень противовоспалительного цитокина ИЛ-10 был особенно высок и превышал средние значения в группе больных с ПМЭ. В то же время у этих родильниц уровень ФНОα оказался ниже средних значений, полученных в данной группе. Недостаточная или избыточная продукция цитокинов может вести к неадекватной воспалительной реакции, утяжелению течения заболевания. С другой стороны, в нашем исследовании повышение ИЛ-10, возможно, играет позитивную роль, так как приводит к уменьшению неблагоприятных эффектов ФНОα. Согласно литературным данным, продукция противовоспалительных цитокинов является компенсаторной реакцией, а их уровень в крови и тканях постепенно увеличивается наряду с уменьшением содержания воспалительных медиаторов [20].
В случаях тяжелого течения ПМЭ установлена положительная корреляционная связь между уровнями ИЛ-10 и СРБ (r=+0,63; р<0,05), ИЛ-10 и лейкоцитозом (r=+0,26; р>0,05), а между содержанием ИЛ-10 и фибриногена – отрицательная (r=-0,53; р<0,05). Между содержанием СРБ и ФНОα выявлена положительная корреляционная связь (r=+0,64; р<0,05), как и между ФНОα и лейкоцитозом (r=+0,77; р<0,05) (табл. 3).
В соответствии с протоколом ведения больных с ПМЭ мы направляли отделяемое из цервикального канала на бактериологическое исследование.
В посевах наиболее частыми возбудителями были Escherichia coli (24/124 (19,3%)), Enterococcus faecalis (17/124 (16,9%)), Staphylococcus haemolyticus (16/124 (12,9%)), Staphylococcus aureus (13/124 (10,4%)), Klebsiella pneumoniae (4/124 (3,2%)) и их ассоциации (82/124 (66,1%)).
Кроме вышеизложенного, для диагностики послеродового эндометрита и наличия в полости матки сгустков крови, остатков последа, на фоне которых формируется воспалительная реакция, мы применяли трансвагинальное ультразвуковое сканирование и гистероскопию. У родильниц с ПМЭ, по сравнению с неосложненным течением пуэрперия, чаще встречалось увеличение объема матки и ее переднезаднего размера – 32/124 (25,8%) против 3/50 (6%) в группе сравнения. Расширение полости матки у родильниц с ПМЭ составило в среднем 12,5 (2,3) мм на 3-и сутки пуэрперия, а в ряде наблюдений – до 22 мм, у здоровых родильниц – до 7,8 (1,2) мм (р<0,05).
При проведении гистероскопии при ПМЭ визуально слизистая оболочка была отечной, цианотичной, с рыхлыми фибринозными отложениями, множеством легко кровоточащих сосудов. При эндометрите после кесарева сечения отмечались выраженные изменения в области швов на матке: частичное расхождение шва, гнойно-фибринозный налет и кровоточащая слизистая. Подозрение на остатки плацентарной ткани обнаружено у 5 пациенток, что потребовало проведения вакуум-аспирации и кюретажа содержимого полости матки. Улучшение самочувствия, уменьшение болевого синдрома, снижение температуры, лейкоцитоза и СРБ отмечалось у всех пациенток после гистероскопии и вакуум-аспирации. Гистологическое исследование соскобов из полости матки выявило обширные, сливающиеся очаги некроза с гнойным расплавлением в центре, отечную строму с густой лейкоцитарной инфильтрацией, очаги кровоизлияний. В ряде случаев отмечено наличие децидуальной ткани с некрозом, распадом, инфильтрацией, по периферии – фрагменты мышечной ткани с обширными кровоизлияниями, рассеянной лейкоцитарной инфильтрацией, на поверхности массивный фибринозный налет. Ретроспективный анализ гистологического исследования последа выявил в 84/124 (67,7%) наблюдениях базальный децидуит, хориоамнионит, виллузит, фуникулит. В 5/124 (4,03%) случаях пациентки после абдоминального родоразрешения были подвергнуты релапаротомии, тотальной гистерэктомии в связи с наличием несостоятельного шва на матке и развитием перитонита. Морфологически подтвержден диагноз гнойно-некротического метроэндометрита, метротромбофлебита и расхождения швов на матке. Обнаружено множество тромбов с гнойным расплавлением и реканализацией в сосудах эндо- и миометрия. Всем пациенткам проведена комплексная терапия, которая включала антибактериальную, инфузионную, противовоспалительную, утеротоническую, антианемическую. Все родильницы выписаны домой в удовлетворительном состоянии.
Заключение
Подводя итог нашему клинико-лабораторному исследованию, хотим отметить, что не всегда лабораторные показатели, в частности цитокины, могут трактоваться однозначно. Если по клиническому течению ПМЭ не выделять группы больных c легкими и тяжелыми формами, то уровень провоспалительных цитокинов преобладает над противовоспалительными. Основные медиаторы воспалительной реакции согласованно взаимодействуют между собой и определяют тяжесть клинического течения заболевания. Нами определено, что пациенты с тяжелым течением ПМЭ характеризовались более высоким уровнем ИЛ-10, СРБ, фибриногена, отношением ИЛ-10 к ФНОα. Выявленные изменения цитокинового баланса при ПМЭ могут использоваться в качестве дополнительного метода для оценки характера его течения. Сопоставление концентрации в крови цитокинов с клинической картиной позволяет врачу судить о тяжести системного воспалительного ответа, а также глубже понять патофизиологические процессы, происходящие у пациенток с послеродовыми воспалительными заболеваниями матки.



