Работа частично поддержана Государственным контрактом Министерства образования и науки РФ № 16.522.12.2009 от 29.09.2011.
Проблема бесплодного брака была и остается весьма актуальной в наше время. По данным статистики примерно 15% супружеских пар в популяции бесплодны, и тенденции к снижению этого показателя не наблюдается. Следует подчеркнуть, что меняется сама структура бесплодия. Если 20 лет назад в структуре бесплодия мужской фактор составлял примерно 30%, то в настоящее время на его долю приходится уже 50% случаев [1–3].
Репродуктивное здоровье мужчин – вопрос, на изучение которого в последнее время направлены многие исследования из-за явного ухудшения показателей спермограммы в современных условиях [4–6]. К факторам, влияющим на количественные и морфофункциональные параметры эякулята, относят: социальные, экологические, а также генетические особенности тех или иных популяций. Кроме того, важно отметить, что некоторые этиологические аспекты мужского бесплодия остаются неизвестными и в современных условиях [3, 7]. Все это позволяет представить масштаб проблемы мужского бесплодия и определяет актуальность данного вопроса не только для врачей репродуктологов, андрологов, но и для здравоохранения и общества в целом.
В настоящее время разработка и активное внедрение в клиническую практику таких методик, как биопсия яичка и интрацитоплазматическая инъекция сперматозоида в ооцит (ИКСИ), подарили реальные шансы мужчинам с тяжелой патозооспермией/азооспермией иметь собственных детей.
Анализ литературных данных выявил ряд нерешенных вопросов, связанных с тактикой обследования супружеских пар с бесплодием. Так, современные методы обследования не позволяют выявить причину мужского бесплодия примерно в 25% случаев [8]. В этом случае устанавливается диагноз идиопатического бесплодия. Предполагается, что данная форма нарушений фертильности является результатом комплексного воздействия неблагоприятных факторов образа жизни и экологии, которые не всегда учитываются клиницистами, а также наличием неизвестных в настоящее время заболеваний. Соответственно, более глубокий клинический и генетический анализ с применением современных возможностей медицины потенциально уменьшил бы долю пациентов с идиопатическим бесплодием, а также определил прогностические маркеры эффективности лечения пациентов с данной патологией.
Патогенез мужского бесплодия продолжает оставаться недостаточно изученным. На сегодняшний день принято считать, что различные, в том числе неизвестные этиологические факторы запускают в целом схожие патогенетические процессы, конечным итогом которых является патозооспермия (снижение количества и/или качества сперматозоидов) [9].
Одной из основных генетических причин сопряженного c патозооспермией мужского бесплодия являются делеции в локусе (регионе) AZF хромосомы Y [10]. Данный локус находится на длинном плече хромосомы Y в регионе Yq11 и содержит около половины ее генов, большинство из которых вовлечены в сперматогенез. Роль делеций данного хромосомного региона в бесплодии была впервые установлена в 1976 г. цитогенетически с помощью метода дифференциальной окраски хромосом [11]. Стандартными цитогенетическими методами выявляют макроскопические делеции Y-хромосомы. С помощью молекулярно-генетических или молекулярно-цитогенетических методов обнаруживают микроделеции [12].
В настоящее время в AZF локусе хромосомы Y, как правило, различают три области – AZFa субрегион, расположенный в проксимальной части длинного плеча хромосомы Y, AZFb субрегион, расположенный в промежуточной части, и AZFс субрегион, расположенный в дистальной части длинного плеча хромосомы Y [13]. Все субрегионы содержат гены или семейства генов, участвующие в сперматогенезе [3].
Помимо деления региона AZF на субрегионы AZFa, AZFb и AZFc, некоторые исследователи предложили выделить четвертый субрегион AZFd, расположенный в проксимальной части AZFc субрегиона [14, 15]. Также рассматривается вопрос о переименовании субрегиона AZFa в субрегион AZF1 и объединении субрегионов AZFb и AZFc в единый субрегион AZF2 в связи с тем, что они частично перекрываются на хромосоме Y [16].
Среди делеций AZF локуса хромосомы Y выделяют полные делеции, при которых происходит утрата всего региона AZF или потеря целого субрегиона, и частичные делеции, при которых отсутствует участок какого-либо субрегиона.
Делеции локуса AZFa встречаются реже, чем делеции других субрегионов. Они обычно связаны с азооспермией, проявляющейся синдромом наличия только клеток Сертоли типа 1 (СКС1), иногда с тяжелой олигозооспермией. СКС1 характеризуется полным отсутствием сперматогенного эпителия семенных канальцев, в связи с чем половые клетки (сперматозоиды и их предшественники) отсутствуют. Делеции части региона AZFb приводят к возникновению олигозооспермии. Делеции, охватывающие весь регион AZFb, связаны с азооспермией, возникшей в результате прекращения мейоза и созревания сперматозоидов на стадии сперматоцитов. В таких случаях пункция яичка, как правило, не позволяет получить зрелые сперматозоиды. Многочисленные исследования показали, что наиболее распространенными являются делеции локуса AZFc, которые приводят к различным нарушениям сперматогенеза – от слабой олигозооспермии до азооспермии. При этом у пациентов с делециями в локусе AZFc и азооспермией при пункции яичка довольно часто могут быть получены и успешно использованы в циклах ИКСИ тестикулярные сперматозоиды [10, 17, 18]. Делеции, включающие весь AZFc регион и выходящие за его границы (AZFb+c и AZFa+b+c), по мнению многих авторов, приводят к полному отсутствию тестикулярных сперматозоидов [17].
Важно учитывать, что делеции AZF локуса хромосомы Y могут быть переданы потомству мужского пола. Кроме того, частичные делеции AZFc субрегиона предрасполагают к возникновению полных делеций в последующих поколениях [19].
Своевременное выявление микроделеций у пациентов позволяет избежать бессмысленного гормонального и хирургического лечения. На сегодняшний день показаниями к проведению исследования AZF локуса являются азооспермия или тяжелая олигозооспермия [20]. Для выявления делеций в локусе AZF и определения их относительного расположения на хромосоме Y молекулярно-генетическим методом обычно используют маркеры STS (Sequence Tagged Sites) – уникальные короткие участки ДНК, расположение которых в геноме известно и которые могут быть амплифицированы при ПЦР. STS-маркеры позволяют судить о наличии, протяженности и границах мутаций генов, при этом не являясь их частью, а располагаясь в непосредственной близости от них. Всего для AZF локуса хромосомы Y было картировано более 300 STS-маркеров [3]. Одновременная детекция нескольких определенных STS-маркеров позволяет выявлять микроделеции локуса AZF в широкой клинической практике.
Согласно рекомендациям EAA (European Academy of Andrology) и EMQN (European Molecular Genetics Quality Network), более 95% микроделеций AZF локуса хромосомы Y могут быть достоверно определены при использовании 6 базовых STS-маркеров – sY84 и sY86 для субрегиона AZFa, sY127 и sY134 для AZFb, sY254 и sY255 для AZFc субрегиона [20]. Тем не менее, некоторые исследователи считают, что более информативно для выявления мутаций в хромосоме Y использование большего числа STS-маркеров [15,21]. Так, спектр используемых STS-маркеров для определения границ микроделеций в AZF локусе может быть расширен за счет маркеров sY615 (AZFa), sY1192, sY1291, sY242, sY1125, sY1197, sY1206, sY142 (AZFb+c) и др.
Таким образом, целью настоящего исследования стала оценка обоснованности применения в клинической практике расширенной панели маркеров STS – sY84, sY86, sY615, sY127, sY134, sY254, sY255, sY1192, sY1291, sY242, sY1125, sY1197, sY1206 и sY142 – для диагностики мужского бесплодия.
Материал и методы исследования
По результатам спермиологического анализа эякулята, который проводился двукратно в соответствии с рекомендациями ВОЗ от 2010 г., в исследование были включены 272 мужчины.
Основную группу составили 146 пациентов с патозооспермией и бесплодием, проходящих обследование на этапе подготовки к программе ЭКО/ИКСИ.
Контрольную группу составили 126 фертильных мужчин с нормозооспермией, имеющие хотя бы одного ребенка.
Медиана возраста мужчин в основной группе составила 35 лет (интерквартильный интервал 30,75–39,5 года), в контрольной группе – 31,5 года (интерквартильный интервал 28–34,5 года).
Всем мужчинам проводился молекулярно-генетический анализ для выявления делеций в локусе AZF хромосомы Y.
Забор крови у обследуемых лиц осуществлялся в стандартные пробирки с ЭДТА. ДНК для проведения ПЦР выделяли из лейкоцитов периферической крови с использованием коммерческих наборов «Проба-Рапид-Генетика» (НПФ «ДНК-Технология», Россия). Полученные образцы ДНК сразу использовали для типирования, либо хранили при -20°С. ПЦР проводили с помощью наборов производства «ДНК-Технология».
Амплификацию и детекцию продуктов амплификации проводили с помощью детектирующего амплификатора «ДТ-96» (НПФ «ДНК-Технология», Россия). Температурный режим амплификации был следующим: денатурация при 94°С – 5 секунд, отжиг, элонгация и детекция флуоресценции при 64°С – 15 секунд (50 циклов). Типирование проводилось по 14 STS-маркерам: sY84, sY86, sY615, sY127, sY134, sY254, sY255, sY1192, sY1291, sY242, sY1125, sY1197, sY1206 и sY142.
Нами были использованы 8 мультиплексных систем для ПЦР со следующими парами праймеров и зондов: система 1 (sY134, sY242), система 2 (sY142, sY255), система 3 (sY615, sY254), система 4 (sY1125, sY84), система 5 (sY1197, sY86), система 6 (sY1206, sY127), система 7 (sY1291). В систему 8 были включены праймеры и зонды для амплификации ДНК гена половой принадлежности (SRY) и праймеры и зонды для амплификации ДНК гена рецептора гормона роста в качестве дополнительного контроля амплификации.
В качестве внешнего отрицательного контроля были использованы 83 образца крови женщин.
При отсутствии амплификации какого-либо из фрагментов ПЦР проводили еще раз и при повторении результата определяли у пациента делецию. Положительный (образец ДНК мужчины-донора) и отрицательные (образец ДНК женщины, отсутствие ДНК) контроли ставили в каждом ПЦР-эксперименте.
При анализе качественных признаков (данные по наличию или отсутствию мутаций) оценивали частоту встречаемости в процентах. Для оценки значимости различий в распределении соответствующих признаков между группами использовали χ2. Различие групп полагали статистически значимым при p<0,05.
Результаты исследования
Общая распространенность делеций в локусе AZF хромосомы Y у мужчин с патозооспермией и бесплодием, которые вошли в основную группу, составила 19,2% (28 из 146). Также при применении данного набора маркеров STS были выявлены делеции у фертильных мужчин с нормозооспермией, их распространенность составила 15,9% (20 из 126).
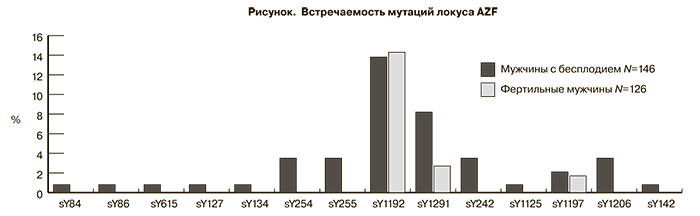
Из 146 обследованных мужчин основной группы были обнаружены следующие AZF-микроделеции: у 20 – микроделеция STS-маркера sY1192 (13,7%), у 12 – микроделеции маркера sY1291 (8,2%), у 5 – маркера sY242(3,4%), у 5 – маркера sY254 (3,4%), у 5 – маркера sY255 (3,4%), в 5 – маркера sY1206 (3,4%), у 3 – маркера sY1197(2,1%), у 1 – маркера sY134 (0,7%), у 1 – маркера sY142 (0,7%), у 1 – маркера sY615 (0,7%), у 1 – маркера sY1125 (0,7%), у 1 – маркера sY84 (0,7%), у 1 – маркера sY86 (0,7%), у 1 – маркера sY127 (0,7%). При этом у 7 пациентов было обнаружено более одной мутации. Так, в одном случае наблюдалась полная делеция AZFa субрегиона с одновременным отсутствием sY1192 (AZFc); в одном случае были полностью делетированы регионы AZFb и AZFc (у пациента обнаружены только маркеры sY84, sY86, sY615, локализованные в регионе AZFa); в 4 случаях при отсутствии более одного маркера наблюдалась частичная делеция региона AZFc, из них в 3 случаях были одновременно делетированы sY1192, sY1291, sY242, sY255, sY254, sY1206, в одном случае отсутствовали sY1197 и sY1192.
Среди 126 обследованных мужчин контрольной группы у 18 человек были обнаружены AZF-микроделеции маркеров sY1192 (14,3%), sY1291 – у 3 человек (2,4%), sY1197 – у 2 человек (1,6%). В этой группе мужчин у 2 человек было выявлено более одной мутации, при этом в обоих случаях делеции наблюдалась в регионе AZFc (в одном случае были делетированы sY1197, sY1291 и sY1192, в другом – sY1197 и sY1291).
Результаты делеционного анализа локусов AZF в обследованных группах представлены на рисунке.
Анализ частот встречаемости делеций маркеров STS в AZF локусе выявил статистически значимые различия только для маркера sY1291, он достоверно чаще выявлялся у пациентов с патозооспермией и бесплодием (χ²(1)=4,424, р=0,035).
Обсуждение полученных результатов
В результате проведенного анализа на наличие мутаций в локусе AZF у мужчин с патозооспермией и бесплодием микроделеции были выявлены в 19,2% случаев. Согласно данным, опубликованным разными исследователями, частота встречаемости микроделеций в AZF локусе хромосомы Y у бесплодных мужчин широко варьирует в различных популяциях – от 3,2 до 43,5% [17, 18, 22, 23]. Эти различия отчасти могут отражать особенности генотипа разных этнических (географических) популяций и мутагенное влияние окружающей среды. Также эти различия объясняются различными подходами при отборе кандидатов для проведения анализа.
До сих пор существуют разногласия о количестве маркеров, используемых для тестирования пациентов. Использование для анализа недостаточного количества маркеров может привести к ошибочным результатам, а использование большего их числа может предотвратить ошибки, но вместе с тем может привести к детекции клинически незначимых полиморфных вариантов.
Сообщалось, что количество маркеров, используемых для скрининга, хоть и незначительно, но влияет на частоту выявляемости делеций [24]. Подбор маркеров для микроделеционного исследования локуса AZF важен для увеличения чувствительности и специфичности анализа. Поэтому для нашего исследования были выбраны маркеры, о специфичности которых сообщалось ранее в нескольких работах [24–26]. При этом для каждого локуса AZF было выбрано несколько маркеров.
Наиболее часто, у 10–20% пациентов, страдающих бесплодием, микроделеции выявляются в AZFc субрегионе [17]. В нашем исследовании у 28 из 146 пациентов была выявлена делеция локуса AZFc, у 1 пациента – локуса AZFb. У одного из 146 пациентов нами была обнаружена микроделеция в локусе AZFa, которые встречаются лишь у 1–5% пациентов [17].
По результатам проведенного ДНК-типирования для диагностики мужского бесплодия не представляет интереса STS-маркер sY1192, так как он с одинаковой частотой обнаруживается как у мужчин с бесплодием, так и у фертильных мужчин (рисунок).
По результатам нашего исследования частота встречаемости делеции STS-маркера sY1291 у пациентов с патозооспермией достоверно выше, чем у фертильных мужчин контрольной группы, следовательно, этот маркер должен быть обязательно включен в диагностическую панель.
Применение STS-маркера sY1197 для диагностики мужского бесплодия по нашим данным остается дискутабельным, и этот вопрос требует дальнейшего исследования на больших выборках пациентов. Однако целесообразность использования данного маркера подтверждается опубликованными исследованиями других авторов [25, 27]. Кроме того, этот маркер важен для точного определения границ делеций, следовательно, исключить его из диагностической панели на сегодняшний день нельзя.
Заключение
Разработка методов диагностики генетических причин мужского бесплодия является приоритетным направлением в проблеме бесплодия. Дифференциальная диагностика генетически обусловленного бесплодия позволяет планировать лечение пациентов и проводить медико-генетическое консультирование перед проведением программы вспомогательных репродуктивных технологий (ВРТ).
Учитывая рекомендации EAA, EMQN и результаты данной работы, молекулярно-генетический скрининг расширенной панели STS-маркеров, а именно sY84, sY86, sY615, sY127, sY134, sY254, sY255, sY1291, sY242, sY1125, sY1197, sY1206 и sY142, для выявления генетических факторов мужского бесплодия может быть рекомендован всем пациентам с бесплодием неясного генеза перед проведением программы ВРТ.
По результатам проведенного исследования не представляет интереса использование STS-маркера sY1192, так как он с одинаковой частотой обнаруживается как у пациентов с патозооспермией и бесплодием, так и у фертильных мужчин.



