Проблема мужского бесплодия чрезвычайно актуальна и находится в фокусе прицельного изучения специалистами в области репродукции, генетики и андрологии. По различным данным на долю мужского фактора приходится примерно 40–50% случаев бесплодия [1–3].
Доказано, что среди причин выраженных нарушений репродуктивной функции у мужчин основополагающую роль играют различные генетические факторы – хромосомные нарушения, а также мутации отдельных генов, влияющих на мужскую репродуктивную систему [3–5].
Одна из главных генетических причин мужского бесплодия, сопряженного с тяжелыми формами нарушения сперматогенеза – делеции AZF локуса хромосомы Y. Распространенность данной мутации среди мужчин с выраженными отклонениями в показателях спермограммы варьирует в различных популяциях и в среднем составляет 10–15% [6–8].
Данные ряда исследований указывают на возможность вертикальной передачи мутаций AZF локуса хромосомы Y от отца сыну, что впоследствии может привести к нарушению репродуктивной функции у потомства [9, 10].
Кроме того, некоторые исследователи предполагают, что наличие микроделеции в AZF локусе хромосомы Y приводит к общей нестабильности этой хромосомы и впоследствии может явиться пусковым механизмом в возникновении анеуплоидии у эмбрионов (интерхромосомный эффект). Так в исследовании, проведенном E. Mateu с соавт. [11], FISH анализа ядер сперматозоидов мужчин с микроделецией AZF локуса хромосомы Y выявил высокий уровень не только дисомии половых хромосом и диплоидии, но и дисомии аутосом. Наличие в сперматозоидах пациентов с мутацией AZF локуса хромосомы Y высокого уровня анеуплоидии как гоносом, так и аутосом, может привести к возникновению хромосомных нарушений у эмбрионов этих пациентов.
В настоящее время в литературе данные относительно исходов программ ВРТ у супружеских пар с микроделецией AZF локуса хромосомы Y немногочисленны, представлены на малых выборках, освещены недостаточно полно и противоречивы [12–14].
Особое внимание исследователей уделяется изучению возможной взаимосвязи между наличием мутации AZF локуса хромосомы Y у мужчин и самопроизвольным прерыванием беременности у таких супружеских пар.
 В литературе имеются сообщения о высокой распространенности микроделеций хромосомы Y среди пациентов с выкидышами у жен в анамнезе (16%) по сравнению с пациентами, имеющими детей, без отягощенного акушерского анамнеза (p<0,05). Таким образом, авторами высказывается предположение, что данная мутация может быть возможным этиологическим фактором спонтанного прерывания беременности [15]. С этими данными согласуются результаты других исследователей, показавших, что частота самопроизвольного прерывания беременности у супружеских пар с делецией AZF локуса хромосомы Y в программе ЭКО/ИКСИ составляет 30,8% [12].
В литературе имеются сообщения о высокой распространенности микроделеций хромосомы Y среди пациентов с выкидышами у жен в анамнезе (16%) по сравнению с пациентами, имеющими детей, без отягощенного акушерского анамнеза (p<0,05). Таким образом, авторами высказывается предположение, что данная мутация может быть возможным этиологическим фактором спонтанного прерывания беременности [15]. С этими данными согласуются результаты других исследователей, показавших, что частота самопроизвольного прерывания беременности у супружеских пар с делецией AZF локуса хромосомы Y в программе ЭКО/ИКСИ составляет 30,8% [12].
Таким образом, супружеские пары с мужским фактором бесплодия и делецией AZF хромосомы Y у мужчин составляют особую группу пациентов. При проведении программы ВРТ у данной группы пациентов нельзя не учитывать особенности их генотипа.
Применение преимплантационной генетической диагностики (ПГД) с выбором для переноса в матку эмбрионов женского пола без генетической патологии может способствовать повышению эффективности программы ВРТ у данной категории пациентов.
Целью нашего исследования стало изучение частоты и структуры хромосомной патологии в эмбрионах у супружеских пар с мужским фактором бесплодия и мутацией AZF локуса хромосомы Y, а также проведение сравнительной оценки эффективности программ ВРТ у данной группы пациентов при проведении ПГД и без нее.
Материал и методы исследования
Были обследованы 439 супружеских пар с мужским фактором бесплодия, которые проходили лечение методом ЭКО/ИКСИ в рамках отделения вспомогательных технологий в лечении бесплодия ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России (руководитель отделения д.м.н. Е.А. Калинина).
По результатам проведенного анализа для исследования были отобраны 46 супружеских пар с нормальными кариотипами супругов, патозооспермией и мутацией AZF локуса хромосомы Y у мужчин. Возраст женщин, включенных в исследование, был до 37 лет. У всех пациенток определяли нормальный овариальный резерв (визуализация по данным ультразвукового исследования не менее 5–7 антральных фолликулов в яичниках с каждой стороны, уровень антимюллерового гормона >1,1 нг/мл, ФСГ <8,0 МЕ/л [16]); не было выявлено отягощенного акушерско-гинекологического анамнеза (эндометриоз III–IV ст., миома матки больших размеров, СПКЯ и др.).
 Все супружеские пары, включенные в исследование, были разделены на 2 группы в зависимости от вида программы ВРТ. Основную группу составили 24 супружеские пары, которым был проведен 41 цикл ЭКО/ИКСИ с ПГД эмбрионов. Группу сравнения составили 22 супружеские пары, которым было проведено 39 циклов ЭКО/ИКСИ без ПГД.
Все супружеские пары, включенные в исследование, были разделены на 2 группы в зависимости от вида программы ВРТ. Основную группу составили 24 супружеские пары, которым был проведен 41 цикл ЭКО/ИКСИ с ПГД эмбрионов. Группу сравнения составили 22 супружеские пары, которым было проведено 39 циклов ЭКО/ИКСИ без ПГД.
Стимуляция функции яичников проводилась по «длинному» протоколу с агонистами гонадотропин-рилизинг гормона и по протоколу с антагонистами гонадотропин-рилизинг гормона с индивидуальным подбором дозы гонадотропинов в зависимости от возраста пациентки и параметров овариального резерва. Культивирование эмбрионов осуществляли по стандартизированной методике.
ПГД проводилась FISH методом с применением зондов к хромосомам X, Y, 13, 18, 21 на 3-й день культивирования эмбрионов. Суммарно в основной группе было проанализировано 159 ядер бластомеров.
Статистическая обработка полученных данных выполнена с использованием пакета прикладных программ Statistica for Windows v. 7.0. Для сравнительного анализа данных в исследуемых группах применялись непараметрические методы (тест Краскела–Уоллиса) и метод χ2.
Результаты исследования и обсуждение
Анализ возрастных характеристик пациенток, включенных в исследование, не выявил статистически значимых различий между группами. Медиана возраста женщин в основной группе составила 30 лет (28–33 года), в группе сравнения – 29 лет (28–35 лет). Однако были выявлены значимые различия по возрасту мужчин – медиана этого показателя составила 34 года (22–56 лет) (p=0,001).
Пациентки исследуемых групп были сопоставимы по параметрам овариального резерва. Также не было выявлено статистически значимых различий в распространенности гинекологических и экстрагенитальных заболеваний между группами.
Анализ репродуктивной функции женщин выявил, что случаи первичного и вторичного бесплодия встречались с одинаковой частотой в исследуемых группах, при этом на долю первичного бесплодия приходилось примерно 80% случаев в каждой группе.
По параметрам фолликуло- и оогенеза, количеству полученных эмбрионов исследуемые группы были сопоставимы.
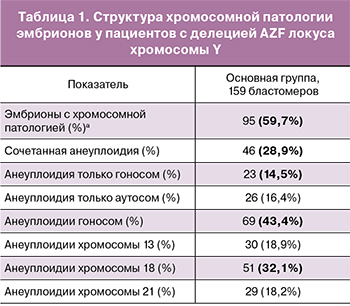
На первом этапе исследования в основной группе был проведен анализ 159 ядер бластомеров, полученных после биопсии эмбрионов на 3-и сутки культивирования. Результаты проведенной генетической диагностики у супружеских пар с мутацией AZF локуса хромосомы Y выявили высокий уровень анеуплоидии у эмбрионов, который составил 59,7%.
В структуре хромосомной патологии преобладала сочетанная анеуплоидия – 28,9%. Анализ данных по гоносомам и отдельным аутосомам выявил высокую частоту анеуплоидии гоносом и хромосомы 18 (табл. 1).
Следует отметить, что у значительной части эмбрионов в основной группе выявлялись анеуплоидии, при которых эмбрионы являются жизнеспособными и могут иметь высокий потенциал к имплантации и развитию, что может привести к рождению детей с генетической патологией. Частота встречаемости моносомии хромосомы Х и патологии гоносом, соответствующей синдрому Клайнфельтера, составила 11,3%, дисомии хромосомы Y – 8,8%. Частота трисомии хромосомы 13 составила 6,3%, хромосомы 18 – 14,5%, хромосомы 21 – 8,8% случаев.
Анализ связи между морфологическими характеристиками эмбрионов третьего дня развития и наличием у них анеуплоидии не выявил корреляции между этими показателями в группах с ПГД (р>0,05). Так, в основной группе у 66,2% эмбрионов «хорошего» качества была выявлена хромосомная патология, 46,3% эмбрионов «плохого» качества не имели патологии по исследованным хромосомам. Также не было выявлено корреляции между наличием анеуплоидии у эмбрионов и примененными протоколами стимуляции (р>0,05).
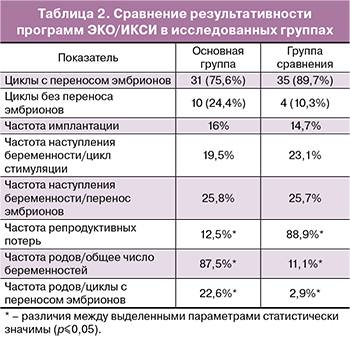
На заключительном этапе работы был проведен сравнительный анализ исходов программ ЭКО/ИКСИ в исследованных группах (табл. 2).
Показатели частоты имплантации были сопоставимы в исследуемых группах и составили 16% в основной группе и 14,7% в группе сравнения. Достаточно низкие показатели частоты имплантации у супружеских пар с делецией AZF локуса хромосомы Y в группе с ПГД могут быть связаны с наличием у эмбрионов анеуплоидии хромосом, анализ которых не производился в рамках ПГД.
Показатели частоты наступления беременности статистически значимо не различались у супружеских пар в исследуемых группах. Частота наступления беременности в расчете на перенос эмбрионов составила 25,8% в основной группе и 25,7% в группе сравнения.
Однако, частота репродуктивных потерь в группе без проведения ПГД была в 7 раз выше, чем с ПГД, и составила 88,9 против 12,5% (р=0,007), что может быть обусловлено наличием анеуплоидии у эмбрионов.
Частота живорождения у супружеских пар с мутацией AZF локуса хромосомы Y в перерасчете на циклы с переносом эмбрионов была в 8 раз выше в группе с ПГД, чем без нее, и составила 22,6 и 2,9% соответственно (р=0,014).
У супружеских пар в основной группе родилось 9 живых детей, в группе сравнения – 1 ребенок.
Заключение
Полученные в ходе проведения исследования данные свидетельствуют о том, что супружеские пары с мужским фактором бесплодия и мутацией AZF локуса хромосомы Y составляют группу риска по невынашиванию беременности и рождению детей с хромосомной патологией, что требует индивидуализации стратегий лечения бесплодия у таких пациентов. С целью повышения эффективности программ ВРТ у данной группы пациентов целесообразно проведение преимплантационного генетического скрининга с анализом полного спектра хромосом у эмбрионов.



