Эндометриоз – это хроническое, доброкачественное, гормонально-зависимое, воспалительное заболевание, характеризующееся присутствием и ростом эндометриальной ткани за пределами полости матки. Эктопическая эндометриальная ткань по морфологическому строению и функциям подобна эндометрию и отвечает на циклические изменения яичниковых гормонов подобно эндометрию в полости матки [1–5]. Определение эндометриоза гистологическое и требует опознаваемого присутствия эндометриальных желез и стромально-подобной ткани за пределами полости матки. Эти эктопические очаги поражения обычно локализуются на тазовых органах и брюшине. Изредка эктопические очаги эндометриоза находят в других частях человеческого тела, таких как почки, мочевой пузырь, легкие и даже головноq мозг. Это хроническое заболевание сопровождается такими симптомами, как дисменоррея, диспареуния, выраженная тазовая боль и бесплодие, которые сильно влияют на социальную жизнь, сексуальное и психологическое благополучие, обычно ослабляя качество жизни больных женщин [1–5]. В структуре гинекологической заболеваемости эндометриоз прочно удерживает 3-е место после воспалительных заболеваний и миомы матки, приводя к значительным нарушениям репродуктивной функции, стойкому болевому синдрому (71–87%) и бесплодию (21–47%). Эндометриоз поражает приблизительно 10% женщин репродуктивного возраста, диагностируется у 35–50% женщин с тазовой болью и бесплодием [1–3].
Предполагают, что при эндометриозе также имеются иммунные изменения на уровне эутопического эндометрия. Таким образом, иммунная система кажется значительно измененной не только в эндометриоидных очагах, но также в пределах эутопического эндометрия от женщин с эндометриозом, затрагивая жизнеспособность и функции эутопического эндометрия [5–10]. Были исследованы изменения в иммунном ответе в пределах эутопического эндометрия от женщин с эндометриозом – распределение макрофагов в эутопическом эндометрии различно между пациентами с эндометриозом и без этого заболевания [8–11]. Сообщалось об увеличении активности макрофагов, наряду с увеличением секреции и синтеза различных провоспалительных медиаторов, цитокинов, фактора некроза опухоли-α, интерейкинов, RANTES, фактора активации тромбоцитов, фактора роста фибробластов, фактора роста гепатоцитов (HGF), факторов роста макрофагального происхождения, сосудистого эндотелиального фактора роста, факторов ангиогенеза и фибронектина в эктопических очагах у женщин с эндометриозом. Их эффекты могут облегчить развитие и манифестацию эндометриоза [5, 6, 8–12]. Хронический эндометрит – это постоянное воспаление слизистой оболочки тела матки с поражением как функционального, так и базального слоя. К постоянным морфологическим признакам хронического эндометрита относится очаговая или диффузная инфильтрация стромы эндометрия, представленная преимущественно плазматическими и лимфоидными клетками [10]. Кроме того, при хроническом эндометрите имеют место и другие морфологические признаки: фиброз стромы, склеротические изменения спиральных артерий. Результаты ряда исследований продемонстрировали, что хронический эндометрит связан с бесплодием и привычным невынашиванием беременности [13–15]. Он был выявлен у 12–46% бесплодных женщин, 30% женщин с повторными неудачными имплантациями при ЭКО, 28% при бесплодии неясного генеза и 12% при необъясненных повторяющихся самопроизвольных абортах [13–15]. Данных по взаимосвязи эндометриоза и патологических изменений эутопического эндометрия недостаточно. Необходимы дальнейшие исследования в этой области, это может предотвратить необоснованное лечение, позволив заподозрить другую патологию.
Цель нашего исследования: определить частоту и структуру патологических изменений в эндометрии женщин репродуктивного возраста с генитальным эндометриозом.
Материалы и методы исследования
В наше исследование были включены 236 пациенток, находившихся на лечении в отделении оперативной гинекологии ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России в 2015–2016 гг. Все женщины были в репродуктивном возрасте (18–45 лет), имели регулярный менструальный цикл и не принимали гормональных препаратов за 6 мес. до оперативного вмешательства. Пациентки были разделены на две группы: 118 женщин с генитальным эндометриозом (основная группа) и 118 женщин без эндометриоза (группа сравнения). Пациентки с генитальным эндометриозом также разделялись на две подгруппы: 20 пациенток с эндометриозом в сочетании с аденомиозом и 98 пациенток только с наружным генитальным эндометриозом. Перед включением в исследование все женщины ознакомились, датировали и подписали информированное согласие в 2 экземплярах, один из которых был выдан на руки пациентке. Протокол исследования был одобрен этическим комитетом.
Всем пациенткам проводили общепринятое клинико-анамнестическое обследование, УЗИ, гистероскопическое и лапароскопическое исследование. Эндоскопическую операцию проводили по стандартизированной методике с помощью эндовидеохирургического оборудования фирмы Karl Storz (Германия). Диагноз НГЭ устанавливали при обнаружении эндометриоидных гетеротопий на брюшине малого таза, матке, маточных трубах, яичниках, при обнаружении кист яичников с характерным «шоколадным» содержимым и при последующем подтверждении диагноза при гистологическом исследовании. Во время лапароскопического оперативного вмешательства производили осмотр органов брюшной полости и малого таза и стадирование эндометриоза по классификации Американского общества фертильности (R-AFS). Оценка распространения эндометриоза варьировала в пределах от 2 до 150 баллов.
Группу сравнения составили 118 женщин, у которых при выполнении лапароскопического исследования не было выявлено эндометриоза. Как правило, это были женщины, поступившие на диагностическое лапароскопическое исследование в связи с бесплодием, а также пациентки со спаечным процессом, параовариальными кистами.
Материалом исследования был эндометрий пролиферативной фазы менструального цикла от пациенток с эндометриозом и женщин без этого заболевания (группа сравнения), полученный при диагностическом выскабливании после гистероскопического исследования.
Для морфологического исследования использовались соскобы эндометрия, полученные в результате диагностического выскабливания слизистой оболочки тела матки. Полученный материал фиксировали в 10% нейтральном формалине с фосфатным буфером, обрабатывали в аппарате гистологической проводки тканей фирмы Shandon и заливали в парафин. Суммарное время фиксации, проводки и заливки материала, как правило, не превышало 48 часов. Затем готовились парафиновые срезы толщиной 4–5 микрон. Срезы фиксировали на предметные стекла и инкубировали в термостате при 37° С в течение 12 часов. Далее срезы обрабатывали в автомате окраски гистологических/цитологических препаратов и заключали под покровное стекло.
Для иммуногистохимического исследования были отобраны те случаи, в которых для постановки окончательного гистологического диагноза необходимо было применять дополнительный метод исследования. К ним относились сложные для диагностики случаи хронического эндометрита, в которых имелись все морфологические признаки хронического эндометрита кроме плазматических клеток, которые при световой микроскопии выявить не удавалось (всего оценено 18 иммуногистохимических препаратов), а также те случаи гиперплазии эндометрия, в которых необходимо было выявить клональность поражения для верификации атипических клеток (всего оценено 2 иммуногистохимических препарата). Для проведения данной части работы готовили срезы толщиной 4 мкм, которые наносили на высоко адгезивные стекла и сушили при температуре 37°С в течение 18 часов. После снятия парафина со срезов их регидратировали в батарее спиртов 95, 80, 70, инкубируя в каждом растворе по 2 минуты. Восстановление антигенной активности проводили в PT Link («Dako») при температуре 97°С в течение 20 мин. в 10 мМ цитратном буфере рН 6,0. Остывшие стекла помещали во влажные камеры (для предотвращения высыхания срезов) и инкубировали 15 минут в 3% растворе перекиси водорода для блокирования эндогенной пероксидазы. Реакцию с первичными антителами проводили в течение 30 минут при комнатной температуре. В исследовании использовались моноклональные антитела к CD 138 (RTU, clone D0-7, Dako, Denmark) и PTEN (клон 6H2.1, разведение 1:100). В качестве вторичных антител использовали систему Dako REAL EnVision (Dako, Denmark). Для визуализации мест связывания антител с антигенами использовали реакцию окисления субстрата 3,3-диаминобензидина (ДАБ) пероксидазой хрена в присутствии перекиси водорода с образованием водонерастворимого конечного продукта коричневого цвета. Для правильной постановки иммуногистохимических реакций ставили положительные и отрицательные контроли. В качестве отрицательных контролей брали образцы исследуемых срезов, которые подвергались стандартной процедуре иммуногистохимической реакции, но без добавления первичных антител. Положительные контроли для каждого антитела выбирали в соответствии со спецификациями от фирмы производителя. После проведения иммуногистохимических реакций срезы контрастировали гематоксилином и заключали в синтетическую среду «Shandon mount TM» (USA). Оценка результатов иммуногистохимических реакций проводилась следующим образом: экспрессию CD138 считали (+) при умеренно-сильной преимущественно мембранной окраске плазматических клеток и подсчитывали количество (+) экспрессированных клеток в препарате. Экспрессию PTEN считали (+) при слабой-сильной цитоплазматической и/или ядерной окраске эпителиоцитов желез. PTEN (-) экспрессия регистрировалась при полном отсутствии экспрессии маркера в железистом эпителии на участке морфологически измененного эндометрия.
При постановке диагноза «хронический эндометрит» пользовались рекомендациями ВОЗ. В тех случаях, когда с помощью светового микроскопа верифицировать плазматические клетки не удавалось, а остальные морфологические признаки хронического эндометрита присутствовали, применялось иммуногистохимическое исследование экспрессии CD 138. Количество позитивно окрашенных плазматических клеток оценивалось на 10 неперекрывающихся полях зрения при увеличении х400. Диагноз хронического эндометрита ставился, если хотя бы одна плазматическая клетка была идентифицирована при наличии других морфологических критериев данного заболевания.
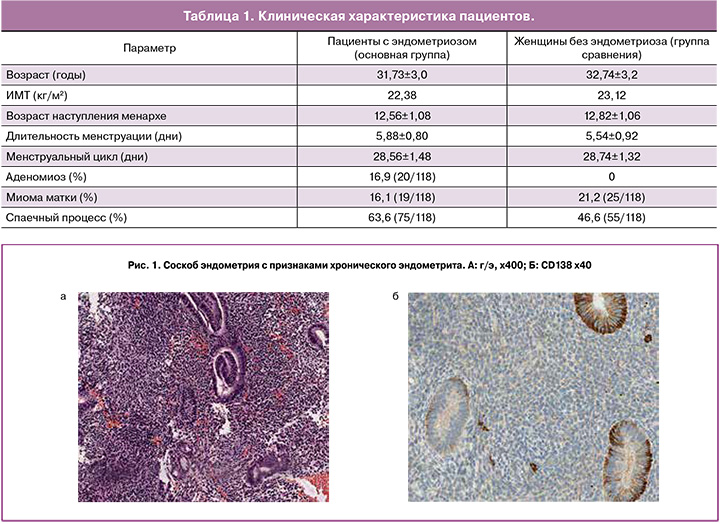
Для диагностики гиперплазии эндометрия (ГЭ) пользовались классификацией ВОЗ 2014 года. В тех случаях, когда оценка цитологической атипии была затруднительной, проводилось дополнительное исследование экспрессии гена – супрессора PTEN. Данный маркер в норме экспрессируется как в железистом, так и в стромальном компоненте, причем окраска может носить ядерный и/или цитоплазматический характер при применении используемого в настоящем исследовании клона. При полной утрате экспрессии данного маркера в железистом компоненте можно судить о клональности поражения, что помогает выявить атипическую ГЭ.
Статистический анализ полученных данных проводили с применением стандартных методов математико-статистической обработки с использованием лицензионных пакетов программ прикладного статистического анализа Office 2003, Statistica 10.0.
Результаты исследования
Клиническая характеристика пациентов
Основную группу составили 118 женщин с эндометриозом. Средний возраст женщин с эндометриозом составил 31,73±3,0 года. У всех женщин наблюдался регулярный менструальный цикл, все были в пролиферативной фазе менструального цикла. Возраст наступления менархе колебался от 12 до 16 лет (в среднем – 12,56±1,08 года). Длительность менструации варьировала от 4 до 7 дней (средняя длительность – 5,88±0,80 дня), а продолжительность менструального цикла – от 26 до 35 дней (средняя продолжительность – 28,56±1,48 дня).
Характерными при обращении за медицинской помощью были жалобы на хронические тазовые боли (у 52,5% больных) и бесплодие (у 44,9%). У 56,4% пациенток бесплодие носило первичный характер, у 43,6% пациенток в анамнезе имелись беременности.
На основе балльной оценки распространенности эндометриоза у больных определяли I степень – 14,4% пациенток, II степень – 39,8%, III степень – 35,6% и IV степень – у 10,2%. У 80,5% пациенток эндометриоз был выявлен впервые, в 19,5% случаев установлен рецидив эндометриоза.
У 61,0% больных выявлены эндометриоидные кисты яичников, размеры которых колебались от 1,5 до 9,0 см (средний размер кисты 3,56±1,08 см), у 20,3% больных при операции обнаружен эндометриоз ретроцервикальной/ректовагинальной локализации. Из 118 пациенток с генитальным эндометризом у 16,9% пациенток также был диагностирован аденомиоз 1–2-й стадии.
Группу сравнения составили 118 женщин, у которых при выполнении лапароскопического исследований не было выявлено эндометриоза. Средний возраст женщин составил – 32,74±3,2 года. У всех женщин наблюдался регулярный менструальный цикл. Возраст наступления менархе колебался от 12 до 16 лет (в среднем – 12,82±1,06 года). Длительность менструации варьировала от 4 до 7 дней (средняя длительность – 5,54±0,92), а продолжительность менструального цикла – от 24 до 35 дней (средняя продолжительность – 28,74±1,32 дня). Таким образом, возраст пациенток и характеристики менструального цикла в основной группе и группе сравнения достоверно не различались (p<0,05). Клиническая характеристика пациентов представлена в таблице.
Частота патологических изменений в эндометрии
Уровень патологических изменений в эутопическом эндометрии от женщин с эндометриозом составил 50% (59/118). Патологические изменения в эутопическом эндометрии от женщин без эндометриоза были диагностированы в 27,1% случаев (32/118). Уровень патологических изменений эндометрия был значительно выше в группе пациентов с эндометриозом по сравнению с женщинами без этого заболевания (р<0,05).
Хронический эндометрит был диагностирован в 22,03% случаев (26/118) в группе пациентов с эндометриозом и 11,02% случаев (13/118) в группе пациентов без этого заболевания. Этот уровень был значительно выше в группе пациентов с эндометриозом по сравнению с группой пациентов без эндометриоза, полученная разница была статистически значима.

Полип эндометрия был выявлен в 17,8% случаев (21/118) среди пациентов с эндометриозом и в 8,47% случаев (10/118) среди пациентов из группы сравнения. Этот уровень был выше в группе пациентов с эндометриозом по сравнению с группой пациентов без этого заболевания, полученная разница была статистически значима.
Гиперплазия эндометрия была диагностирована в 10,17% случаев (12/118) в группе пациентов с эндометриозом и 7,63% случаев (9/118) среди пациентов группы сравнения. Этот уровень был выше в группе пациентов с эндометриозом по сравнению с группой сравнения, однако, разница не была статистически значимой. Среди гиперплазии эндометрия была выявлена гиперплазия эндометрия без атипии и атипическая гиперплазия эндометрия. В группе пациентов с эндометриозом гиперплазия эндометрия без атипии была диагностирована в 9,32% случаев (11/118), атипическая гиперплазия эндометрия – в 0,85% случаев (1/118), в группе сравнения гиперплазия эндометрия без атипии была диагностирована в 7,63% случаев, атипическая гиперплазия эндометрия выявлена не была (рис. 1, 2).
Все пациенты с эндометриозом были разделены на две группы по наличию аденомиоза: 20 пациентов с эндометриозом в сочетании с аденомиозом (1–2-я стадия аденомиоза) и 98 пациентов с НГЭ. Среди пациентов с аденомиозом хронический эндометрит был диагностирован в 25% случаев, полип эндометрия – в 25% случаев, гиперплазия эндометрия без атипии – в 10% случаев, атипическая гиперплазия эндометрия не была выявлена. Среди пациентов с НГЭ хронический эндометрит был выявлен в 21,43% случаев, полип эндометрия – в 16,33% случаев, гиперплазия эндометрия без атипии – в 9,2% случаев, атипическая гиперплазия эндометрия – в 1,02% случаев.
Частота патологических изменений в эндометрии в зависимости от стадии заболевания
Частота хронического эндометрита, полипа эндометрия и гиперплазии эндометрия была проанализирована в зависимости от стадии эндометриоза. Хронический эндометрит был найден в 17,65% при I стадии, 14,89% при II стадии, 23,8% при III стадии и 16,67% при IV стадии эндометриоза. Не было найдено статистически значимых различий по этому признаку между ранними стадиями (I–II) и поздними стадиями (III–IV) эндометриоза. Полип эндометрия был диагностирован в 5,88% случаев при I стадии, 17,02% при II стадии, 23,8% случаев при III стадии и 8,33% при IV стадии эндометриоза. Не было найдено статистически значимых различий между ранними стадиями (I–II) и поздними стадиями (III–IV) эндометриоза. ГЭ была найдена в 5,88% при I стадии, 10,64% при II стадии, 9,52% при III стадии и 16,67% при IV стадии эндометриоза. Не было найдено статистически значимых различий между ранними стадиями (I–II) и поздними стадиями (III–IV) эндометриоза.
Обсуждение
В нашем исследовании, уровень патологических изменений в эутопическом эндометрии был значительно выше среди пациентов с эндометриозом по сравнению с женщинами без этого заболевания (50% против 27,1%). Ретроградная менструация может быть основным инициирующим фактором в патогенезе поверхностного эндометриоза, а генетические и микроэкологические факторы препятствуют элиминации эктопических очагов, способствуя ремоделированию брюшины, которые важны для распространения эндометриоидных очагов [5, 8, 9, 16]. Наличие повышенной частоты патологических изменений со стороны эндометрия может свидетельствовать об изменении свойств эндометрия, который попадает в полость малого таза, что подтверждает теорию ретроградной менструации. Однако эти изменения также могут быть и вторичными по отношению к развитию эндометриоза. По данным другого ретроспективного исследования [17], в котором исследовался эндометрий от 176 женщин с эндометриозом, уровень патологических изменений в эндометрии составил 22,2% [17]. Подобные различия можно объяснить различными критериями в гистологической диагностике некоторых патологий эндометрия.
Значительную роль в развитии эндометриоза, как полагают, играют и воспалительные изменения в эндометрии [5, 6, 8–10]. Хронический эндометрит – это постоянное воспаление слизистой оболочки тела матки с поражением как функционального, так и базального слоя. Хронический эндометрит обычно имеет бессимптомное течение, и поэтому его трудно диагностировать. В нашем исследовании заболеваемость хроническим эндометритом была выше в группе пациентов с эндометриозом по сравнению с группой женщин без этого заболевания. Эти данные совпадают с данными других исследований [10]. По данным пошагового логистического регрессионного анализа только эндометриоз был значительным предиктором хронического эндометрита, также выявили, что заболеваемость хроническим эндометритом была значительно выше среди пациентов с эндометриозом по сравнению с женщинами без эндометриоза (52,94% для группы пациентов с НГЭ по сравнению с 27,02% для группы пациентов без НГЭ) [10]. Однако уровень заболеваемости в обеих исследуемых группах был значительно выше по сравнению с нашими данными: 52,94% против 22,03% для пациентов с эндометриозом и 27,02% против 11,02% для пациентов без эндометриоза. В то же время, K. Kitaya и T. Yasuo иммуногистохимически проанализировали 234 образца, полученных после гистерэктомии по поводу доброкачественной гинекологической патологии, и сообщили, что хронический эндометрит был определен в 11,1% случаев образцов эндометрия [18]. Расхождение с результатами литературы по частоте хронического эндометрита можно объяснить более жесткими критериями постановки диагноза, которые использовались в нашем исследовании. Следует отметить, что четких критериев количества плазматических клеток в эндометрии для постановки диагноза хронический эндометрит не существует. Отдельные авторы считают, что достаточно всего одной плазматической клетки для верификации данной патологии [19]. Однако в нашем исследовании мы придерживались классических критериев для выявления хронического эндометрита, которые могут быть отнесены к более жестким. Так, наличие одной плазматической клетки являлось для нас достаточным для постановки диагноза «хронический эндометрит» только при верификации других морфологических признаков (вышеописанные изменения стромы). В тех случаях, когда отдельные из этих признаков были не выражены, для постановки диагноза «хронический эндометрит» необходимо было выявить не менее 5 плазматических клеток в 10 полях зрения. Данные критерии на наш взгляд являются более оправданными как с гистологической, так и с клинической точки зрения, поскольку отражают совокупность патологических изменений в эндометрии вследствие воспалительного процесса.
Опираясь на полученные данные, мы предполагаем, что, несмотря на различие в абсолютных цифрах процентной доли заболеваемости, наши данные, как и данные мировой литературы, свидетельствуют о большей частоте встречаемости хронического эндометрита у пациентов с эндометриозом. Кроме того, воспалительный процесс в эндометрии женщин с эндометриозом протекает в более тяжелой форме, чем у пациенток не страдающих этим заболеванием.
В нашем исследовании уровень заболеваемости полипом эндометрия был значительно выше в группе пациентов с эндометриозом по сравнению с женщинами без эндометриоза (17,8% против 8,47%). Наши данные совпадают с данными других исследований [17]. Так, например, в исследовании K. Nasu и соавт. полип эндометрия в эутопическом эндометрии от женщин с эндометриозом выявлялся приблизительно в 19,9% случаев [16]. В метанализе, проведенном Q.M. Zheng и соавт., риск развития полипа эндометрия повышен среди женщин с эндометриозом по сравнению с женщинами без этого заболевания [20]. В нашем исследовании также было выявлено, что заболеваемость полипом эндометрия на 2–4-й стадиях эндометриоза выше по сравнению с 1-й стадией. Согласно мета-анализу [20], риск развития полипа эндометрия также выше на 2–4-й стадии по сравнению с 1-й стадией эндометриоза. Однако эти различия не были достоверными [20]. Также не было выявлено взаимосвязи между наличием полипов эндометрия и стадией эндометриоза [21]. Точный патогенез развития эндометриоза и полипов эндометрия не известен. Одна из теорий состоит в том, что оба этих заболевания являются эстроген-зависимыми [20, 22]. Полип эндометрия – это локальный гиперпластический рост эндометриальных желез и стромы, в то время как эндометриоз – это эктопический рост эндометриальных желез и стромы. Оба заболевания включают разрастание эндометрия, а этот процесс требует эстрогеновой поддержки [20, 23]. Характер экспрессии ЭР и ароматазы изменен при эндометриозе и у пациентов с полипом эндометрия. Как фермент, ароматаза может катализировать преобразование андрогенов в эстрогены, увеличивая местную концентрацию эстрогена [5, 7, 8]. Эстрогеновый метаболизм, включающий ароматазу и 17β-гидроксистероиддегидрогеназу 2-го типа (17β-HSD2, фермент, который инактивирует эстрадиол в эстрон), изменен в эутопическом эндометрии у женщин с эндометриозом по сравнению с эутопическим эндометрием у женщин без этого заболевания [7, 23]. Кроме того, увеличение пролиферации и снижение апоптоза наблюдается в эутопическом эндометрии от женщин с эндометриозом по сравнению с женщинами без этого заболевания [5, 6, 8, 24, 25]. Регулятор апоптоза, Bcl-2, как было показано, значительно увеличен в эутопическом эндометрии от женщин с эндометриозом, способствуя ингибированию апоптоза в эндометрии [26]. Эутопический эндометрий от женщин с эндометриозом, как было найдено, отличается от эндометрия женщин без эндометриоза. Увеличение пролиферации, снижение апоптоза и измененный метаболизм в эндометрии от женщин с эндометриозом способствуют появлению полипов эндометрия. Мы также обнаружили, что заболеваемость полипом эндометрия среди пациентов с НГЭ в сочетании с аденомиозом выше по сравнению с женщинами с НГЭ без аденомиоза (25% против 16,33%). Полученные данные совпадают с данными литературы [22]. По данным U. Indraccolo и соавт., только возраст, наличие аденомиоза, повышенное содержание глюкозы в крови и гипертоническая болезнь связаны с наличием полипов эндометрия. Полипы цервикального канала по данным исследования были связаны только с наличием аденомиоза [22]. Предположительно, аденомиоз может вызывать секрецию цитокинов и других медиаторов в маточную жидкость, что может способствовать развитию патологических изменений в эндометрии [22, 27]. Присутствие этих медиаторов может стимулировать рост полипов эндометрия далеко от области, пораженной аденомиозом, а также может вызывать дисрегуляцию экспрессии различных генов в эндометрии в течение менструального цикла, что будет способствовать развитию бесплодия [22, 27]. Исследование L. Shen и соавт. [21] показало повышенную распространенность полипов эндометрия среди женщин с бесплодием в следствии эндометриоза.
Частота хронического эндометрита, полипов эндометрия и гиперплазии эндометрия была проанализирована в зависимости от стадии эндометриоза по пересмотренной классификации Американского общества фертильности (r-AFS). По нашим данным частота патологических изменений в эндометрии не связана со стадией заболевания по пересмотренной r-AFS классификации. Эти результаты предполагают, что хронический эндометрит может быть независимым осложнением эндометриоза или может быть вовлечен в патогенез эндометриоза, так как хронический эндометрит выявляется даже на 1-й стадии эндометриоза [9]. Так как полость матки связана с полостью малого таза посредством маточных труб, клеточные и гуморальные факторы могут свободно перемещаться между этими двумя полостями. То есть некоторые гуморальные факторы или субстанции, продуцируемые в клетках очага эндометриоза в полости малого таза, могут вернуться в полость матки и вызвать инфильтрацию плазматическими клетками стромального компонента эутопического эндометрия. С другой стороны, плазматические клетки эутопического эндометрия, которые характерны только для хронического эндометрита, могут проникнуть в полость малого таза во время менструации, что может вызвать и поддерживать развитие эндометриоза.
Плазматические клетки в эутопическом эндометрии, вероятно, участвуют в устранении бактерий, некоторых органелл и появляющихся неопластических клеток [9]. Приблизительно 25% всех случаев рака связанно с хроническим воспалением, вызванным хроническими инфекциями (например, гепатит B и вирусы C, вирусы папилломы человека 16 и 18, Helicobactor pilori), аутоиммунными болезнями (например, воспалительное заболевание кишечника), или воспалительными заболеваниями неясного происхождения [9, 28, 29]. Экзогенные факторы в состоянии вызвать постоянную воспалительную реакцию. Кроме того, воспалительный компонент присутствует в микросреде большинства опухолей, которые не являются эпидемиологически связанными с воспалением [9, 28]. На ранних стадиях, высокое производство воспалительных медиаторов (например, IL-12, ФНО и реактивных форм кислорода) активирует адаптивный иммунный ответ, способствуя устранению рождающихся неопластических клеток, но также, вероятно, поддержанию неопластической трансформации [30]. Данные факты подтверждают тесную связь воспалительного и неопластического процессов, а поскольку эндометриоз имеет некоторые признаки опухолевого роста, воспаление при нем, как было предположено, также играет существенную роль. В нашем исследовании мы привели данные, подтверждающие эту точку зрения.
Заключение
Наше исследование показало, что частота патологических изменений, таких как хронический эндометрит, полип эндометрия, выше среди пациенток с генитальным энометриозом по сравнению с женщинами без этого заболевания. Возникновение эндометриоидных очагов тесно связано с патологическими изменениями в эндометрии, однако последовательность развития патологических изменений в полости матки и в полости малого таза остается неясной и станет предметом наших дальнейших исследований.



