Влагалищная флора – это многокомпонентная микроэкологическая система, обеспечивающая защиту всех репродуктивных органов женщин как в обычных условиях, так и при патологии. Основными представителями микрофлоры влагалища в норме являются лактобактерии разных видов (Lactobacillus spp.) и в меньшей степени бифидобактерии и коринебактерии, а также анаэробные грамотрицательные палочки рода Fusobacterium и грамотрицательные кокки рода Veillonella. У здоровых женщин репродуктивного возраста ведущее место в вагинальном микроценозе занимают лактобактерии (анаэробного и аэробного происхождения), объединенные под общим названием «палочки Додерлейна», которые составляют более 95% всей микрофлоры влагалища. Бифидобактерии, также как и лактобактерии, защищают слизистую оболочку влагалища от воздействия не только патогенных, но и условно–патогенных микроорганизмов, их токсинов, препятствуют распаду секреторного IgА, стимулируют образование интерферона и выработку лизоцима. У здоровых женщин анаэробная микрофлора превалирует над аэробной в соотношении 10:1 [1–7].
Лактобациллы перерабатывают гликоген, который в большом количестве содержат эпителиальные клетки влагалища женщин репродуктивного возраста, в молочную кислоту, повышая кислотность влагалища. Кроме того, лактобациллы продуцируют перекись водорода. В результате кислая среда влагалища и перекись водорода подавляют рост условно-патогенных микробов (стафилококков, стрептококков, кишечной палочки, анаэробных бактерий, Gardnerella vaginalis, Mobiluncus spp.), которые в небольшом количестве выявляются во влагалище подавляющего большинства женщин. Если доля лактобацилл снижается, их место в экосистеме занимают условно-патогенные микробы (в первую очередь Gardnerella vaginalis). Таким образом, кислая среда влагалищного содержимого, лактобациллы и факторы защиты, которые они продуцируют, образуют мощнейший естественный барьер на пути проникновения патогенных бактерий, защищая верхние отделы полового тракта женщины.
Бактериальный вагиноз (БВ) (прежнее название – вагинальный дисбактериоз) представляет собой общий инфекционный невоспалительный синдром, связанный с дисбиозом влагалища, и сопровождающийся чрезмерно высокой концентрацией облигатно и факультативно анаэробных условно-патогенных микроорганизмов в сочетании с резким снижением количества или отсутствием молочнокислых бактерий в отделяемом влагалища.
Определить истинную частоту встречаемости БВ не представляется возможным в связи с тем, что у 1/3 женщин это заболевание протекает бессимптомно. В немногочисленных исследованиях установлена распространенность БВ в диапазоне от 3,14% у бессимптомных женщин в возрасте от 18 до 72 лет (скрининг в Нидерландах) до 49% у женщин в возрасте от 13 до 65 лет (США). В целом по результатам 21 исследования общая распространенность БВ составила 27,1%, при этом особо не отличаясь в развитых (28,0%) и развивающихся (23,5%) странах [8].
БВ может быть диагностирован клинически или с использованием комплекса клинических критериев, микроскопических, энзимологических, хроматографических методов, а также с использованием качественных или полуколичественных культуральных методов [9].
В мировой медицинской практике пользуются клинико-лабораторными критериями, предложеными R. Amsel (1983) [10]. Диагноз БВ считается подтвержденным при наличии трех или четырех признаков из предложенных критериев.
Самой высокой чувствительностью и специфичностью в диагностике БВ обладает культуральный метод. Его высокая информативность обусловлена качественно-количественными показателями состава микробиоценоза влагалища. Соответственно, при БВ наблюдается уменьшение количества лактобацилл и повышение содержания условно-патогенной флоры. Недостатки метода: относительная дороговизна и длительность выполнения. Исследование ДНК гарднерелл в соскобах из мест поражения методом ПЦР является важным дополнительным критерием БВ.
Невысокая чувствительность критериев Амселя и наличие бессимптомных форм бактериального вагиноза заставило искать другие методы и критерии подтверждения диагноза. В конце 80-х годов C.A. Spiegel предложил использовать балльную систему для диагностики бактериального вагиноза с учетом соотношения морфотипов лактобацилл и вагинальной гарднереллы при микроскопии окрашенного по Граму мазка из влагалища. Однако система не прижилась, и только в 1991 году R.P. Nugent и соавт. предложили свои лабораторные критерии диагностики бактериального вагиноза (Nugent’s Diagnostic Criteria for Bacterial Vaginosis), которыми до сих пор широко пользуются в мировой медицине [11].
В основе лежит система баллов (очков) от 0 до 7 и их комбинация для диагностики и оценки степени бактериального вагиноза по оценке трех бактериальных морфотипов влагалища.
B недавнем исследовании проведено сопоставление критериев Amsel и Nugent, в результате оказалось, что критерии Amsel несколько менее информативны, однако в условиях отсутствия специализированной лаборатории могут быть использованы.
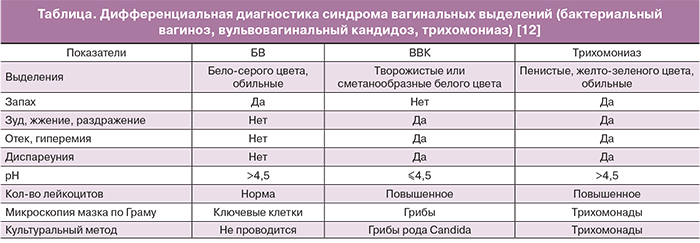
Дифференциальная диагностика синдрома вагинальных выделений представлена в таблице.
В течение десятилетий эти положения казались незыблемыми, но в последние годы появилась новая парадигма: оказалось, что микроорганизмы существуют не изолированно, а в виде биопленок.
При БВ происходит элиминация лактобацилл, сопровождающаяся колонизацией влагалища анаэробами: Fusobacterium, Mobiluncus, Peptostreptococcus, Gardnerella vaginalis. Несмотря на то что БВ характеризуется своей полимикробной природой, основным запускающим процесс микроорганизмом является Gardnerella vaginalis, факультативно-анаэробная грамотрицательная палочка, именно она определяет главную симптоматику БВ.
G. vaginalis обладает уникальной способностью формировать на поверхности урогенитальной слизистой так называемую биопленку. Биопленка (biofilm) – это конгломерат микроорганизмов, расположенных на какой-либо поверхности, клетки которых прикреплены друг к другу. Обычно клетки погружены в выделяемое ими внеклеточное полимерное вещество (внеклеточный матрикс) – слизь. Считается, что 95–99% всех микроорганизмов в естественной среде существуют в виде биопленки. Микроорганизмы образуют биопленку под влиянием массы факторов, включая клеточное распознавание мест прикрепления к поверхности, наличие питательных или, напротив, агрессивных субстанций, кислорода и др. В режиме образования биопленки клетка изменяет свое поведение, что регулируется степенью экспрессии разных генов.
Именно эта биопленка как клей притягивает к себе другие микроорганизмы, образуя конгломерат бактерий, в большинстве своем обладающих патогенным для макроорганизма эффектом. Биопленки, как было установлено, состоят в основном из G. vaginalis, в то время как Atopobium vaginae присутствует в 80% случаев и составляет 40% от массы биопленки. Другие бактерии встречаются намного реже, в том числе бактерии, принадлежащие к родам Bacteroides, Corynebacterium, Lactobacillus, Veillonella, Ruminococcus и Streptococcus [13].
Вагинальные биопсии у женщин без БВ показали в основном свободно распределенные молочнокислые бактерии, в том числе Lactobacillus, Streptococcus, и Enterococcus бактерии.
Основные постулаты концепции биопленок:
- Gardnerella vaginalis может присутствовать во влагалище в свободном состоянии или в режиме биопленки.
- Наличие планктонных или ассоциированных в биофильме Gardnerella vaginalis может быть надежно показано в осадках мочи и у женщин и у мужчин.
- Существует абсолютная конкордантность в переносе биопленки, образованной Gardnerella vaginalis между женщиной с бактериальным вагинозом и ее партнером.
- Gardnerella vaginalis по-видимому, является первым видом, прикрепляющимся к вагинальному эпителию, а затем становится местом адгезии других патогенов.
- Нет достаточно надежной in vitro модели биопленки БВ в настоящее время, что препятствует поиску новых терапевтических агентов [13].
Далее было обнаружено, что G. vaginalis представлена в двух различных состояниях, то есть слущенные клетки существуют либо как диспергированные Gardnerella, состоящие из свободно циркулирующих клеток, указывающих на планктонный рост, либо как сцепленные со слизистой бактерии, состоящие из кластеров клеток с адгезией на эпителии, что свидетельствует о присутствии Gardnerella в виде биопленки [14]. Доказано, что G. vaginalis обладает наибольшей способностью к адгезии и цитотоксичностью в отношении клеток вагинального эпителия. При этом G. vaginalis формирует биопленку значительно более массивную, чем другие БВ-ассоциированные анаэробы [15].
Недавно установлено, что БВ, в отличие от нормального влагалища, характеризуется пролиферирующей структурированной полимикробной Gardnerella-доминирующей биопленкой (STPM). Интактная STPM-Gardnerella биопленка окутана десквамированными вагинальными/препуциальными эпителиальными клетки и секретируется с мочой и спермой. Таким образом, STPM-Gardnerella биопленка представляется своеобразным инфекционным агентом, как правило, заражающим партнера другого пола. Сборка отдельных компонентов STPM-Gardnerella биопленки является не каждодневным процессом, но, вероятно, эволюционным событием с долгой историей роста, размножения и отбора жизнеспособности и возможности изменить окружающую среду. Монотерапия метронидазолом, моксифлоксацином или местными антисептиками подавляет, но не всегда элиминирует STPM-Gardnerella биопленки [16].
Канадские авторы провели исследование, в ходе которого изучалось появление плотной бактериальной биопленки, состоящей из лактобацилл в сочетании с другими условно-патогенными микроорганизмами, и влияние метронидазола на биопленки. Исследователи выяснили, что метронидазол не уничтожает условно-патогенные бактерии, формирующие бактериальную биопленку, но способствует образованию в ней отверстий [17].
Оказалось, что микроорганизмов при БВ гораздо больше, чем мы считали ранее. В процессе выполнения Human Microbiome Project методы молекулярной биологии показали, что существует гораздо большее разнообразие микроорганизмов, ассоциированных с БВ, чем это было очевидно с использованием методов культивирования. Для примера приведем список микроорганизмов, ранее неизвестных при БВ: Atopobium vaginae, БВ ассоциированные бактерии (BVAB-1, BVAB-2 и BVAB-3) из порядка Clostridiales, Megasphaera spp., Leptotrichia spp., Dialister spp., Chloroflexi spp., Olsenella spp., Streptobacillus spp., Shuttleworthia spp., Porphyromonas asaccharolytica [9].
Эти разнообразные организмы аккумулируются, формируя различные сообщества или профили, которые свидетельствуют, что БВ не является единым целым, а синдромом переменного состава, вызывающим разнообразие симптомов, различные фенотипические исходы и приводящий к вариабельности ответов на различные схемы антибиотиков. Некоторые организмы или комбинации организмов обладают высокой специфичностью для БВ, так что в будущем использование молекулярного количественного анализа позволит лучше диагностировать каждый подтип БВ и подбирать индивидуализированную терапию. Например, расовая принадлежность женщины и географический регион, а также различные расовые группы в том же географическом регионе имеют существенные различия, какой микроорганизм является доминирующим в среде влагалища. Так, в США в большинстве популяций L. crispatus является доминирующим изолятом, а у белых женщин L. crispatus и/или L. jensenii более распространены, чем любые другие виды Lactobacillus [9].
В недавнем мета-анализе, включившем более 10 тыс. женщин, доказана связь между БВ и предраковыми состояниями, а именно цервикальной интраэпителиальной неоплазией/дисплазией [8]. Поскольку лишь у небольшой части женщин, инфицированных ВПЧ, развивается дисплазия шейки матки, изучение цервикального канцерогенеза должно включать наличие дополнительных факторов, ему способствующих. Именно этим фактором и является БВ. Биохимические изменения в вагинальных выделениях женщин с БВ включают образование продуктов метаболизма, таких как пропионат и бутират, способные повреждать эпителиальные клетки. Кроме того, БВ-ассоциированные анаэробы выделяют летучие амины (особенно путресцин, триметиламин и кадаверин), которые появляются в вагинальной среде после преобразования аминокислот, полученных из-за обилия анаэробов, и формируют в сочетании с нитритами (производимыми бактериями из нитратов) нитрозамины. Эти канцерогенные соединения способны образовывать аддукты ДНК и, следовательно, мутации. Локальное накопление нитрозаминов во время эпизодов БВ может способствовать клеточной трансформации эпителия шейки матки в комплексе с другими онкогенными агентами, такими, как ВПЧ-инфекция. Кроме того, у пациенток с БВ и дисплазией изменен профиль местного иммунитета шейки, а именно содержание оксида азота (NO) и концентрации цитокинов (ИЛ-6, ИЛ-8 и ИЛ-10). Наконец, еще одним важным дополнительным кофактором цервикального канцерогенеза может быть относительное отсутствие пероксида водорода (H2O2), в обычных условиях производимого лактобактериями. Это препятствует селективной индукции апоптоза, которая представляет собой ключевой элемент стимулируемой лактобактериями противоопухолевой защиты [8].
У небеременных женщин наличие БВ связано с эндометриозом, повышенным риском заражения и передачи ИППП, в том числе хламидийной, гонококковой и ВИЧ-инфекций [18]; первые из них достаточно широко распространены у молодых женщин [19, 20]. Кроме того, Neisseria gonorrhoeae наряду с G. vaginalis также способна участвовать в формировании биопленок [18].
При беременности БВ увеличивает риск пост-абортного сепсиса, раннего выкидыша, привычных выкидышей, позднего выкидыша, преждевременного разрыва мембран, спонтанных преждевременных схваток и преждевременных родов, гистологического хориоамнионита и послеродового эндометрита. В результате аномальная вагинальная флора может предрасполагать к возрастанию колонизации половых путей, инфильтрации плодных оболочек, микробной инвазии амниотической полости и повреждения плода [9].
При тщательном наблюдении за 49 женщинами (вагинальные образцы забирали еженедельно во время беременности и ежемесячно после родов), отмечено, что с риском преждевременных родов связано сравнительно большее разнообразие представленных в родовых путях микроорганизмов, а максимальный риск оказался у женщин, в вагинальных выделениях которых было мало лактобактерий, а также микроорганизмов вида Gardnerella spp и Ureaplasma spp. У большинства женщин выявлены послеродовые нарушения вагинальной микробиоты со снижением Lactobacillus spp и увеличением различных анаэробов, таких как Peptoniphilus, Prevotella и Anaerococcus видов. Это нарушение не связано с гестационным возрастом при родах и сохранялось в течение 1 года после родов. Полученные данные имеют важное значение для прогнозирования преждевременного родоразрешения и понимания потенциального воздействия стойких изменений послеродовой микробиоты на состояние здоровья матерей, в том числе исходов последующих беременностей в случае короткого интервала между ними [21].
И наконец, существуют комбинированные препараты, которые воздействуют на разные компоненты этого микробного биосоциума, успешно разрушая или хотя бы проникая в эту биопленку.
Изучение эффективности комбинированных лекарственных средств показало, что одновременное применение антибактериальной и противогрибковой терапии позволяет значительно снизить количество рецидивов БВ через 104 дня после лечения: с 52% при монотерапии до 33% при комбинированной терапии. С учетом сложившейся ситуации предпочтение в лечении БВ в последние годы отдается комбинированным препаратам для местного применения, в состав которых входят лекарственные компоненты с антианаэробным и антифунгальным действием, что связано с их большей эффективностью и удобством режима применения, обеспечивающим высокую приверженность терапии.
По мнению ряда российских авторов, комбинированный препарат нео-пенотран форте показан в качестве средства стартовой терапии при выявлении инфекционных воспалительных и невоспалительных заболеваний влагалища после проведения обследования с помощью современных методов (метод ПЦР в режиме реального времени) для подбора в случае необходимости патогенетической системной антибактериальной терапии. Особенно это актуально для пациенток при планировании беременности и, в частности, в случаях репродуктивных потерь в анамнезе, а также перед проведением хирургического вмешательства на органах брюшной полости или малого таза [22]. Оба ингредиента нео-пенотран, метронидазол и миконазол нитрат, были созданы в качестве первой линии лечения вагинального кандидоза, бактериальных и трихомонозных вагинитов. Поскольку нео-пенотран содержит оба эти ингредиента, это играет важную роль в лечении вагинита из-за возможности терапии любого или даже всех трех общих типов вагинитов, даже тогда, когда диагноз может быть неопределенным. Нео-пенотран имеет особое значение для немедленного лечения смешанных форм вагинитов. Клинические испытания показали, что нео-пенотран пессарии очень хорошо переносятся, отличаются высокой эффективностью без значительных местных/системных побочных эффектов. Нео-пенотран пессарии могут предотвратить вторичную инфекцию кандидозного вагинита, которые могут возникнуть во время лечения метронидазолом в качестве монотерапии.
В исследовании, проведенном в Стамбуле, было обследовано девяносто семь пациенток с клиническим диагнозом «вагинит» в рамках открытого, не сравнительного исследования. Каждая пациентка использовала один пессарий два раза в день в течение 7 дней. Гинекологические и микробиологические тесты были проведены до лечения, и на 8–10-й, а также 21–23-й день после начала лечения. В результате симптомы вагинита исчезли у 91%, и уменьшились в дальнейшем у 7%. Микробиологические показатели излечения были: 97,3% для трихомониаза, 86,6% для развития бактерий и 81% для кандидозного вагинита. Рецидивы были отмечены в 2,7, 3,8 и 16,1%, соответственно. В целом микробиологические показатели эффективности лечения для смешанной инфекции составили 86%, причем 93% для трихомонозной + бактериальной инфекций, и 73% для бактериальных инфекций + кандидозный вагинит [23].
В другом подобном исследовании симптомы вагинита исчезли в 75% случаев, улучшились в 18% и остались неизменными в 7%. Успешное излечение составило 80% для трихомониаза, 93,4% для бактериального вагиноза и 84,4% для кандидозного вагинита [24].
Недавно в России зарегистрирован нео-пенотран форте л. Каждая доза нео-пенотран форте л содержит 750 мг метронидазола и 200 мг миконазола нитрата плюс 100 мг лидокаина. Доза применяется один раз в день в течение 7 дней. Наличие лидокаина служит для уменьшения таких симптомов, как зуд и боль, а также жжение, диспареуния, вызванные раздражением и воспалением в связи с вагинитом, которые отмечаются более остро в течение первых 3 дней лечения.
Изучение эффективности комбинированных лекарственных средств показало, что одновременное применение антибактериальной и противогрибковой терапии позволяет значительно снизить количество рецидивов БВ через 3 месяца после лечения с 52% при монотерапии до 33% при комбинированной терапии. С учетом сложившейся ситуации предпочтение в лечении БВ в последние годы отдается комбинированным препаратам для местного применения, в состав которых входят лекарственные компоненты с антианаэробным и антифунгальным действием, что связано с их большей эффективностью и удобством режима применения, обеспечивающим высокую приверженность терапии.
Наиболее детально изучено применение препарата в Научном центре акушерства, гинекологии и перинатологии им. академика В.И. Кулакова. Под наблюдением находились 80 женщин в возрасте 18–42 лет. По результатам клинико-лабораторного обследования у 49% женщин установлен диагноз БВ, у 16% – ВВК, у 14% – неспецифический вагинит, у 21% – смешанная бактериально-грибковая инфекция. Всем женщинам был назначен препарат нео-пенотран форте л по 1 суппозиторию интравагинально на ночь в течение 7 дней. Эффективность терапии оценивали через 10 дней и 1 мес после ее окончания. Критериями излеченности считали отсутствие жалоб и клинических проявлений воспалительного процесса при объективном осмотре, а также отрицательные результаты контрольных лабораторных исследований. На фоне проводимой терапии у подавляющего большинства (81,3% пациенток) – отмечалось значительное уменьшение клинических симптомов заболевания уже на 2–3-й день лечения, которые окончательно исчезли к 4–7-му дню, что демонстрирует высокую эффективность местной комплексной терапии. Через 10 дней после окончания лечения слабовыраженные клинические проявления в виде умеренных влагалищных выделений, сопровождающихся незначительным дискомфортом в области наружных половых органов, отмечались у 2 (2,5%) пациенток. При гинекологическом осмотре гиперемии и отека слизистой влагалища и тканей вульвы у данных пациенток не выявлено. Клинико-лабораторная эффективность лечения при оценке через 1 мес после лечения составила 93,7%. Побочных эффектов и аллергических реакций при применении суппозиториев нео-пенотран форте л не наблюдалось ни у одной пациентки [25].
Таким образом, применение комбинированной местной терапии неспецифической патологии вульвовагинальной зоны необходимо:
- при вагинозе/вагините, исходя из вышеописанных критериев;
- при невозможности проведения полноценной диагностики, либо сомнения в достоверности установленного диагноза;
- в случае невозможности или противопоказаний к проведению системной терапии антибактериальными средствами.



