Несмотря на многочисленные теории развития преэклампсии, исследователи почти единогласно сходятся во мнении, что патогенез заболевания связан с гиперактивацией иммунной системы при беременности, в том числе и ее гуморального звена [1].
Гиперактивация является следствием чрезмерного системного воспалительного ответа (СВО) и эндотелиальной дисфункции, признаки которой наблюдаются у всех пациенток с преэклампсией [2, 3]. Под эндотелиальной дисфункцией понимают стадию, следующую за активацией эндотелия и проявляющуюся в изменении функциональной активности клеток, что ведет к изменению/потере способности эндотелия как органа выполнять свою функцию и дисбалансу факторов, обеспечивающих нормальное функционирование всех эндотелий-опосредованных процессов [4, 5]. Эндотелиальная дисфункция является следствием хронической эндотелиальной активации и может вести к необратимому поражению эндотелиальных клеток, апоптозу, некрозу [4].
В крови пациенток с преэклампсией обнаруживается комплекс гуморальных факторов, свидетельствующих об активации эндотелия (цитокины, хемокины растворимые формы молекул клеточной адгезии, компоненты эндотелиального гликокаликса, прокоагулянтные факторы), снижается концентрация молекул с антитромботическими свойствами, повышается число свободно циркулирующих эндотелиальных клеток [5, 6]. Однако относительно гуморальных факторов адаптивного иммунитета, отражающих активированное состояние эндотелия при преэклампсии, существуют лишь единичные данные.
Провоспалительные воздействия на эндотелиальные клетки с неизбежностью должны затронуть молекулярную архитектуру гликокаликса, что проявляется в изменении представленности функциональных углеводных остатков гликокаликса, а также в шеддинге его компонентов и появлении их в крови [7]. Структурные изменения гликокаликса могут привести к формированию DAMP (Danger Associated Molecular Patterns) [1, 8], то есть неоантигенов, к которым могут появиться ауто-антитела, что может сдвигать гомеостатический баланс в пуле естественных антител, существующий в норме. Значительная часть естественных антител человека направлена к гликанам поверхности клетки [9], при патологических состояниях спектр этих антител меняется, что справедливо и по отношению к антителам, мишенями которых являются гликаны гликокаликса. Известно, что мишенями антиэндотелиальных антител (АЭАТ), которые могут как выполнять регуляторную функцию [10], так и выступать в качестве ключевого звена в гуморальном аутоиммунном ответе против эндотелия при патологиях, являются также и углеводные молекулы, в частности гепарин [11].
Цель исследования: определить спектр аутоантител к эндотелиальным клеткам и компонентам гликокаликса в сыворотке крови пациенток с преэклампсией и исследовать взаимосвязь между ними.
Материал и методы исследования
Проводилось проспективное исследование случай-контроль. Основную группу составили 28 пациенток с преэклампсией в III триместре беременности. В группу сравнения были включены 30 условно здоровых беременных. Критериями исключения были: тяжелая экстрагенитальная патология, острые воспалительные заболевания, гемотрансфузия и трансплантация органов в анамнезе, иммуноглобулинотерапия, применение препаратов, влияющих на выработку антител. Клиническая характеристика пациенток, включенных, в исследование представлена в табл. 1.

Для определения антигликановых антител (АГАТ) в периферической крови использовали микрочипы, содержащие 374 гликана, напечатанных как описано ранее [12], в том числе гиалуроновая кислота (ГК) степени полимеризации ~12. Чипы инкубировали с исследуемыми сыворотками как описано в [13], после чего связавшиеся с гликанами антитела проявляли вторичными антителами против IgG или IgM, флуоресцентно мечеными Alexa555 и Alexa647 соответственно (Invitrogen, США). Сигналы считывали с помощью флуоресцентного сканера ScanArray Gx (Perkin Elmer, США). Полученные данные обрабатывали с помощью программного обеспечения ScanArrayExpress 4.0, используя метод фиксированных колец диаметром 70 мкм. Значимыми считались величины флуоресценции, превышающие фоновое значение (то есть величину сигнала от поверхности, не содержащей лиганд) в 5 раз. Уровень АГАТ (отражающий аффинность антител и их количество) характеризовали с помощью медианы интенсивностей флуоресценции повторов лигандов гликочипа.
Для выявления АЭАТ использовали клетки линии EA.hy 926 (ATCC, CRL-2922, США), полученные путем гибридизации первичной культуры человеческих эндотелиальных клеток (HUVEC) с клетками карциномы легкого A-549 [14]; использованные клетки воспроизводят все основные морфологические, фенотипические и функциональные характеристики, присущие эндотелиальным клеткам макрососудов.
 Изучение активности связывания АЭАТ представленных иммуноглобулинами классов M и G осуществляли методом проточной цитометрии на цитофлуориметре FACSCalibur («Becton Dickinson», США) [15].
Изучение активности связывания АЭАТ представленных иммуноглобулинами классов M и G осуществляли методом проточной цитометрии на цитофлуориметре FACSCalibur («Becton Dickinson», США) [15].
Клетки инкубировали с исследуемыми сыворотками, после чего обрабатывали флуоресцентно мечеными вторичными антителами, специфичными к Fc-фрагменту IgG человека или μ-цепи IgМ человека (Sigma, США). Затем образцы отмывали, добавляли иодид пропидия и анализировали на проточном цитофлуориметре. Активность связывания АЭАТ с поверхностными антигенами характеризовали, оценивая процент живых клеток, которые связывают антитела из образца крови (ПЦМ%) и количество антител, связавшихся с клеткой (модальное значение распределения клеток по интенсивности флуоресценции, выраженное в условных единицах флуоресценции (уеф).
Статистическая обработка полученных данных производилась с помощью электронных таблиц Microsoft Office Excel, пакета прикладных программ IBM SPSS Statistics Standard for Windows и программного обеспечения R (разработчик – The R Foundation for Statistical Computing). Нормальность распределения оценивалась согласно критерию Шапиро–Уилка. Достоверность различия значений в рассматриваемых группах оценивалась при помощи теста Уилкоксона–Манна–Уитни (WMW-тест). Различия считали достоверными при уровне значимости р<0,05. Исследованные количественные показатели представлены в виде Ме (L-H), где Ме – медиана, L – нижний квартиль, Н – верхний квартиль.
Результаты исследования
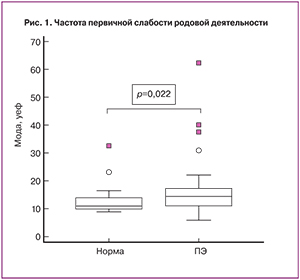
У всех беременных были выявлены АЭАТ, причем показатели активности связывания антител представленных иммуноглобулинами класса M – АЭАТ (IgM) были высокими как в основной группе: ПЦМ% составил 89,4 (85,9–95,6%); мода 52,0 (46,0–66,9) уеф, так и в группе сравнения ПЦМ% 93,8 (89,2–95,9%); мода 57,0 (51,0–69,7) уеф; р>0,05. Значимые различия были выявлены для антител представленных иммуноглобулинами класса G – АЭАТ (IgG), но у женщин с преэклампсией их содержание было выше по сравнению с здоровыми беременными: значения моды составили 14,5 (12,0–16,0) уеф и 11,0 (11,0–13,0) уеф соответственно; р=0,02 (рис. 1). Значения ПЦМ% составили 6,9 (5,5–10,0%) в основной группе и 6,1 (5,1–7,4%) в группе сравнения (р=0,2).
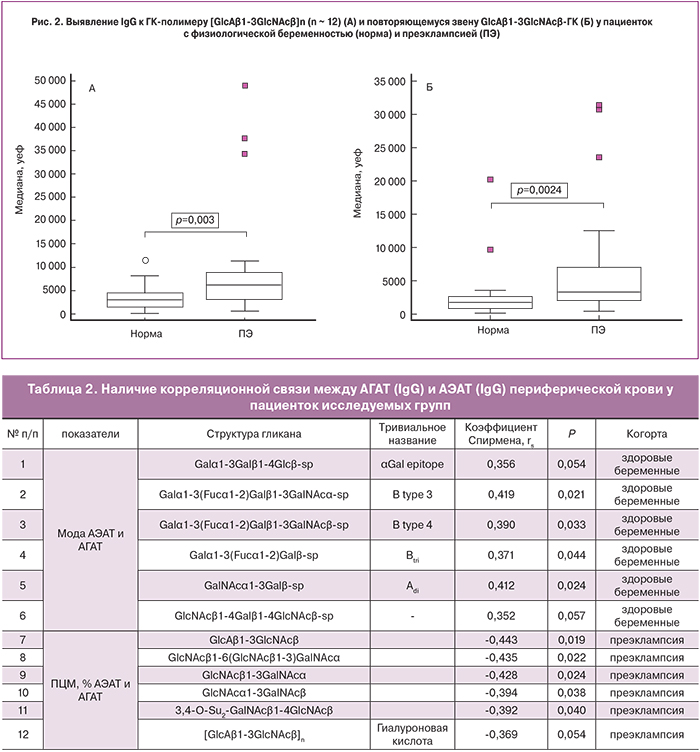
Среди АГАТ особый интерес вызывают антитела против гликанов, являющихся компонентами гликокаликса эндотелиальных клеток, поскольку, возможно, именно они являются мишенями для АЭАТ. Нами установлен значимо повышенный уровень антител к ГК [-4GlcAβ1-3GlcNAcβ1-]n для пациенток основной группы, значение медианы составило 6213 (3159–7805) уеф относительно группы сравнения – 2937 (1834–4235) уеф (р=0,0027) (рис. 2А). Кроме того, выявлены антитела к дисахридному повторяющемуся звену GlcAβ1-3GlcNAcβ этого регулярного полисахарида: медиана в группе с преэклампсией – 3196 (2214–5111) уеф, в группе сравнения – 1524 (1014–2101) уеф (р=0,0022). Причем достоверное повышение уровня наблюдалось только для антител класса IgG (рис. 2Б). Наличие прямой корреляции между этими двумя показателями в группе здоровых беременных (rs=0,677, p=0,0006) и в группе с преэклампсией (rs=0,784, p=0,00001) позволяет считать антитела, связывающиеся с полимером и с его фрагментом, идентичными, или, по крайней мере, близкими по эпитопной специфичности.
При изучении зависимости между активностью связывания АЭАТ (ПЦМ%) и уровнем АГАТ у пациенток основной группы были выявлены отрицательные корреляционные связи с антигиалуроновыми антителами. В группе сравнения установлены связи между активностью связывания АЭАТ (мода) и уровнем ряда АГАТ. Прямые корреляционные связи наблюдались с уровнем антител к Galα-терминированным гликанам, в том числе антигенам группы крови В (табл. 2).
Обсуждение
Выявленное повышение, по сравнению с нормой, активности связывания АЭАТ (IgG) с эндотелиальными клетками, а также высокий уровень антител к ГК и ее структурному дисахариду являются, вероятно, результатом эндотелиальной активации, наблюдаемой при преэклампсии. Как свидетельствуют полученные результаты, у всех беременных отмечается высокая активность связывания АЭАТ (IgM) с клетками, однако значимые различия между группами выявлены только для АЭАТ (IgG) при относительно невысоких (по сравнению с АЭАТ (IgM); p<0,01) характеристиках активности связывания антител. Это, вероятно, объясняется гетерогенностью АЭАТ, поскольку антигенные детерминанты для связывания с антителами на эндотелии до конца не охарактеризованы [16].
Под гетерогенностью АЭАТ подразумевают не только связывание с разными антигенными мишенями, но и функциональную гетерогенность, то есть различный эффект на эндотелиальные клетки [17]. Известно, что АЭАТ выявляются не только при патологии, но и у здоровых доноров. Предполагается, что у человека имеется определенный спектр естественных АЭАТ (еАЭАТ), представленный антителами к ограниченному числу молекул. Последние выполняют регуляторную функцию, контролируют активацию эндотелиальных клеток и оказывают противовоспалительный и противотромботический эффект, а также выступают в качестве факторов, ингибирующих пролиферацию эндотелиальных клеток у здоровых людей [10, 16]. У некоторых здоровых пациентов, кроме консервативных еАЭАТ, был идентифицирован ряд белков, относящихся к разным семействам биологически активных молекул [18]. Эти данные свидетельствуют об индивидуальных различиях спектра еАЭАТ у человека и подтверждают гетерогенность пула АЭАТ. Полученные нами данные позволяют предполагать, что АЭАТ выполняют разные функции у больных и здоровых пациентов.
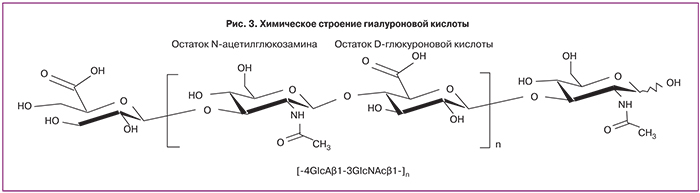
ГК по химическому строению относится к линейным, несульфатированным гликозаминогликанам и является одним из основных компонентов внеклеточного матрикса (ВКМ), в том числе и эндотелиального гликокаликса. Структурной единицей ГК являются повторяющиеся мономеры, состоящие из остатков D-глюкуроновой кислоты и N-ацетилглюкозамина (рис. 3) [19].
Как известно, у здоровых людей ГК присутствует в лимфе (40–55 мкг/мл) и крови (10–100 мкг/л) [20], при патологии отмечается повышение ГК в биологических жидкостях [21, 22]. Имеются данные о повышенном содержании ГК в крови пациенток с преэклампсией [23] и HELLP-синдромом [24]. Повышение ГК в циркуляции предполагает поступление ее в лимфатические узлы, контакт с антигенпрезентирующими клетками и, соответственно, возможность осуществления гуморального ответа на аутоантиген [25]. Интенсивность гуморального ответа при преэклампсии может быть значительно повышена, так как в условиях черезмерного СВО происходит слущивание клеток синцитиотрофобласта и поступление клеточного дебриса в кровь матери, что является фактором усиления СВО, а также провокации аутоиммунного ответа, поскольку клеточный дебрис и субклеточные частицы трофобласта могут выступать в качестве адъювата для аутоантигенов матери [2].
Выраженный гуморальный ответ против ГК и ее структурного дисахарида при преэклампсии может быть свидетельством: во-первых, функциональных изменений гликокаликса эндотелиальных клеток – комплексной структуры, состоящей из заякоренных в мембране протеогликанов и гликопротеинов, а также включенных секретируемых молекул [26]. За счет связей с малыми протеогликанами ГК стабилизирует структуру гликокаликса, обеспечивая выполнение его основных функций: регуляциию физиологических и патофизиологических процессов в сосудистом русле (проницаемости, тонуса, свертываемости крови, воспалительного процесса) [27]. Антитела к ГК и ее структурным сахарам могут выступать в качестве ингибиторов биосинтеза и регенерации гликокаликса, блокируя наращивание углеводной цепи ГК, что увеличивает жесткость и резистентность периферических артерий [28]. Отсутствие или сниженная регенерация эндотелиального гликокаликса может быть одним из факторов дестабилизации системной гемодинамики при преэклампсии.
Во-вторых, высокий уровень антител к ГК при преэклампсии может быть также свидетельством нарушенных процессов организации трехмерной решетчатой структуры ВКМ [29], которая выполняет функции фильтра и является первой линией для межклеточного взаимодействия: адгезии, миграции и последующего проявления функциональной активности [25].
Предполагается, что ГК может иметь ключевое значение в опухолевой инвазии, поскольку существует прямая связь между увеличением экспрессии ГК и erbB2 (HER-2/neu) опухолевыми клетками, что способствует активации соответствующего сигналлинга и свидетельствует о значении ГК для манифестации инвазивного клеточного фенотипа [30].
В-третьих, установленная в данном исследовании обратная корреляционная связь между активностью связывания АЭАТ(IgG) эндотелиальными клетками и уровнем антигиалуроновых антител (IgG) в крови позволяет высказать предположение о возможном участии последних в связывании АЭАТ с клеткой. Наличие связи может быть обусловлено присутствием третьего фактора, предположительно – свободной несвязанной ГК. Мы предполагаем, что повреждающее действие на эндотелиальные клетки оказывают АЭАТ класса G, уровень которых повышен у больных пациенток. По-видимому, АГАТ (IgG), препятствуют цитотоксическому действию АЭАТ, но вследствие разрушения гликокаликса при воспалительном ответе и возрастании количества циркулирующей гиалуроновой кислоты протективное действие АГАТ нивелируется. Поскольку ГК обнаруживается в крови в свободном виде [20], то циркулирующий полимер частично маскирует антитела; в действительности уровень антител при преэклампсии должен быть повышен даже в более заметной степени, чем выявляется в наших экспериментах. Косвенно это подтверждается фактом, что только уровень IgG, но не IgM-антител (имеется в виду усредненный уровень для всей когорты) увеличивается при патологии; это можно объяснить предпочтительной нейтрализацией именно иммуноглобулинов M циркулирующей мультивалентной ГК.
Заключение
Таким образом, выявленный в данном исследовании гуморальный ответ на антигены эндотелиальных клеток является подтверждением выраженной эндотелиальной активации, которая является одним из основных патогенетических факторов развития преэклампсии. Полученные данные позволяют выдвинуть гипотезу о роли гликокаликса в патогенезе заболевания, поскольку основные звенья патогенеза – нарушенная инвазия клеток трофобласта в маточные спиральные артерии, приводящая к неадекватной перфузии фето-плацентарной системы и ишемии, а также эндотелиальная дисфункция, являющаяся причиной эндотелиоза и повышенного сосудистого тонуса у больных преэклампсией, связаны с нарушенными межклеточными взаимодействиями и утратой клетками способности к выполнению своих функций. В этой связи ГК как одна из основных структурных единиц гликокаликса может быть значима как для локомоции клеток при ее взаимодействии с рецепторами, так и для процессов механотрансдукции, регулирующих сосудистый тонус. Дестабилизация и слущивание гликокаликса при чрезмерном СВО критически меняет ответ эндотелиальных клеток на механические стимулы, поскольку сокращение слоя гликокаликса снижает механочувствительность клеток эндотелия, что в условиях увеличения кровотока оказывает сосудосуживающий эффект, а также влияет на проницаемость гломерулярного фильтра – проницаемость возрастает, что выражается в появлении протеинурии. Поэтому гликокаликс может явиться основной точкой приложения для действия повреждающих факторов при преэклампсии, поскольку его повреждение способно приводить к появлению клинических симптомов болезни. Наличие циркулирующих антител к ГК, которая выполняет функции организации и стабилизации трехмерной структуры гликокаликса, потенциально может быть неблагоприятным прогностическим фактором, причем не только для пациенток с преэклампсией, но и для пациенток с гипертензивными расстройствами, также и вне беременности. Высокий риск развития сердечно-сосудистых заболеваний у пациенток, перенесших преэклампсию в анамнезе, может быть связан с присутствием аутоантител к ГК, которые способны блокировать регенерацию гликокаликса до физиологической нормы. Полученные данные могут способствовать расширению знаний о патогенезе преэклампсии, а также иметь практическую реализацию в диагностике и прогнозе заболевания.



