Анемия остается самым частым изменением со стороны системы крови, несмотря на многообразие терапевтических подходов и фактически полное понимание патологических процессов, лежащих в ее основе. Накопление знаний о патогенезе различных форм анемии, степени их влияния на качество жизни и вероятность осложнений у женщин, а также на развитие детей, внутриутробно перенесших материнскую анемию, диктует необходимость систематизации подхода к раннему выявлению, дифференциальной диагностике и терапии анемии у женщин репродуктивного возраста.
В целом известно, что анемия является одной из наиболее распространенных проблем здравоохранения в мире, затрагивающей почти 2 млрд населения, в том числе 0,5 млрд женщин репродуктивного возраста [1]. Примерно 40% фертильных женщин вне беременности имеют сниженные запасы железа в организме, т.е. начальные явления дефицита железа [2]. Железодефицит (ЖД) определяется как состояние, при котором доступность железа недостаточна для удовлетворения потребностей организма [3]. При отсутствии коррекции ЖД снижается гемоглобин и развивается железодефицитная анемия (ЖДА).
У женщин снижение запасов железа в первую очередь связано с воздействием репродуктивных факторов (менструальный цикл, периоды беременности и лактации). Нередко особенности питания и сопутствующие заболевания желудочно-кишечного тракта являются дополнительными причинами анемии. Также известны другие причины анемии, требующие обязательного исключения при планировании терапии анемии: хронические заболевания, в первую очередь воспалительные процессы, патология щитовидной железы, последствия перенесенных оперативных вмешательств, значительно снижающих резервы усвоения питательных веществ (в частности, бариатрические операции, нередко выполняемые женщинам репродуктивного возраста) [4].
Особенности метаболизма железа у женщин
Почему железо имеет такое значение? Известно, что железо играет глобальную роль в клеточной активности и физиологических процессах. Чаще всего обсуждается его роль, связанная с обеспечением уровня гемоглобина, адекватного для полноценной оксигенации организма [5]. Однако железо не менее важно для энергетического обмена, синтеза ДНК, а также обеспечения специальных клеточных функций нервной и иммунной систем. Организм содержит 2500–4000 мг железа, из которых 1800 мг находится в эритроцитах [6]. Не считая менструации, примерные потери железа в день составляют 1–2 мг. Всасывание железа из пищи обеспечивает примерно 1,5–3,4 мг железа в день. Усвоение железа контролируется преимущественно гепцидином (пептидный гормон, синтезируемый печенью) [7]. Когда содержание железа избыточно, гепцидин повышается и снижает всасывание железа, когда же запасы истощены, он снижается, чем усиливает поступление железа [8]. Функциональный ЖД существует, когда железо не может мобилизоваться для эритропоэза, несмотря на адекватные запасы, и считается, что он вызван провоспалительной активацией с избытком гепцидина.
Потребность в железе варьирует в течение жизни женщины, особенно важно его адекватное удовлетворение в репродуктивном возрасте. Регулярный менструальный цикл в целом создает дополнительную потребность в железе. Во время беременности женщине необходимо дополнительно 500—1000 мг железа вследствие расширения объема плазмы и массы эритроцитов, а также ввиду нарастающих потребностей плода.
Потребности в железе во время беременности прогрессивно растут, достигая 10-кратного повышения к III триместру по сравнению с первым [9].
Беременность, лактация, а также кровотечения (к примеру, меноррагии), значительно повышающие расход железа, не могут быть восполнены пищей и приводят к истощению запасов железа, а нередко – и к анемии [10]. Поэтому чрезвычайно важно знать о предсказуемом повышении потребности в железе у таких женщин, а также своевременно распознавать и корректировать уже развившийся дефицит. Именно акушер-гинеколог, на приеме у которого с большей вероятностью окажется женщина, имеющая нарушения менструального цикла или планирующая беременность, должен быть насторожен относительно различных стадий ЖД. Данный факт обосновывает необходимость рутинного исследования показателей запасов железа акушером-гинекологом до наступления беременности с целью выявления скрытого дефицита железа и определения необходимости его коррекции. Особую группу риска ЖД составляют женщины с меноррагией [11]. Также чаще встречается ЖД во второй половине беременности, при ранее выявляемых эпизодах ЖДА, многоплодной и повторных беременностях [12].
В целом основные причины развития анемии можно разделить на связанные с недостаточным синтезом гемоглобина либо с избыточным разрушением эритроцитов – гемолизом. Основными факторами, приводящими к недостаточной выработке гемоглобина, являются ЖД, дефицит фолатов, витамина В12, аутоиммунные и другие хронические воспалительные заболевания. Гемолиз эритроцитов может быть аутоиммунным (в результате воздействия антиэритроцитарных антител) или происходить вследствие неиммунных причин – наследственных дефектов эритроцитов и гемоглобина (сфероцитоз, эллиптоцитоз, талассемия, серповидноклеточная анемия) либо механического повреждения эритроцитов, например, при протезированных клапанах сердца. Тактика терапии определяется этиологией процесса.
Негативные эффекты железодефицитной анемии у беременных
Почему так важно на любом этапе репродуктивного возраста женщины сохранять адекватные запасы железа? Несомненно, здоровье и самочувствие самой женщины имеют важнейшее значение, но в контексте беременности добавляется риск негативного влияния на плод, внутриутробно испытывающий ЖД, а также повышается восприимчивость к инфекциям, выше риск акушерских кровотечений, а соответственно, и возможная потребность в заместительных гемотрансфузиях [15]. Также исследователи отмечают повышение вероятности послеродовых кровотечений [16] и даже вероятное повышение риска смерти от послеродовых кровотечений [17].
ЖДА во время беременности может неблагоприятно влиять на потомство ввиду повышенного риска преждевременных родов и низкой массы тела при рождении, задержки физического и умственного развития, частой заболеваемости новорожденных [18, 19]. Негативное влияние ЖДА может также заключаться в нарушении взаимодействия матери, страдающей ЖДА и испытывающей слабость или депрессию, и новорожденного. Кроме того, дети, с раннего возраста страдающие ЖДА, демонстрируют сниженные умственные способности, нарушения двигательного развития и социо-эмоциональной адаптации при оценке в динамике до подросткового возраста [20].
ЖДА во время беременности, особенно в сочетании с массивной кровопотерей в родах, – основная причина послеродовой анемии, которая выявляется минимум у половины европейских женщин [21]. Снижение лактации и сокращение периода кормления неизбежны при развитии послеродовой анемии. Послеродовая депрессия также значительно чаще регистрируется среди женщин с послеродовой ЖДА [22]. Данные осложнения требуют особой настороженности и превентивной тактики со стороны акушеров-гинекологов и врачей других специальностей, на различных этапах наблюдающих подобных пациенток.
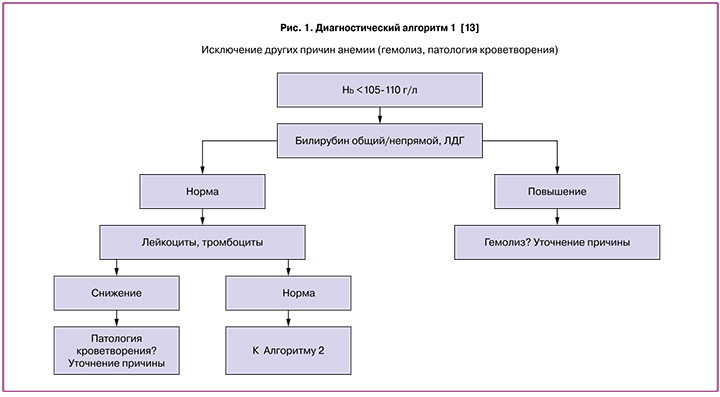
Диагностика железодефицита
Для своевременного выявления и коррекции анемии предложены и широко используются алгоритмы дифференциальной диагностики и эффективной терапии. Данные алгоритмы можно применять как во время беременности, так и вне ее.
Очевидно, что наиболее частой причиной анемии является ЖД [14], однако для исключения иных причин снижения гемоглобина, требующих специальной терапии, мы рекомендуем последовательное применение данных алгоритмов. В частности, на первом этапе, особенно в случае тяжелых форм анемии, нередко требующих трансфузионной терапии, необходимо исключение гемолитического процесса. Дальнейшее исследование показателей обмена железа также показано при гемолитических анемиях, но выбор терапевтической тактики должен быть основан на этиологии процесса.
Особенности превентивной стратегии состоят в выделении групп риска и рутинном мониторинге лабораторных данных. Лабораторные исследования обязательны для подтверждения диагноза ЖДА. Ключевым тестом для современной диагностики ЖД является сывороточный ферритин [23].
Он является наиболее надежным индикатором ЖД вне воспалительных и других хронических заболеваний. В настоящее время снижение уровня сывороточного ферритина менее 30 мкг/л у беременной женщины или на этапе планирования беременности принято считать ЖД [24, 25]. Скрининг на предмет ЖД проводится посредством периодического измерения ферритина. При наличии воспаления уровень ферритина может ложно повышаться, тогда при помощи клинического выявления воспалительного процесса или при повышении уровня С-реактивного белка (СРБ) крови можно отличить ложное повышение от достоверного. Скрининг ферритина, наряду с гемоглобином, рекомендован всем беременным женщинам в I триместре [26].
Необходимо отметить, что в целом для женщины, не планирующей беременность, уровень ферритина 15 мкг/л является достаточным при нормальных цифрах гемоглобина. Но планирование беременности требует больших запасов, чтобы минимизировать риск анемии и связанных с ней осложнений.
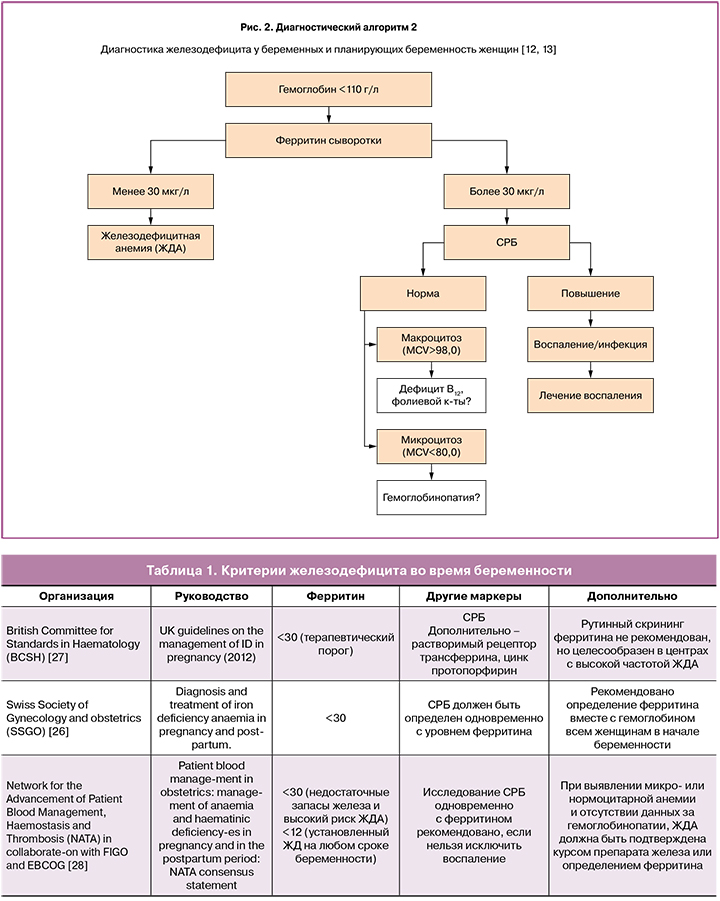
В табл. 1 приведены основные международные рекомендации, касающиеся критериев ЖД и необходимого объема обследования во время беременности.
Важно, что все авторитетные руководства фактически единодушны в своих рекомендациях по диагностике ЖД, и в настоящее время определение ферритина с целью ранней диагностики в группах повышенного риска необходимо повсеместно.
В каком же случае ЖД становится ЖДА? По определению Всемирной Организации Здравоохранения, анемией при беременности принято считать снижение гемоглобина крови менее 110 г/л. Ввиду увеличения объема плазмы во II триместре беременности Американским Центром Контроля и Профилактики Заболеваний (CDC) предложено считать анемией для данного срока снижение гемоглобина менее 105 г/л (табл. 2). Важно сопоставлять данные показатели гемоглобина с уровнем ферритина и другими данными для оптимального выбора терапии.

Тактика ведения пациентов с железодефицитом и железодефицитной анемией
Назначение препаратов железа – основа терапии ЖДА, но уточнение и коррекция причин, приведших к данной патологии, являются непременным условием для достижения эффекта.
Терапия при подтверждении ЖД зависит от степени выраженности анемии, времени ее возникновения и наличия сопутствующих изменений. Лечение ЖДА, независимо от времени возникновения, целесообразно начинать с препаратов для приема внутрь. Выбор препарата определяется максимальной эффективностью наряду с оптимальной переносимостью. Особенно важны хорошая переносимость и отсутствие побочных эффектов во время беременности, так как тошнота, запоры, вздутие живота могут ухудшать состояние беременных женщин значительно более выраженно, чем начальный ЖД. Поэтому необходимо исходный выбор останавливать на препарате с наилучшей переносимостью, каковым себя зарекомендовал железа (III) гидроксид полимальтозный комплекс [31], особенно в сравнении с солями железа (сульфат, фумарат, глюконат). Необходимо отметить, что длительность лечения препаратом железа для приема внутрь не может быть менее месяца, а вероятное развитие побочных эффектов солей железа нередко не позволяет обеспечить адекватную длительность терапии. В случае отсутствия полного восстановления гемоглобина и ферритина через месяц, терапия продолжается до стойкой нормализации показателей. Критериями эффективности лечения можно считать прирост гемоглобина, повышение количества ретикулоцитов, улучшение общего самочувствия в случае ЖДА. Превентивная стратегия, направленная на восстановление запасов железа, необходима для женщин, планирующих беременность, и на ранних сроках гестации. При выявлении снижения ферритина менее 30 мкг/л независимо от уровня гемоглобина в I триместре показано назначение препарата железа для приема внутрь (например железа (III) гидроксид полимальтозный комплекс 100 мг × 2 р/д не менее 4 недель). В подавляющем большинстве случаев отсутствие ожидаемого эффекта требует не смены одного препарата железа на другой, а поиска причин неэффективности (наличие сопутствующего воспалительного процесса, комплексное дефицитное состояние, низкая приверженность терапии и др.). При выявлении снижения гемоглобина менее 80 г/л, а также при плохой переносимости препаратов железа для приема внутрь, в сроке беременности более 13 недель необходима терапия препаратами железа парентерально. В I триместре парентеральные препараты железа противопоказаны. Также целесообразна парентеральная коррекция впервые выявленной анемии после 34 недель беременности [28].
В последнее время появилась не вполне объяснимая тенденция проводить терапию фактически любых степеней тяжести ЖДА парентеральными препаратами – быстро и удобно. Очень важно отметить, что парентеральное железо должно быть назначено только по оговоренным показаниям. В целом назначение парентеральных форм может сопровождаться рядом осложнений (декстрансодержащие препараты – риск аллергических реакций, карбоксимальтозат железа – гипофосфатемия) [32]. Поэтому попытки применения парентеральных форм у пациентов, которым должна быть назначена терапия перорально, очевидно, приведут к нарастанию частоты серьезных реакций, что недопустимо.
Эффективность терапии препаратом железа при адекватно установленной ЖДА оценивается через 4 недели после ее начала (оценка гемоглобина и ферритина) и далее 1 раз в триместр. После коррекции ЖДА восстановление запасов железа во время беременности должно проводиться не менее 3 месяцев до полной нормализации показателей гемоглобина и ферритина [12].
Таким образом, женщины репродуктивного возраста относятся к группе риска ЖДА. Учитывая вероятное негативное влияние ЖД на течение [33] и исходы беременности, планирование беременности требует обязательной оценки запасов железа, своевременной коррекции ЖД и дальнейшего мониторинга с учетом физиологических особенностей. Данная тактика позволяет свести к минимуму вероятность ЖД у беременных и родильниц, а соответственно, не допустить связанных с ним серьезных осложнений.



