Анемия – наиболее часто встречающееся состояние при беременности, способное отрицательно влиять на ее исходы. По определению Всемирной организации здравоохранения анемией при беременности принято считать снижение гемоглобина (Hb) крови менее 110 г/л [1], в послеродовом периоде – менее 100 г/л [2]. Ввиду увеличения объема плазмы во втором триместре беременности Американским центром контроля и профилактики заболеваний (CDC) предложено считать анемией для данного срока снижение Hb менее 105 г/л [3, 4]. В мире до 24,8% населения страдают различными видами анемии [5]. Основные причины развития анемии в целом связаны с недостаточным синтезом Hb либо с избыточным разрушением эритроцитов – гемолизом (алгоритм диагностики 1). Основными факторами, приводящими к недостаточной выработке Hb, являются дефицит железа, фолатов, В12, аутоиммунные и хронические воспалительные заболевания. Гемолиз эритроцитов может быть аутоиммунным (в результате воздействия антиэритроцитарных антител) или происходить вследствие неиммунных причин – наследственных дефектов эритроцитов и гемоглобина (сфероцитоз, эллиптоцитоз, талассемия, серповидно-клеточная анемия), либо механического повреждения эритроцитов, например, при протезированных клапанах сердца.
Известно, что при беременности в организме женщины происходит ряд физиологических изменений, в том числе со стороны крови. Общий объем плазмы увеличивается примерно на 30–50% исходного, а глобулярный объем возрастает только на 25% [6, 7]. Вследствие этого повышается потребность в микроэлементах и витаминах, необходимых как для синтеза Hb, так и для обеспечения нормального развития плода и плаценты. При отсутствии адекватного восполнения возрастающих потребностей развивается дефицит микроэлементов, и как следствие, третий триместр беременности может сопровождаться анемией различной степени выраженности более чем у 30% женщин [8]. Обусловлено это множеством факторов: нередко беременность наступает при исходно сниженном уровне Hb, и анемия диагностируется в связи с более тщательным лабораторным контролем беременных женщин. Но наиболее частой причиной является недостаточный запас железа в организме, нередко обусловленный особенностями диеты (вегетарианство), хроническими заболеваниями желудочно-кишечного тракта или длительными обильными менструациями, что в связи с возрастающими потребностями в железе на фоне беременности приводит к развитию анемии. Также во время беременности возможны и более редкие причины снижения гемоглобина (гемолиз, аплазия и пр.). Важно обратить внимание на тот факт, что причин анемии, связанных исключительно с беременностью, не существует. Своевременное выявление достоверной причины, лежащей в основе анемии, является залогом эффективности терапии. Наиболее распространенной причиной анемии у беременных является дефицит железа (до 95%), тем более что 40% женщин имеют нарушения обмена железа до беременности [9].
Первым шагом диагностического алгоритма является исключение иных, нередко более серьезных причин снижения гемоглобина – гемолитической анемии и панцитопении вследствие системной патологии кроветворения (рис. 1, 2).
Основные понятия и рекомендации:
- Анемия – снижение гемоглобина менее 110 г/л (1-й триместр), менее 105 г/л (2–3-й триместр), менее 100 г/л (послеродовый период).
- Cтепени тяжести анемии: гемоглобин 90–110 г/л – легкая, 70–90 г/л – средняя, ниже 70 г/л – тяжелая. При беременности тяжелой анемией считают снижение гемоглобина менее 80 г/л [9, 10].
- При наступлении беременности необходим контроль лабораторных данных не реже 1 раза в триместр.
- Режим питания во время беременности – полноценная диета, содержащая мясные продукты.
- Цель: выявление и коррекция анемии на этапе планирования и ранних сроках беременности.
- При выявлении микроцитарной/нормоцитарной анемии у беременной наиболее вероятной причиной является дефицит железа.
Железодефицитная анемия
Дефицит железа – наиболее частое отклонение от нормы, выявляемое более чем у 2 млрд людей в мире [8]. Причины его разнообразны и нередко комплексны, но основные модели железодефицита – это результат недостаточного поступления железа в организм (вегетарианская диета, анорексия, мальабсорбция на фоне патологии желудочно-кишечного тракта) и/или избыточные потери железа вследствие кровопотери или повышенного расхода (беременность, период активного роста). В среднем, обычное питание обеспечивает поступление в организм 10–15 мг железа в день, 5–10% которых всасывается в начальных отделах тонкого кишечника. Общий запас железа в организме в норме достигает 4 г. До 1 мг в день составляют физиологические потери с мочой, калом, потом. В течение беременности обеспечение развития плода повышает расход железа, вследствие чего женщине необходимо дополнительно к обычным потребностям около 1,2 г железа [11] (табл. 1).
Клинические эффекты железодефицита при беременности
Дефицит железа может повышать восприимчивость к инфекции [15], способствовать снижению работоспособности [16], оказывать отрицательное влияние на эмоциональный статус, особенно в послеродовом периоде [17]. Для матери в случае тяжелой анемии и значительной кровопотери в родах возникает необходимость заместительной трансфузионной терапии эритроцит-содержащими компонентами донорской крови, снижается качество жизни в связи с анемическим синдромом, уменьшается лактация. Клинические проявления железодефицита при беременности неспецифичны, за исключением случаев тяжелой анемии. Наиболее распространенными симптомами являются утомляемость, раздражительность, плохая концентрация внимания, выпадение волос. При наличии дефицита железа значительно возрастает риск преждевременных родов [18], синдрома задержки развития плода и снижения веса при рождении [19], неблагоприятного влияния на формирование плаценты, повышение риска отслойки плаценты и кровотечения в родах [20]. Плод относительно защищен от воздействия железодефицита в связи с повышением активности плацентарных транспортных белков [11], но данные свидетельствуют, что дефицит железа во время беременности увеличивает риск дефицита железа в первые 3 месяца жизни [21]. Нарушение психомоторного и/или умственного развития описаны у детей с анемией, также дефицит железа может негативно влиять на социальное поведение [22] и иметь связь с заболеваемостью во взрослом возрасте [17, 23].
В связи с этим своевременная диагностика и адекватная терапия железодефицитной анемии оказывает положительное воздействие на исходы беременности, как для матери, так и для плода.
Диагностика железодефицита
Основа диагностики – изолированное снижение гемоглобина в общем анализе крови. Может быть выявлено уменьшение среднего объема эритроцитов (MCV) (микроцитоз), среднего содержания гемоглобина в эритроцитах, однако, при нормальной беременности MCV несколько увеличивается, в связи с этим при нетяжелых формах железодефицита MCV у беременных остается в пределах нормы.
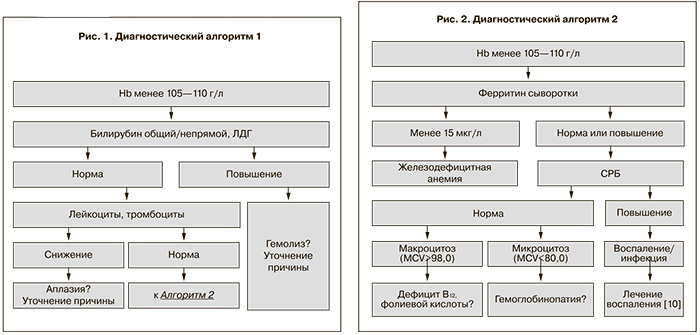
Сывороточный ферритин – это гликопротеин, который вне воспалительного процесса четко отражает запасы железа в организме (являясь неспецифическим маркером воспаления, ферритин повышается в ответ на воспалительный процесс вне зависимости от истинных показателей феррокинетики). Но это первый и основной показатель, который снижается при недостатке железа. Кроме того, значение его не меняется в случае приема препарата железа накануне исследования (в отличие от железа сыворотки), поэтому именно ферритин является основным тестом для выявления железодефицита у беременных. Начальный этап формирования дефицита железа – истощение его запасов в организме, измеряемого уровнем сывороточного ферритина. Снижение ферритина менее 15 мг/дл является четким подтверждением железодефицита [13]. При уровне ферритина ниже 30 мг/дл можно говорить об истощении необходимых запасов железа в организме и необходимости назначения препаратов железа во время беременности [24]. Необходимо помнить о ложно-нормальных (либо повышенных) значениях ферритина, которые могут регистрироваться при наличии воспалительного процесса. Для исключения воспалительных изменений исследуется уровень С-реактивного белка. Следующим этапом формирования железодефицитного эритропоэза является снижение транспорта железа, измеряемого насыщением трансферрина. Железо и общая железосвязывающая способность сыворотки являются ненадежными индикаторами обеспечения организма железом в связи с влиянием употребления железа, суточными колебаниями значений. Дополнительными параметрами дефицита железа могут служить снижение ретикулоцитов, повышение трансферрина.
Ключевые точки диагностики железодефицита:
- Железодефицит – снижение ферритина менее 15 мкг/л;
- Железо сыворотки не является надежным маркером железодефицита, поэтому его исследования не достаточно для уточнения причины анемии;
- При наличии воспалительного процесса значение ферритина может быть недостоверно нормальным/высоким. Повышение С-реактивного белка является подтверждением воспалительного процесса, требующего лечения;
- Показания для обязательного исследования ферритина вне анемии: анемия в анамнезе, многократные роды (3 и более), интервал менее 1 года после предыдущей беременности, вегетарианство, возраст до 20 лет, недавний анамнез кровотечения, высокий риск кровоточивости, гемоглобинопатии, предшествующая терапия парентеральным препаратом железа.
Послеродовая анемия. Диагностика
Клинически значимой послеродовой анемией считают снижение гемоглобина менее 100 г/л. Обычно такие значения являются следствием кровопотери в родах свыше нормы и/или присутствовавшей до родов железодефицитной анемии. Решение о контроле уровня гемоглобина после родов следует принимать с учетом потери крови и клинического состояния родильницы (выраженность анемического синдрома). Минимальное значение гемоглобина после родов достигается приблизительно через 48 ч. Дополнительное определение уровня ферритина в послеродовом периоде бесполезно, так как в течение первых 6 недель после родов значения могут быть недостоверными. Запасы железа у роженицы можно оценивать до родов или через 6 недель после родов. Не имеет смысла определять уровень ферритина в тех случаях, когда анемия присутствовала до родов, и сохраняется после них, так как можно уверенно констатировать истощение запасов железа [8].
Возможности коррекции железодефицита
Диета. Обычный пищевой рацион обеспечивает поступление в организм примерно 10,5 мг железа. Усваивается около 15%. Во время беременности потребности в железе возрастают втрое [14]. Усвоение железа из пищи зависит от его количества в рационе, функционирования желудочно-кишечного тракта, физиологических потребностей. Основным пищевым источником железа являются мясные продукты, в связи с чем вегетарианская диета представляет собой фактор высокого риска железодефицита. Во время беременности и в послеродовом периоде при выявлении дефицита железа коррекции диеты недостаточно – требуется медикаментозная терапия.
Терапия при подтверждении железодефицита зависит от степени выраженности анемии и наличия сопутствующих изменений.

— При анемии легкой степени (гемоглобин более 90 г/л) показана терапия пероральными препаратами железа (соли железа II или III – сорбифер дурулес, мальтофер), 200 мг в день предпочтительно натощак за 1 час до еды.
— При большей выраженности анемии (гемоглобин менее 80–90 г/л), а также при недостаточном эффекте от терапии пероральными препаратами (гемоглобин менее 100 г/л в течение 2 недель) либо плохой переносимости (побочные эффекты со стороны желудочно-кишечного тракта) необходима терапия препаратами железа парентерально. В настоящее время наиболее эффективным терапевтическим подходом, позволяющим в кратчайшие сроки получить максимальный эффект, является применение карбоксимальтозата железа (ферринжект). Это комплекс, не содержащий декстран, который может быть использован в максимальных дозах (до 1000 мг на одно внутривенное введение) в короткий промежуток времени (на одну инфузию требуется 15–30 мин) и способен быстро восполнять дефицит железа в организме. Применение данного препарата возможно со второго триместра беременности. Повторные инфузии проводятся еженедельно из расчета 15 мг железа на кг массы тела. По данным Cochrane Database [25], именно карбоксимальтозат железа является препаратом выбора терапии железодефицитной анемии при беременности. Как и в случае сахарата железа (III), данный препарат одобрен для применения в период беременности, начиная со второго триместра. В модели плацентарного кровотока показано, что карбоксимальтозат железа не проникает через плацентарный барьер к плоду. При парентеральном введении железа повышение уровня гемоглобина происходит быстрее, чем при приеме внутрь. Внутривенное введение карбоксимальтозата железа повторяют 1 раз в неделю до повышения уровня гемоглобина >100 г/л. Затем пациента можно перевести на прием пероральных препаратов железа для поддерживающей терапии. Нет оснований ожидать возможной передозировки железом. В ряде рандомизированных многоцентровых исследований было проведено сравнение карбоксимальтозата железа (феринжект) и заместительной терапии с приемом железа внутрь при лечении анемии. Исследования показали очень высокую безопасность применения, а также высокую эффективность карбоксимальтозата железа. Практическая польза, удобство для пациентов и снижение затрат, обусловленное необходимостью однократного введения, указывают на преимущество карбоксимальтозата железа перед ранее применяемым сахаратом железа (III) [26, 27] .
Лечение тяжелой анемии
При тяжелой анемии у беременных (гемоглобин <80 г/л) оправдано введение рекомбинантного эритропоэтина (рЭПО) в дополнение к парентеральному назначению карбоксимальтозы железа. Введение рЭПО улучшает результаты лечения анемии, но только в сочетании с парентеральным введением железа. рЭПО следует назначать только в случаях тяжелой анемии при наличии дополнительных факторов (выраженные клинические симптомы, отказ от переливания донорской крови и др.). Примерная дозировка: 150 МЕ/кг веса тела один раз в сутки подкожно, суммарно четыре дозы эпоэтина альфа (эпрекс) на фоне парентерального лечения с применением карбоксимальтозы железа [10].
Критическое значение гемоглобина, при котором оправдано переливание компонентов донорской крови, составляет 60 г/л, однако, необходимость трансфузии зависит в первую очередь от степени выраженности клинических симптомов анемии. Выраженная слабость, головокружение, обмороки, тахикардия в покое являются симптомокомплексом показаний для трансфузии.
Ключевые рекомендации по терапии железодефицитной анемии:
Факторы, повышающие вероятность железодефицита во время беременности: диета, ограничивающая мясные продукты, многоплодная беременность, интервал менее 1 года между последующими беременностями, железодефицитная анемия в анамнезе, возраст до 20 лет, склонность к кровотечениям (болезнь Виллебранда и другие наследственные коагулопатии).
Снижение ферритина менее 30 мкг/л без анемии – назначение препарата железа перорально (100 мг/сут) не менее 3 недель.
Анемия с подтверждением железодефицита (снижение ферритина) – назначение препарата железа перорально в дозе 200 мг элементарного железа ежедневно до нормализации Hb.
Женщинам с Hb менее 110 г/л до 10–12 недель беременности и менее 105 г/л после 12 недель (микроцитарная/нормоцитарная анемия) требуется назначение препарата железа перорально в дозе 100–200 мг элементарного железа ежедневно даже при неуточненном уровне ферритина. При отсутствии эффекта через 2 недели – дообследование.
Даже в случае ранее установленного диагноза гемоглобинопатии при снижении ферритина менее 30 мкг/л требуется назначение препарата железа.
После нормализации гемоглобина терапия препаратами железа у беременных/родильниц должна продолжаться не менее 3 месяцев.
В послеродовом периоде при снижении гемоглобина менее 100 г/л и кровопотере в родах более 500 мл – назначение препарата железа в дозе 100-200 мг/сутки в течение 3 месяцев, отмена – только после восстановления ферритина и гемоглобина до нормальных значений.
Применение парентерального препарата железа возможно со 2-го триместра беременности и в послеродовом периоде в случае отсутствия эффекта от пероральной терапии препаратами железа, их плохой переносимости или Hb менее 80 г/л.

Переливание эритроцит-содержащих сред возможно в качестве дополнительного терапевтического подхода в случае массивной кровопотери в родах/послеродовом периоде, снижении Hb менее 60 г/л и/или при наличии выраженных проявлений анемического синдрома.
Противопоказания для терапии парентеральными препаратами железа: анафилактическая реакция на парентеральный препарат железа в анамнезе, 1-й триместр беременности, активная острая или хроническая инфекция, хроническое заболевание печени.
Для парентерального введения препаратов железа предпочтительнее применение железа карбоксимальтозата в связи с лучшим профилем безопасности во время беременности, еженедельным введением в виде короткой внутривенной инфузии.
Доза парентерального препарата железа рассчитывается на массу тела до беременности.
При снижении гемоглобина менее 80 г/л и/или возникновении признаков нестабильности гемодинамики, непосредственно связанных с кровотечением в родах/послеродовом периоде, оправдано применение эритроцит содержащих донорских компонентов крови, свежезамороженной плазмы. В случае массивного акушерского кровотечения при оперативном родоразрешении необходимо использовать процедуру интраоперационной реинфузии аутоэритроцитов (табл. 2).
Заключение
Таким образом, с целью профилактики осложнений беременности, связанных с анемией необходимо проведение ранней диагностики железодефицитной анемии. Мониторирование показателей гемоглобина и ферритина позволяет своевременно определить максимально эффективную лечебную тактику до родов и в послеродовом периоде с привлечением кровесберегающих технологий. Данная тактика позволяет минимизировать количество осложнений беременности, связанных с анемией, и улучшить исходы беременности в целом.



