Работа выполнена при финансовой поддержке Государственного контракта №16.512.11.2030 от 14.02.2011 с Министерством образования и науки РФ.
В связи с широким распространением вспомогательных репродуктивных технологий особую актуальность приобретает вопрос повышения их эффективности, которая у женщин репродуктивного возраста не превышает 30–40% [1]. Наиболее частыми причинами неэффективности попыток экстракорпорального оплодотворения (ЭКО) являются плохое качество эмбрионов, патология эндометрия (хронический эндометрит, гиперплазия или полип эндометрия), наличие гидросальпинкса, нарушение свертываемости крови, а также изменения кариотипа супругов [5]. К спорным причинам относят совпадение супругов по антигенам второго класса гистосовместимости [1]. В то же время существует определенный процент циклов ЭКО, при которых причина ненаступления беременности остается неясной. В подобных ситуациях в качестве возможной причины рассматривается нарушение имплантации эмбриона в толщу эндометрия [3, 5].
Процесс имплантации сложен и зависит от множества факторов и соблюдения ряда условий: физиологически полноценных анатомических факторов, адекватного гормонального фона, а также высокой степени синхронности молекулярно-иммунологических процессов в эндометрии и эмбрионе [5]. Для успешной нидации эмбриона и дальнейшего развития беременности в преимплантационном эндометрии необходимо наличие особого микроокружения, в создании которого участвуют различные клетки, гормоны и цитокины [3]. Цитокины, опосредуя молекулярные механизмы взаимодействия между децидуальной оболочкой и растущим эмбрионом, участвуют в процессах имплантации, роста и развития эмбриона и плода, а также в подготовке эндометрия к инвазии бластоцисты [1]. По мнению ряда исследователей [2, 11, 13], выявление неадекватной секреции цитокинов в эндометрии является признаком неадекватной рецептивности матки и позволяет предсказать потенциальное нарушение имплантации независимо от качества эмбриона.
Согласно современным представлениям, успешность пролонгирования беременности зависит от
баланса провоспалительных цитокинов типа Th1 (интерлейкин-1, интерлейкин-6, фактор некроза опухоли) и противоспалительных типа Th2 (интерлейкин-10). Оплодотворенная яйцеклетка
защищает себя, формируя пара- и аутокринное окружение доминирующих цитокинов Th2-типа,
которые блокируют провоспалительную активность Th1 клеток [6].
В частности, интерлейкин-1 (IL-1) является важным медиатором локальных и системных воспалительных реакций. Во время беременности IL-1 продуцируется преимущественно в децидуальной оболочке макрофагами, клетками железистого эпителия и стромальными клетками эндометрия. Выделяют 2 фракции IL-1: IL-1α и IL-1β. Первая является основной секретируемой формой IL-1, осуществляющей свое действие как на местном, так и на системном уровнях [14]. К провоспалительным цитокинам относится IL-6. Он секретируется трофобластом, его экспрессия резко возрастает в секреторную фазу в период «окна имплантации».
IL-10, являясь противовоспалительным цитокином, экспрессируется в эндометрии и плаценте и служит важнейшим регулятором иммунного ответа. Основной эффект IL-10 заключается в подавлении синтеза цитокинов Th1 клетками и снижении активности макрофагов.
Фактор некроза опухоли (TNF-α) является многофункциональным цитокином с провоспалительными свойствами. Данный цитокин синтезируется активированными макрофагами децидуальных и трофобластных клеток и принимает активное участие в процессе репродукции, играет регуляторную роль в процессах инвазии клеток трофобласта и мезенхимальном ангиогенезе [2, 8].
Таким образом, детальное изучение молекулярных процессов, происходящих в эндометрии в период имплантации, является одним из перспективных направлений для понимания возможных причин ненаступления беременности и возможности их коррекции.
Целью настоящего исследования явилось определение значимости аллельных вариантов генов цитокинов в нарушении процессов имплантации у пациенток с многократными неудачными
попытками ЭКО по поводу бесплодия неясного генеза или трубно-перитонеального бесплодия.
Материал и методы исследования
В исследование были включены 65 пациенток (средний возраст 32±4,5 года) – основная группа, которым было произведено от 2 до 5 неудачных попыток ЭКО, из них 35 пациенткам – по поводу
первичного бесплодия неясного генеза и 30 – по поводу трубно-перитонеального бесплодия. При этом были перенесены эмбрионы удовлетворительного качества, но попытки ЭКО были неэффективны. Все пациентки основной группы проходили обследование по поводу бесплодия. Обследование включало в себя исследование гормонального профиля (ЛГ, ФСГ, эстрадиол, пролактин, тестостерон, 17-ОН прогестерон, ДГЭА-С, ТТГ, антимюллеровский гормон, ингибин Б), выявление урогенитальных инфекций, ультразвуковое исследование органов малого таза, анализ спермограммы супругов, диагностику проходимости маточных труб (гистеросальпингографию, фертилоскопию или лапароскопию). В группу контроля вошли 70 женщин (средний возраст 33±5,2 года) с реализованной репродуктивной функцией. Средний возраст менархе и характер менструального цикла у исследуемых пациенток были сопоставимы и соответствовали физиологическим параметрам. У пациенток с трубно-перитонеальным бесплодием в анамнезе чаще встречались воспалительные заболевания придатков матки, а также внематочные беременности.
Критериями включения в исследование для основной группы были: возраст до 38 лет, нормальный овариальный резерв (умеренный или выраженный фолликулярный аппарат, по данным УЗИ, нормальные показатели уровней ФСГ, антимюллеровского гормона, ингибина Б), нормальное состояние эндометрия, по данным УЗИ (на 2–5-й день менструального цикла М-эхо линейное, во вторую фазу менструального цикла – 9–15 мм, трехслойное), а также удовлетворительное качество эмбрионов.
Качество эмбрионов оценивали эмбриологи. Оценку эмбрионов проводили на 3-и сут по
числу клеток и по качеству. При оценке качества использовали буквенное обозначение от А до D,
где A обозначает наиболее качественный, D – наименее качественный эмбрион. При оценке
качества эмбриона учитывали следующие параметры:
1) регулярность размеров и форму бластомеров;
2) наличие и степень фрагментации;
3) наличие многоядерных бластомеров;
4) наличие и степень вакуолизации бластоме-
ров.
Таким образом, на 3-и сут качество эмбрионов считалось удовлетворительным при условии, что
он состоял из 6–10 бластомеров группы А или В. Для оценки эмбрионов на 5-е сут использовали
общепринятую классификацию бластоцист по Д. Гарднеру [7]. Таким образом, на 5-е сут эмбрион представлял собой бластоцисту группы А или В (от В1 до В5).
Для пациенток с бесплодием неясного генеза критерием включения также было отсутствие патологии при исследовании супружеской пары, а для пациенток с трубно-перитонеальным бесплодием – отсутствие маточных труб или доказанная их непроходимость, по данным гистеросальпингографии, фертилоскопии или лапароскопии. Критериями исключения для основной группы были: снижение овариального резерва, клинически значимый эндометриоз, хронический эндометрит, патология эндометрия, пороки развития матки, мужской фактор бесплодия в паре, а также неудовлетворительное качество эмбрионов при ЭКО. Критериями включения в контрольную группу были: возраст до 38 лет, отсутствие бесплодия в анамнезе, физиологическое протекание одной и более беременностей, завершившихся рождением здорового ребенка (take home baby).
Исследовали полиморфизм генов цитокинов: IL-1β -511С/Т, IL-6 -174G/C, IL-10 -1082G/A, TNF-α -238G/A. Для генетического исследования выполнялась экстракция геномной ДНК на сорбенте из лимфоцитов периферической цельной крови при помощи коммерческого набора «ДНК-сорб-В» («АмплиСенс», Москва).
Определение аллельных вариантов генов проводили методом ПЦР-ПДРФ при помощи амплификатора «Mastercycler gradient» («Eppendorf», Германия) с последующей рестрикцией полученных ампликонов эндонуклеазой, согласно рекомендациям фирмы-изготовителя («Fermentas», США). Для электрофореза и визуализации результатов продукты амплификации и рестрикции разделяли в 2% агарозном геле, окрашенном водным раствором бромистого этидия (0,1 мкг/мл). Результаты анализа фиксировали с помощью системы видео-гель-документации «Versa Doc RG 3000» («Bio-Rad», США).
При статистической обработке полученных данных на первом этапе было проведено сравнение результатов в основной и контрольной группах, далее результаты в каждой из двух подгрупп
основной группы сравнивали с группой контроля, а затем друг с другом.
Достоверность значений определялась в программе Statistiса при подсчете значения р по точному двустороннему тесту Фишера. Все лица, включенные в исследование, дали письменное информированное согласие на участие в нем. Результаты исследования и обсуждение
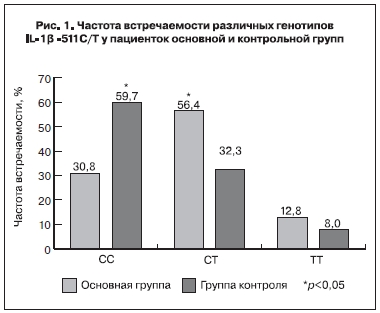
При изучении полиморфизма гена IL-1β-511С/Т было выявлено статистически достоверное (р<0,05) снижение частоты встречаемости генотипа СС (30,8%), а также увеличение встречаемости гетерозиготного генотипа СТ (56,4%) в основной группе по сравнению с группой контроля (соответственно 59,7 и 32,3%). Установлена тенденция к увеличению частоты встречаемости
генотипа ТТ (12,8%) в основной группе по сравнению с группой контроля (8%) (рис. 1). При сравнении частот встречаемости аллелей С и Т получено статистически достоверное (р<0,05) повышение встречаемости аллели Т в основной группе (41,0%) по сравнению с группой контроля (24,2%). Аналогичные данные были получены при сравнении каждой из подгрупп с группой контроля.
Известно, что связывание IL-1β с рецепторами в материнском организме необходимо для имплантации, так как участвует в следующих важных процессах: ремоделировании ткани эндометрия, изменении продукции цитокинов, ростовых факторов и молекул адгезии в клетках эндометрия, а также контроле пролиферации, дифференцировки и апоптотической гибели клеток [4]. Полиморфизм гена IL-1β -511С/Т сопряжен с повышенным уровнем IL-1β в случае -511Т аллели и соответственно бóльшей активностью воспалительных процессов у носителей этой аллели [9].
При сравнении частот встречаемости генотипов генов IL-6 -174G/C и IL-10 -1082 G/A, а также их аллелей не было получено статистически достоверных различий между основной и контрольной группами. Аналогичные результаты были получены при сравнении группы с бесплодием неясного генеза с группой контроля, а также группы с трубно-перитонеальным бесплодием с группой контроля.
IL-6, является провоспалительным цитокином, стимулирующим ангиогенез и активирующим коагуляционные реакции. В то же время он оказывает и противовоспалительное действие за счет ингибирования продукции IL-1 и TNF-α [2]. Полиморфизм -174G/C ассоциирован с изменением уровня IL-6 в плазме. Аллель С ассоциирован с понижением уровня IL-6 в плазме, в то время как носительство G аллеля связано с повышенным уровнем данного цитокина [10]. IL-10 оказывает протективное действие на нормальное течение беременности. Отмечено снижение уровня этого цитокина у женщин с невынашиванием беременности [6]. Полиморфизм гена IL-10 в положении -1082 с заменой G на А приводит к снижению уровня продукции этого цитокина [13]. Выявленное в настоящем исследовании отсутствие достоверных различий между основной и контрольной группами может свидетельствовать об отсутствии прямой связи между изменением уровня продукции данных цитокинов и наступлением беременности. Возможно, что цитокины IL-6 и IL-10 принимают основное участие в пролонгировании беременности, а не в ее наступлении.
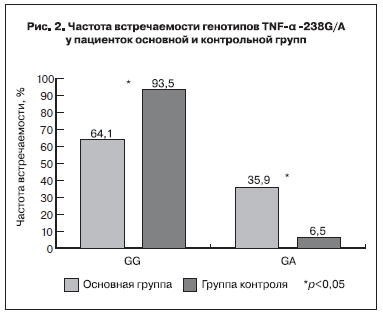
ПрианализеполиморфизмагенаTNF-α-238G/A было выявлено статистически достоверное (р<0,05) снижение частоты встречаемости генотипа GG (64,1%), а также повышение частоты встречаемости гетерозиготного генотипа GA (35,9%) в основной группе по сравнению с группой контроля (соответственно 93,5 и 6,5%) (рис. 2). Аллельный вариант AA данного гена не был найден ни у одной из исследуемых пациенток. Сравнение частот встречаемости аллеля G и вариантного аллеля А также выявило статистически достоверное (р<0,05) повышение встречаемости вариантного аллеля А в основной группе (7,9%) по сравнению с группой контроля (3,2%). При сравнении подгрупп основной группы с контролем были получены аналогичные результаты.
Полиморфизм гена TNF-α -238G/A является наиболее изученным. Известно, что генотип GA ассоциирован с повышенной продукцией этого цитокина [12]. Гиперсекреция TNF-α приводит к существенному увеличению числа апоптотических клеток трофобласта, активации системы свертывания крови с развитием локальных микротромбозов в области плацентации [4].
Изучение различий между подгруппами основной группы показало, что в случае IL-1b была выявлена тенденция к более частой встречаемости гетерозиготного CT (65,2%), а также генотипа TT (12,0%) в подгруппе с трубно-перитонеальным фактором бесплодия по сравнению с группой бесплодия неясного генеза (соответственно 43,8 и 4,3%).
Сравнение встречаемости генотипов IL-6 между подгруппами основной группы выявило тенденцию к более высокой частоте встречаемости генотипа GG (31,25%), а также к более низкой частоте гетерозиготного генотипа GC (56,25%) и генотипа CC (12,5%) в группе с трубно-перитонеальным фактором бесплодия по сравнению с бесплодием неясного генеза (17,4, 60,9 и 21,7% соответственно).
При аналогичном анализе генотипов TNF-α были получены результаты, схожие с IL-1b. Так, в группе с трубно-перитонеальным фактором бесплодия частота встречаемости генотипа GG составила 56,25%, гетерозиготного GА – 43,75%, а в группе с бесплодием неясного генеза – 73,9 и 26,1% соответственно.
Выявленные тенденции при сравнении подгрупп с трубно-перитонеальным фактором бесплодия и бесплодием неясного генеза, вероятно, можно объяснить склонностью пациенток с трубно-перитонеальным фактором бесплодия к воспалительным заболеваниям. Именно воспалительные заболевания придатков матки приводят к возникновению непроходимости маточных труб, а также внематочным беременностям. Однако полученные результаты являются предварительными и требуют увеличения числа пациенток в данных группах.
Необходимо также отметить, что из всех пациенток основной группы сочетание аллельных полиморфизмов по двум генам наблюдалось у 26 (40%) женщин, по трем генам – у 27 (41,5%), по всем четырем – у 5 (7,7%), наличие вариантного аллеля только в одном гене было выявлено у 7 (10,8%) женщин, без вариантных аллелей в исследуемых полиморфизмах не было выявлено ни одного случая. При этом в группе контроля у 8 (11,4%) пациенток отсутствовали вариантные аллели во всех исследуемых генетических полиморфизмах, наличие вариантного аллеля в полиморфизме только одного гена обнаружено у 30 (42,9%) пациенток, сочетание полиморфизмов двух генов наблюдалось у 24 (34,3%) пациенток, трех генов – у 8 (11,4%), а сочетание вариантных аллелей в четырех полиморфизмах не было выявлено ни у одной пациентки (см. таблицу).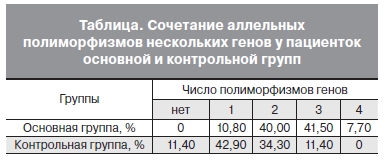
При изучении анамнеза установлено, что из 65 пациенток основной группы у 9 (13,8%) было больше всего неудачных попыток ЭКО (4–5). При этом у 3 из них было сочетание четырех вариантных аллелей в исследуемых полиморфизмах, у 4 – сочетание трех аллельных полиморфизмов и у 2 – сочетание двух аллельных полиморфизмов.
Таким образом, у пациенток с многократными неэффективными попытками ЭКО выявлен дисбаланс провоспалительных и противовоспалительных цитокинов, который выражается в увеличении частот встречаемости аллельных вариантов генов IL-1b и TNF-α. Выявленные генетические особенности у исследуемых пациенток могут указывать на значение данных полиморфизмов генов IL-1b -511С/Т и TNF-α -238G/A в успешности имплантации. При обследовании пациенток с многократными неудачными попытками ЭКО целесообразно проводить молекулярно-генетические исследования для выявления предрасположенности пациентки к нарушению имплантации и, возможно, необходимости проведения предгравидарной подготовки.



