На сегодняшний день вопрос актуализации недостаточности витамина D (25(OH)D) как среди здоровых людей, так и среди пациентов с различной соматической патологией возрастает. В настоящее время недостаточность, а в большей степени дефицит 25(OH)D представляют собой пандемию, затрагивающую преобладающую часть общей популяции, все возрастные группы. Так, распространенность уровней менее 30 нг/мл у женщин репродуктивного возраста в Российской Федерации составляет 74–83,2% [1–3]. В этой группе женщин одним из наиболее частых эндокринно-метаболических заболеваний остается синдром поликистозных яичников (СПКЯ), который в общей популяции встречается у 6–10% женщин, а согласно Роттердамским критериям ESHRE/ASRM от 2003 г. – у 15% женщин [4]. Одним из недооцененных факторов овариальных и метаболических нарушений при СПКЯ является дефицит 25(OH)D, который может вызывать и усугублять уже имеющуюся инсулинорезистентность (ИР), а также снижать фертильность [5].
Данные российских и международных исследований ассоциации 25(OH)D недостаточности у пациенток с СПКЯ разнообразны и иногда противоречивы, и пока не имеют общего представления. Часть авторов придерживаются мнения, что недостаток 25(OH)D приводит к ИР и метаболическому синдрому (МС), однако не всегда достоверно различается в группе пациенток с СПКЯ и без него [6, 7].
С другой стороны, в исследованиях J. Figurová, И.В. Кузнецовой выявлен значительный дефицит 25(OH)D у пациенток с СПКЯ по сравнению с группой контроля [8, 9]. По-видимому, имеются различия в наблюдаемых группах и не учитываются дополнительные факторы. Такими факторами могут выступать окружность талии (ОТ), соотношение ЛГ/ФСГ, глобулин, связывающий половые гормоны (ГСПГ), андрогены и другие метаболиты [10, 11]. Таким образом, изучение вопроса о связи 25(OH)D и СПКЯ, а также факторах, влияющих на клиническую картину, требует системного подхода.
Не менее важным является вопрос о необходимости коррекции недостатка 25(OH)D у пациенток с СПКЯ в комплексном лечении. Исследование R. Firouzabadi показало положительные эффекты добавок кальция и 25(OH)D на потерю веса, созревание фолликулов, регулярность менструального цикла и уменьшение гиперандрогении у бесплодных женщин с СПКЯ [12]. Кроме того, выявлено положительное влияние на ожирение и профиль сердечно-сосудистой системы сезонных изменений 25(OH)D у пациенток с СПКЯ [13].
СПКЯ является мультифакториальным заболеванием и характеризуется разнообразием клинических проявлений, которые обуславливают определенные психологические особенности поведения. Так, пациентки характеризуются экстернальным поведением, а также повышенным уровнем агрессии, тревожности и депрессии [14]. Возможно, такие изменения связаны именно с недостатком 25(OH)D, который имел значимую связь с депрессией у пациенток с СПКЯ [15].
В связи с чем является актуальным изучение недостаточности 25(OH)D у пациенток с СПКЯ и связи с метаболическими и психологическими параметрами, а также коррекция данного нарушения.
Материал и методы исследования
В исследование были включены 44 женщины с различными клинико-лабораторными проявлениями СПКЯ и распределены на две группы: 1-я – пациентки с СПКЯ, получающие терапию препаратами комбинированных оральных контрацептивов (КОК), бигуанидами и колекальциферолом; 2-я – пациентки с СПКЯ, получающие терапию препаратами КОК, бигуанидами. Группу контроля составили 22 здоровых женщины без нарушения функции яичников. Пациентки были обследованы дважды – до лечения и после терапии через 3 месяца.
В соответствии с резолюцией Европейского общества репродукции и эмбриологии человека и Американского общества репродуктивной медицины (The Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group) (2012) диагноз СПКЯ верифицировали при наличии 2 из 3 утвержденных критериев: 1) гиперандрогения, проявляющаяся повышенными сывороточными уровнями общего (норма 0,26–1,3 нг/мл) или свободного тестостерона и/или клиническими признаками андрогенизации; 2) олигоменорея/аменорея или отсутствие овуляции; 3) поликистозные яичники по результатам ультразвукового исследования (УЗИ) [4]. При этом критерием включения был впервые поставленный диагноз и отсутствие специфического лечения. Бесплодие выставляли на основании отсутствия беременности в течение 1 года при неиспользовании методов контрацепции.
Дизайн исследования включал оценку антропометрических параметров (масса тела, окружность талии — ОТ, окружность бедер — ОБ, ОТ/ОБ). Ожирение рассчитывали по индексу массы тела (ИМТ).
Уровень 25(OH)D исследовали методом иммуно-ферментного анализа (ИФА) на анализаторе «Abbott/Architect-8000», оценивался по «Клиническим рекомендациям» Российской ассоциации эндокринологов (нг/мл): выраженный дефицит витамина D<10 25="" d="" 20="" 50="" d="" 20="" 30="" 50="" 75="" d="" 30="" 75="" d="">150 нг/мл (>375 нмоль/л) [16].
Для выявления нарушений углеводного обмена определяли глюкозу натощак глюкозооксидазным методом на биохимическом анализаторе «Hitachi 912» (Hoffmann-La Roche Ltd/Roche Diagnostics GmbH, Германия), инсулин натощак оценивали по принципу ферментной амплификации одностадийного «сэндвичного» ИФА с использованием набора «DSL-10-23100 ACTIVE Human Leptin ELISA», высчитывали индекс инсулинорезистентности HOMA =[Концентрация глюкозы в крови (нмоль/л)] × [Концентрация инсулина в крови (мкЕД/л)]/ 22,5.
Анализ депрессивного состояния оценивали с помощью шкалы депрессии Бека с раздельной регистрацией выраженности 21-й категории симптомов и жалоб, наиболее значимых для клинической характеристики депрессии. Преимущество этого опросника заключаются в возможности прицельной оценки степени тяжести как депрессивного синдрома в целом, так и отдельных симптомов, его составляющих [17].
Статистическая обработка полученных данных проводилась с использованием прикладного программного пакета R-system. Выполнялся описательный и сравнительный анализ. Описательный анализ включал определение среднего арифметического значения (X), ошибки среднего значения (m). Сравнительный анализ основывался на определении достоверной разницы показателей по t-критерию Стьюдента для нормально распределенных двух независимых выборок и ANOVA нескольких выборок, для качественных данных χ2 Пирсона. Критический уровень значимости (р) при проверке статистических гипотез в исследовании принимался 0,05. Для оценки корреляционной зависимости показателей использовался поиск коэффициента Спирмена [18].
Результаты
В результате сравнительного анализа ANOVA выявлено, что пациенты с СПКЯ и пациенты контрольной группы имели достоверные различия по массе, ИМТ, ОТ, ОБ, ОТ/ОБ, 25(OH)D, тестостерону, глюкозе, инсулину, индексу HOMA, а также по уровню депрессии. Таким образом, исходные параметры сопоставимы между группами пациенток с СПКЯ, однако показатели ОТ, ОБ, ОТ/ОБ и тестостерона были не значимо выше у пациенток с СПКЯ в группе 2 (табл. 1). Отмечен повышенный ИМТ в группах пациенток с СПКЯ, избыток массы в 1-й группе и ожирение I степени во второй. Кроме того, антропометрические показатели также были выше в группах с СПКЯ. При оценке уровня 25(OH)D отмечено дефицитное состояние в 1-й и 2-й группе по сравнению с группой контроля. Уровень тестостерона превышал нормативные показатели у пациенток с СПКЯ в обеих группах. Также были выявлены нарушения углеводного обмена в виде гиперинсулинемии и инсулинорезистентности в 1-й и 2-й группах. Дополнительно при исследовании у пациенток с СПКЯ регистрировалась депрессия, которая имела выраженный характер.
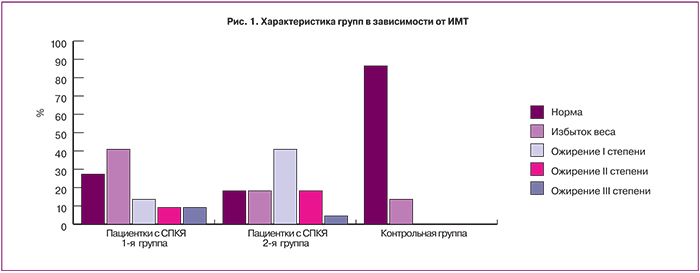
При оценке степени ожирения было выявлено, что пациентки 1-й и 2-й группы имели чаще ожирение I, II и III степени (λ2=11,3, p=0,001, λ2=4,4, p=0,036). Тогда как, в контрольной группе женщины имели нормальную или избыточную массу тела (λ2=15,6, p=0,001, λ2=4,1, p=0,042) (рис. 1).
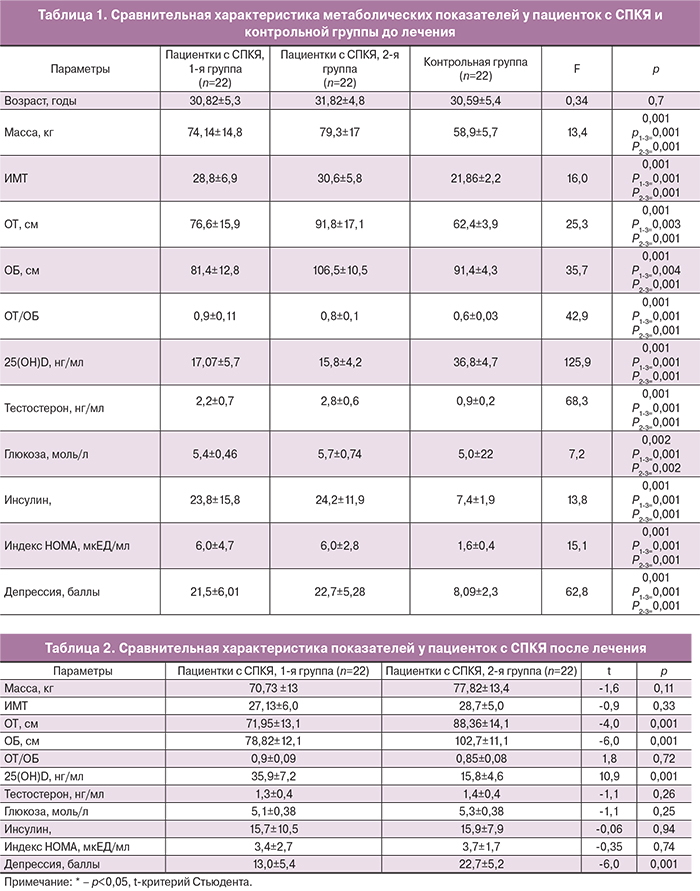
С помощью шкалы Бека было выявлено, что депрессия имела место у всех пациенток с СПКЯ, при том в большей мере – тяжелой степени (λ2=8,3, p=0,004, λ2=11,3, p=0,001, λ2=6,9, p=0,008, λ2=12,9, p=0,001). В контрольной группе преимущественно отсутствовали депрессивные симптомы (λ2=25,1, p=0,001) (рис. 2).
В течение 3 месяцев пациентки с СПКЯ получали лечение препаратами КОК с антиандрогенным эффектом, содержащие дроспиренон и кальция левомефолинат с учетом будущего планирования беременности. При этом 47,7% (n=21) получали препарат ярина плюс, 52,3% (n=23) – джес плюс, вне зависимости от группы. Вторым обязательным препаратом в обеих группах были бигуаниды, 61,3% (n=27) принимали глюкофаж, 38,6% (n=17) – сиофор. Средняя доза составляла 1500 мг в сутки и зависела от уровня глюкозы, инсулина, индекса HOMA, а также клинических проявлений. Препарат колекальциферола применяли только в 1-й группе, дозу подбирали с учетом уровня 25(OH)D по клиническим рекомендациям: при уровне 25(OH)D<20 150="" 000="" 3="" 20="" 29="" 150="" 000="" 16="" p="">
При анализе было отмечено достоверное различие в группах по уровням ОТ, ОБ, 25(OH)D, депрессии. Так, пациентки из группы, которые получали дополнительно препарат колекальциферола, достигли лучших результатов лечения по перечисленным параметрам (табл. 2).
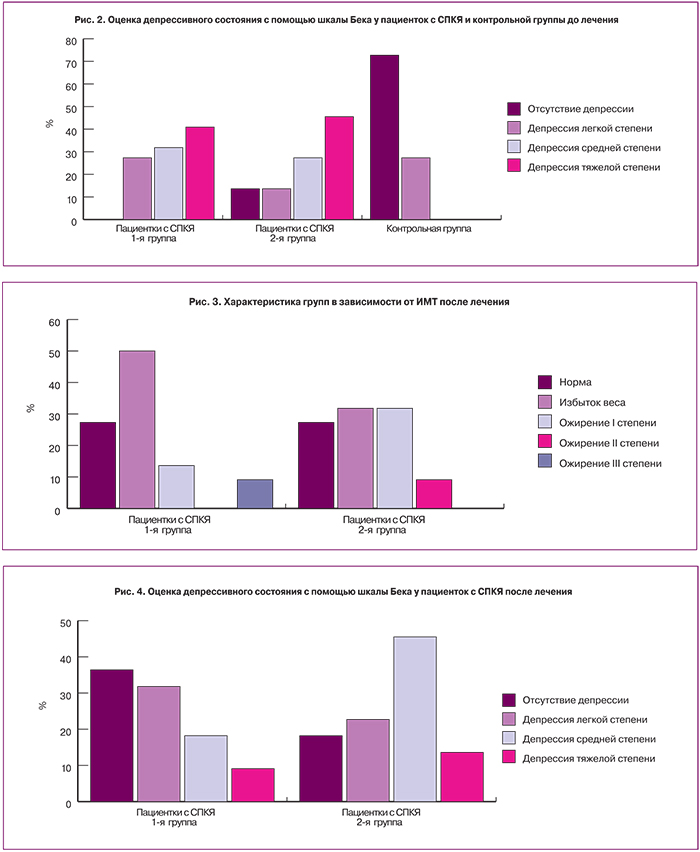
При оценке степени ожирения было выявлено, что в 1-й группе преобладал нормальный и избыточный вес, при этом у пациенток 2-й группы – ожирение I и II степени (λ2=4,1, p=0,042) (рис. 3).
При оценке уровня депрессии, в 1-й группе преобладала депрессия легкой степени или отсутствовали симптомы. Тогда как во 2-й группе у всех пациенток были проявления депрессии и при этом значимо больше тяжелой степени (λ2=8,3, p=0,004, λ2=7,3, p=0,007) (рис. 4).
После проведенного лечения в обеих группах было отмечено значимое снижение уровня тестостерона (t=5,01, p=0,001; t=7,0, p=0,004), инсулина (t=2,3, p=0,024; t=2,7, p=0,01), индекса HOMA (t=2,1, p=0,04; t=3,3, p=0,002), в 1-й группе – повышение уровня 25(OH)D (t=9,15, p=0,001).
Кроме того, 13 пациенток основной группы (9 – из группы 1 и 4 – из группы 2) через 3 месяца после лечения приняли решение о планировании беременности. В результате после отмены лечения в первом самостоятельном цикле беременность наступила у 7 пациенток из 1-й группы и у 2 пациенток из 2-й группы. В настоящий момент все наступившие беременности пролонгируются. Пациентки, у которых беременность не наступила в первом самостоятельном цикле, продолжают лечение и наблюдение.
Несомненно, дефицит 25(OH)D вносит большой вклад в физиологию углеводного и жирового обменов, однако в различных исследованиях ведутся споры о взаимосвязях. В связи с актуальностью проблемы был проведен корреляционный анализ связи 25(OH)D, метаболических и психологических параметров. В результате дефицит 25(OH)D был связан с антропометрическими данными – повышенной массой тела, ИМТ, ОТ и ОТ/ОБ (r=-0,61, p=0,001; r=-0,63, p=0,001; r=-0,64, p=0,001; r=-0,73, p=0,001). Среди метаболических показателей связь была выявлена с гиперандрогенией (r=-0,72, p=0,001), гиперинсулинемией (r=-0,49, p=0,001), инсулинорезистентностью (r=-0,47, p=0,001), гипергликемией (r=-0,38, p=0,001). Дополнительным проявлением недостатка 25(OH)D была депрессия (r=-0,94, p=0,001).
Обсуждение
В результате исследования показано, что пациентки с СПКЯ имеют пониженный или недостаточный уровень 25(OH)D, который связан с нарушением антропометрических, метаболических и психологических показателей. Эти данные сопоставимы с международным обзором L. Buggio, где показана связь метаболизма 25(OH)D и СПКЯ [19]. Однако на сегодняшний день все еще трудно сделать однозначный вывод о причинно-следственных связях, ввиду противоречивости выводов из-за недавнего мета-анализа [20].
В проведенном исследовании показано, что пациентки с СПКЯ имеют пониженный или недостаточный уровень 25(OH)D, который связан с нарушением антропометрических, метаболических и психологических показателей. При этом, дополнительный прием препарата колекальциферола приводил к более значимым улучшениям параметров ОТ, ОТ/ОБ, а также уменьшал проявления депрессии. Эти данные перекликаются с мета-анализом, проведенным X.Z. Jia, но автор отмечает, что необходимо дальнейшее изучение всей полноты терапевтического эффекта 25(OH)D на СПКЯ [21].
В нашем исследовании мы не изучали возможный патогенез связи 25(OH)D и СПКЯ, однако эта тема представляет большой интерес. Так, в литературе есть данные, что основная роль отводится трансформирующему ростовому фактору-β1, который уменьшается при использовании добавок 25(OH)D, тем самым улучшается течение заболевания [22]. Кроме того, ученые из Индии проводили анализ генотипов рецептора 25(OH)D и определили, что Fok1 связан с уровнем тестостерона, а Cdx2 с бесплодием у пациентов с СПКЯ [23].
Также в исследовании отмечено более частое наступление беременности в 1-й группе пациенток, которые принимали препарат 25(OH)D. Возможный механизм связан с изменением уровня антимюллерового гормона при приеме препаратов 25(OH)D [24].
Таким образом, актуальность изучения взаимосвязи 25(OH)D и эндокринно-метаболических изменений у пациенток с СПКЯ несомненна, однако вопрос причинно-следственных связей и патогенеза остается дискутабельным, что требует углубленного изучения и проведения дополнительных исследований
Заключение
Таким образом, коррекция недостаточности 25(OH)D дополнительно к базисной терапии несомненно вносит вклад в улучшение метаболических и психологических параметров, кроме того положительно влияет на фертильность пациенток с СПКЯ.



