Зеркальный синдром, или Ballantyne-синдром, впервые описанный в 1882 г. John W. Ballantyn, представляет собой осложнение беременности, клинически очень схожее с преэклампсией [1]. Существующий в литературе термин «тройной отек» четко демонстрирует взаимосвязь между отеком плаценты, плода и отечным статусом самой беременной [2]. Зеркальный синдром – достаточно редкое осложнение беременности; к 2017 г. в литературе имеется сообщение о 113 таких пациентках [3].
Патогенетический механизм зеркального синдрома до конца не изучен, но, по данным различных исследований, имеет много общего с патогенезом преэклампсии. Авторы [2, 4] предполагают, что выраженный отек плаценты на фоне иммунной или неиммунной водянки плода приводит вторично к плацентарной ишемии, что является триггером для сброса в материнский кровоток токсических плацентарных факторов, одним из которых является fms-подобная тирозинкиназа (sFlt-1). В работе Espinoza J. et al. показано, что увеличение уровня sFlt-1, снижение уровня плацентарного фактора роста (PlGF) и повышение уровня соотношения sFlt-1/PlGF более 85 являются характерными для зеркального синдрома лабораторными критериями [4]. Но подобные изменения ангиогенных и антиангиогенных факторов имеют место и при преэклампсии.
Однако, в отличие от преэклампсии, зеркальный синдром может дебютировать раньше (начиная с 16 недель), возникает на фоне отека плаценты (62,8%) и водянки плода (94,6%), как иммунной, вследствие резус-сенсибилизации (16,8%), так и неиммунной, вследствие кардиальной патологии у плода, тахиаритмии, анемии по причине парвовируса В19 (16,8%), а-талассемии, различных осложнений монохориальной двойни: синдрома фето-фетальной трансфузии (СФФТ), синдрома анемии-полицитемии (САП), синдрома обратной артериальной трансфузии (СОАП) (16,8%) и др. [1, 5–8]. Также отличительными особенностями зеркального синдрома являются: наличие выраженной гемодилюции (анемии и гипоальбуминемии), повышение уровня мочевой кислоты, отсутствие гиперрефлексии в неврологическом статусе пациентки и тромбоцитопении, характерных для преэклампсии.
Общей же с преэклампсией симптоматикой являются появление отеков и патологическая прибавка в весе (84%), артериальная гипертензия (60,1%), повышение печеночных трансаминаз (19,4%), возможные головные боли (12,3%) и нарушения со стороны органов зрения (8,8%) [1].
Но главной отличительной особенностью зеркального синдрома является обратимость клинической симптоматики по мере разрешения отека плаценты и улучшения состояния отечного плода.
Существует много различных лечебных опций, которые могут быть использованы для лечения плода с водянкой в зависимости от этиологического фактора, ставшего причиной этого осложнения. Так, в случае резус-изоиммунизации или при анемии, вызванной парвовирусом В19, лечебным мероприятием является кордоцентез, внутриутробное переливание крови; в случае СФФТ, САП, СОАП – селективный фетоцид или фетоскопическая коагуляция анастомозов; при тахиаритмиях – соответствующая антиаритмическая терапия.
Если лечебные мероприятия, направленные на купирование водянки плода, окажутся эффективными, с большой вероятностью удастся добиться регресса клинической симптоматики зеркального синдрома у матери.
Однако не всегда водянка плода объяснима и обратима. В таких ситуациях единственным методом лечения зеркального синдрома может быть прерывание беременности или родоразрешение.
Прогноз зеркального синдрома в целом характеризуется высокой материнской заболеваемостью и перинатальной смертностью. Так, по данным Espinoza J., риск антенатальной гибели плода составляет 56% [4].
Описание
В своей статье мы описываем 2 наблюдения зеркального синдрома у пациенток с осложненным течением беременности монохориальной двойней.
Клиническое наблюдение № 1
Пациентка К., 39 лет, данная беременность вторая после криопереноса эмбриона, в анамнезе 1 роды, госпитализирована в Клинический госпиталь MD GROUP ГК «Мать и Дитя» с диагнозом: Беременность 19–20 недель, монохориальная биамниотическая двойня, САП 4 стадия, селективная задержка роста 2-го плода. Преэклампсия? Зеркальный синдром?
В течение последней недели пациентка отметила появление отеков нижних конечностей, прибавку массы тела 3 кг. При поступлении – выраженные отеки голеней, АД 150/100 мм рт. ст. При лабораторном обследовании выявлена анемия (гемоглобин 74 г/л) на фоне выраженной гемодилюции (гематокрит 23,8%), гипопротеинемия 52,8 г/л, в разовой порции мочи белок 425 мг/л, соотношение sFlt-1/PlGF – 188,7, sFlt-1 – 17375 пг/мл, PlGF – 92,1 пг/мл (тест Elecsys «Ф. Хоффман-Ля Рош», Швейцария, Cobas e411).
При ультразвуковом исследовании (УЗИ): дискордантность плодов по массе 33% (1-й плод 300 г/2-й плод 200 г), максимальный вертикальный карман 1-го плода – 73 мм, 2-го плода – 25 мм. Максимальная скорость кровотока в средней мозговой артерии (Vmax СМА) 1-го плода – 20 см/с (<1 МоМ), Vmax СМА 2-го плода 50 см/с (>1,5 МоМ), разность по Vmax СМА>0,5 МоМ; показатели допплерометрии в артерии пуповины 1-го плода – норма, в артерии пуповины 2-го плода – нулевой конечно-диастолический кровоток, венозный проток обоих плодов в пределах нормы. Также при УЗИ обращали на себя внимание изменения паренхимы печени 1-го плода (плода-реципиента) по типу «звездного неба» и «дихотомичная» «ступенчатая» плацента: толщина плаценты в зоне гемодинамического бассейна 1-го плода (реципиента) – 19 мм, 2-го плода (донора) – 46 мм, наличие выраженного асцита и отека мягких тканей у 2-го плода (донора).
Учитывая вышеописанную клинико-лабораторную картину у пациентки, наряду с ранней тяжелой преэклампсией, заподозрен зеркальный синдром. В сторону последнего свидетельствовали наличие выраженного отека в плаценте на фоне тяжелого течения САП, признаки водянки плода (выраженный асцит, отек мягких тканей), умеренная степень протеинурии и гипертензии, наличие анемии и выраженной гемодилюции. Так как для лечения зеркального синдрома необходимы мероприятия, направленные на купирование отека плаценты/плода, то, учитывая критическое состояние плода-донора, пациентке был предложен селективный фетоцид, от которого она отказалась.
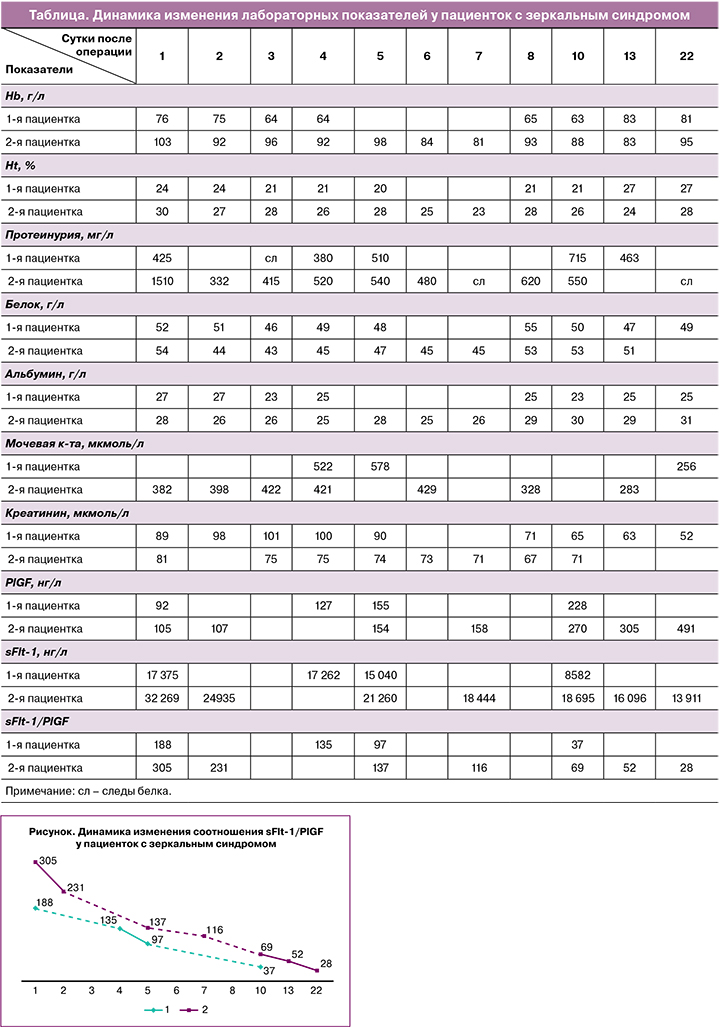
Консилиумом врачей с целью лечения САП 4 степени было принято решение о проведении фетоскопической лазерной коагуляции анастомозов. Под эпидуральной анестезией с помощью оборудования Karlshtorz и диодного лазера Dornier MedTech Medilas MultiBeam (длина волны 940 нм, мощность 33 Вт) выполнена последовательная селективная лазерная коагуляции анастомозов: коагулировано 5 АВ-анастомозов малого калибра, 2 АА-анастомоза среднего калибра, 1 АА-анастомоз крупного калибра. Через 12 ч диагностирована антенатальная гибель плода-донора. Через 24 ч после фетоскопической операции у пациентки появились кинические признаки отека легких: сухой кашель, сопровождающийся рвотой, снижение SрO2 до 89–90%; при компьютерной томографии легких – картина интерстициального отека легких, двусторонний гидроторакс (расхождение листков плевры справа 25 мм, слева 20 мм), что при УЗИ грудной клетки соответствовало 150 мл выпота в обеих плевральных полостях. Начата терапия отека легких (ингаляции кислорода, диуретическая терапия), продолжена гипотензивная терапия (метилдопа, амлодипин, бисопролол). Отмечен повышенный уровень мочевой кислоты – 552 ммоль/л, гемоглобин – 64 г/л, гематокрит – 21%. На 5-е сутки отек легких разрешился: сухой кашель купирован, SрO2 95–98%, при УЗИ грудной клетки в плевральной полости слева – 100 мл жидкости, справа – 50 мл. Отеки нижних конечностей значительно уменьшились, АД стабилизировалось на цифрах 130/80 мм рт. ст. Вместе с этим при УЗИ отмечено уменьшение отека плаценты. По лабораторным тестам – улучшение со стороны теста Elecsys (уровень соотношения sFlt-1/PlGF на 4-е сутки снизился до 97,03, sFlt-1 – до 15040 пг/мл, PlGF вырос до 155 пг/мл), однако выраженная анемия до 60 г/л на фоне гемодилюции (гематокрит 20,1%) и гипоальбуминемия (общий белок 48,7 г/л) сохранялись. На 6-е сутки после операции пациентка из отделения реанимации переведена в отделение патологии беременных, где продолжена терапия. В связи с сохраняющейся анемией дважды проведена гемотрансфузия, после которой уровень гемоглобина вырос до 76 и 83 г/л соответственно. На 9-е сутки после операции АД нормализовалось, однако сохранялась умеренная протеинурия, уровень соотношения sFlt-1/PlGF снизился до 37,53, sFlt-1 – до 8582 пг/мл, PlGF вырос до 228,7 пг/мл (таблица, рисунок). На 28-е сутки после фетоскопии в сроке 23 недели пациентка была выписана домой (при УЗИ предполагаемая масса плода 700 г, показатели допплерометрии в пределах нормы, АД и показатели общего анализа мочи в норме).
В 29 недель по поводу преждевременного разрыва плодных оболочек произведено кесарево сечение, извлечена живая недоношенная девочка весом 1670 г, оценка по шкале Апгар на 1-й минуте – 7 баллов, на 5-й минуте – 8 баллов, по Сильверману 4–5 баллов. Погибший плод мумифицирован, размерами 7×5 см. Газы крови плода: pH 7,411, BE -0,4, Lactat 2,9, Hb 176 г/л. Учитывая синдром дыхательных расстройств однократно эндотрахеально введен «Куросурф» из расчета 215 мг/кг. Респираторная поддержка – искусственная вентиляция легких (ИВЛ), экстубирован в возрасте 18 ч, далее переведен на неинвазивную ИВЛ в режиме Biphasic; с 3-х суток – на самостоятельном дыхании. На 8-е сутки после рождения ребенок из отделения реанимации и интенсивной терапии новорожденных (ОРИТН) переведен в отделение выхаживания недоношенных детей, выписан из госпиталя в возрасте 1 месяц 8 дней весом 2710 г.
Клиническое наблюдение № 2
Пациентка Г., 35 лет, данная беременность первая после криопереноса эмбриона, госпитализирована в Клинический госпиталь MD GPOUP ГК «Мать и Дитя» с диагнозом: Беременность 19 недель. Монохориальная биамниотическая двойня, САП 1 ст., селективная задержка роста 2 плода. Преэклампсия? Зеркальный синдром?
При поступлении жалобы на головную боль, рвоту, генерализованные отеки, повышение АД до 150/100 мм рт. ст. В анализах крови: гемоглобин 103 г/л, гематокрит 30%, белок крови 54,2 г/л, протеинурия 1510 мг/л, соотношение sFlt-1/PlGF – 305, sFlt-1 – 32 269 пг/мл, PlGF – 105 пг/мл (тест Elecsys «Ф. Хоффман-Ля Рош», Швейцария, Cobas e411). При УЗИ: дискордантность плодов по массе 42% (1-й плод 350 г/2-й плод 200 г), максимальный вертикальный карман 1-го плода 65 мм, 2-го плода – ангидрамнион, эхо-тень мочевого пузыря 2-го плода не визуализируется; Vmax СМА 1-го плода – 23 см/с (<1 МоМ), Vmax СМА 2-го плода 35 см/с (>1,5 МоМ), разность Vmax СМА>0,5 МоМ; показатели допплерометрии в артерии пуповины 1-го плода (реципиента) и 2-го плода (донора) в пределах нормы, венозный проток обоих плодов – норма. Печень 1-го плода (реципиента) – по типу «звездного неба», визуализируется «дихотомичная» «ступенчатая» плацента: 23 мм в гемодинамическом бассейне 1-го плода (реципиента) и 46 мм в бассейне 2-го плода (донора).
Клинико-лабораторная картина расценена как зеркальный синдром, и, учитывая прогрессирование симптоматики, неблагоприятный прогноз у плода-донора, пациентке предложен селективный фетоцид, проведена лазерная абляция интерстициального отдела пупочной вены. Через 48 ч после процедуры у пациентки появились сухой кашель, рвота, SpO2 – 92%. При компьютерной томографии легких выявлены интерстициальный отек, минимальный двусторонний гидроторакс, гидроперикард. Начата терапия отека легких, магнезиальная и гипотензивная терапия. На 7-е сутки отек легких разрешился, АД стабилизировалось (130/80 мм рт. ст.), генерализованные отеки купировались. При УЗИ отмечено уменьшение отека плаценты, тест sFlt-1/PlGF снизился с 305 до 116. Максимальное снижение гемоглобина до 81 г/л и гематокрита до 21% отмечено на 7-е сутки (таблица, рисунок). На 14-е сутки в сроке 21–22 недели пациентка выписана домой (предполагаемая масса плода по УЗИ 400 г).
В 31–32 недели по поводу преждевременного разрыва плодных оболочек произведено кесарево сечение, извлечена живая недоношенная девочка весом 1940 г, 43 см, оценка по шкале Апгар на 1-й минуте – 7 баллов, на 5-й минуте – 8 баллов, по Сильверману 5–6 баллов. Погибший плод мумифицирован, размерами 6×4 см. Учитывая синдром дыхательных расстройств, однократно эндотрахеально введен «Куросурф» из расчета 186 мг/кг. Респираторная поддержка – ИВЛ, экстубирован в возрасте 12 ч, далее переведен на неинвазивную ИВЛ в режиме Biphasic, с 3-х суток – на самостоятельном дыхании. На 22-е сутки после рождения ребенок из ОРИТН переведен в отделение выхаживания недоношенных детей. Выписан из госпиталя в возрасте 1 месяц 6 дней весом 2720 г.
Обсуждение
В представленных двух случаях мы столкнулись с осложнением беременности – зеркальным синдромом, напоминающим по клинической картине преэклампсию. У обеих пациенток зеркальный синдром развился при беременности монохориальной двойней, осложнившейся САП. САП в обоих случаях стал причиной выраженного отека плаценты в гемодинамическом бассейне, принадлежащем плоду-донору, и привел к развитию водянки плода-донора в 1-м клиническом случае. По данным Allarakia S. [1], осложнения монохориальной двойни являются причиной зеркального синдрома в 13,2% случаев. В наших двух случаях клиническая картина зеркального синдрома сопровождалась развитием интерстициального отека легких и двусторонним гидротораксом, что, по данным того же автора, встречается в 30% случаев Ballantyne-синдрома. Причина отека легких, по предположению Brochot C. et al., заключается в поражении эндотелиоцитов сосудов легких циркулирующими токсическими факторами плацентарного происхождения (предположительно sFlt-1, в том числе) [9]. Медиана времени, необходимого для разрешения клинической симптоматики зеркального синдрома, по данным Allarakia S. [1], составляет 5,5 дня, по данным других авторов – до 2 недель; максимальное описанное в литературе время, потребовавшееся для восстановления пациентки, – 90 дней (в случае тяжелой печеночно-почечной недостаточности). В наших случаях для разрешения отека легких понадобилось 5 и 7 суток, для регресса всей клинической симптоматики – 28 и 14 суток.
Также большой интерес представляет динамика изменения антиангиогенного (sFlt-1) и ангиогенного факторов (PlGF). Так, на высоте клинической симптоматики зеркального синдрома уровни sFlt-1 и соотношения sFlt-1/PlGF были максимальными, уровень PlGF – минимальным. Повышение sFlt-1 очень хорошо объясняет симптомы зеркального синдрома, которые обусловлены повреждающим эндотелий сосудов и вазоконстрикторным действиями sFlt-1, что подробно было описано в работах Goa S. et al. и Perfumo F. [10, 11]. Через 28 и 14 суток после гибели плодов-доноров и уменьшения отека плаценты регрессировала клиническая картина зеркального синдрома, что сопровождалось снижением sFlt-1 и нормализацией уровня соотношения sFlt-1/PlGF и косвенно подтвердило роль этого антиангиогенного фактора в манифестации клинической симптоматики зеркального синдрома.
Заключение
Оба клинических случая зеркального синдрома, сопровождающегося отеком легких, подтверждают, что беременность монохориальной двойней относится к группе высокого риска не только перинатальных, но и материнских осложнений. Появление у беременной пациентки артериальной гипертензии, протеинурии и такого серьезного осложнения, как отек легких, требует тщательной дифференциальной диагностики с преэклампсией, так как в случае преэклампсии подобная клиническая симптоматика необратима и является показанием для родоразрешения или прерывания беременности. Однако такая же клиническая симптоматика в рамках зеркального синдрома может быть обратимой по мере разрешения отека плаценты и водянки плода, что может дать шанс на рождение живого ребенка. Регресс клинической симптоматики зеркального синдрома сопровождается нормализацией уровня соотношения sFlt-1/PlGF, что может служить дополнительным лабораторным признаком для дифференциальной диагностики зеркального синдрома и преэклампсии.



