Во время беременности и кормления женская грудь претерпевает значительные изменения, затрагивающие функции эпителия и стромы, которые обеспечивают поддержание синтеза и секреции молока и его доставку ребенку. Грудное молоко является оптимальным продуктом питания новорожденного ребенка, максимально адаптированным к его потребностям и обладающим высокой биодоступностью. Более того, грудное молоко способствует защите здоровья ребенка, созреванию его иммунной системы, а процесс кормления необходим для становления психоэмоционального единения матери и новорожденного. В состав молока входят сотни биоактивных молекул (гидролитических ферментов, гормонов, факторов роста, цитокинов, пре- и пробиотиков и т.д.), соотношение которых невозможно воспроизвести в искусственных смесях. Однако главное отличие грудного молока от его субститутов заключается в присутствии уникального клеточного компонента, отличающегося высокой вариабельностью.
Клеточный состав молока может меняться в зависимости от многих факторов (длительности лактации, состояния здоровья матери и ребенка, жирности молока, времени, прошедшего с последнего кормления). На первом этапе вскармливания важнейшую роль играют лейкоциты молока, обеспечивающие иммунную защиту как матери, так и ребенка. Предполагается, что особое значение для этого процесса могут иметь макрофаги, активно мигрирующие в протоки желез. Помимо лейкоцитов, грудное молоко содержит также эпителиальные (от прогениторных до терминально дифференцированных) и стромальные клетки [1–7].
Приоритет грудного вскармливания является неоспоримым, исключение составляют только дети с некоторыми редкими врожденными заболеваниями. Успешное грудное вскармливание возможно при наличии у ребенка зрелого сосательного рефлекса и координации сосания, глотания и дыхания. Если ребенок не может быть приложен к груди после рождения, рекомендуется начать сцеживать молоко в течение первых 6 ч после родов. Молозиво, которое синтезируется в небольшом количестве в первые несколько дней после родов, крайне необходимо для ребенка, поэтому введение капель молозива за щеку ребенка рекомендуется даже детям с экстремально низкой массой тела и нуждающимся в искусственной вентиляции легких. При заболеваниях матери, вследствие которых временно необходимо принимать лекарства, не рекомендуемые при кормлении грудью, грудное вскармливание прекращается только на время лечения, в процессе которого также необходимо регулярно сцеживать грудное молоко. Таким образом, сцеживание грудного молока позволяет кормить больных новорожденных и недоношенных детей материнским молоком, а также поддерживать лактацию, пока мать или ребенок болеет или они находятся в разлуке.
В настоящее время существуют современные технологии, которые позволяют не только безопасно и комфортно сцеживать грудное молоко, сохранить лактацию и обеспечить больного ребенка питанием, но и создать определенный запас грудного молока (индивидуальный банк молока) [8]. Возможность хранения, с точки зрения микробиологической безопасности, нативного сцеженного грудного молока исследована многими авторами, и, несмотря на различные данные, сегодня нет сомнений в том, что сцеженное грудное молоко может храниться достаточно долго. Опубликовано большое количество исследований, которые предлагают различные временные промежутки для безопасного хранения сцеженного грудного молока без дополнительной обработки – от 48 ч до 8 суток [9, 10]. По данным ВОЗ, сцеженное молоко можно хранить в стерильной закрытой посуде при температуре +18–20 °С в темном месте в течение 24 ч, в холодильнике (при температуре +4–5 °С) – около 72 ч и в морозильнике (при температуре от 18 °С до –20 °С) – примерно 4 месяца [11]. Грудное молоко традиционно считалось стерильным, однако недавние исследования показали, что для кишечника ребенка молоко является постоянным источником разных бактерий, которые могут быть симбионтами, обладать взаимно полезными (мутуализм) и/или потенциально пробиотическими свойствами. Таким образом, изменение микробиоты кишечника матери в течение беременности и лактации напрямую воздействует на здоровье младенца [12].
Существующие рекомендации по хранению грудного молока при различных температурных режимах исходят из соображений сохранности основных нутриентов и предотвращения контаминации молока патогенной микрофлорой. Однако данные о сохранности клеточного компонента молока или изменении его состава в научной литературе отсутствуют. Учитывая потенциально высокую значимость материнских клеток молока для развития ребенка, исследование выживаемости клеток при различных режимах хранения молока является актуальным.
Цель исследования – определить состав и выживаемость клеточного компонента грудного молока при разных условиях сцеживания (одинарное или двойное) и хранения.
Материалы и методы
Образцы грудного молока. Исследовали 86 образцов грудного молока, полученных от 77 матерей. У 54 женщин беременность была одноплодной, у 23 – многоплодной. У 24 женщин роды произошли своевременно, средняя масса тела детей при рождении составила 3481 (376) г (от 1996 до 4230 г). У 53 женщин произошли преждевременные роды, средняя масса тела детей при рождении составила 2122 (636) г (от 850 до 3098 г).
Критерии включения: доношенная беременность и роды в срок 37–41 недель; преждевременные роды в сроке 26–36 недель; отсутствие воспалительных процессов молочной железы (мастит, трещины соска и т.п.); клинические показания для сцеживания грудного молока.
Критерии исключения: воспалительные заболевания молочной железы, отказ матери от участия в исследовании.
Грудное молоко (не менее 10 мл) собирали с помощью одинарного (63 образца) или двойного (23 образца) клинического молокоотсоса Symphony Medela. Каждый образец делили пополам в стерильных условиях, предварительно перемешав на вортексе, и хранили в течение 72 ч при охлаждении до 4 °С или комнатной температуре (RT, room temperature).
Определение количества клеток в образцах грудного молока. Общее количество и доли живых клеток оценивали через 4, 24 и 72 ч после сцеживания для обоих температурных режимов. Крайние временные точки были выбраны, исходя из рекомендаций компании Medela по хранению сцеженного грудного молока при комнатной температуре (4 ч) или при охлаждении до 4 °С (72 ч). Из каждого образца молока стерильно отбирали по 1 мл клеточной суспензии, трижды отмывали раствором Хэнкса («Панэко», Россия) с помощью центрифугирования в течение 10 минут при 1100 об/мин. Общее количество и доли живых клеток оценивали с помощью клеточного анализатора TC20 (Bio-Rad, США) при использовании программного обеспечения TC20 Data Analyzer Software.
Определение клеточного состава молока. Для определения экспрессии специфических поверхностных и внутриклеточных маркеров клеток использовали метод проточной цитофлуориметрии. Пермеабилизацию и фиксацию клеток для окрашивания на внутриклеточные маркеры осуществляли с помощью набора Inside Stain Kit (MiltenyiBiotec, Германия) в соответствии с рекомендациями производителя. Для окрашивания на поверхностные маркеры клетки ресуспендировали в фосфатно-солевом буфере в концентрации 100 000 клеток в 100 мкл и добавляли антитела. В качестве негативного контроля неспецифического связывания использовали изотипический контроль. Анализ проводили на цитофлуориметре Cytomics FC 500 (Beckman Coulter, США) с помощью программы CXP (Beckman Coulter, США). Используемые антитела приведены в таблице.

Статистический анализ. Количественные данные (масса тела детей при рождении, количество клеток в 1 мл молока и др.) представляли в виде среднего (M) и стандартного отклонения (SD) или в виде медианы и интерквартильного размаха (min, Q1, Me, Q3, max). При отсутствии нормального распределения независимые выборки сравнивали с использованием непараметрического U-критерия Манна–Уитни. Статистически значимыми считали различия при p<0,05. Обработку статистических данных проводили с помощью пакета SigmaStat (Systat Software, США).
Результаты и обсуждение
Общее содержание клеток в грудном молоке
Все полученные образцы грудного молока содержали клетки; общее их количество определяли сразу после доставки биоматериала в лабораторию (рис. 1, А). Данный параметр значительно варьировал в зависимости от образца, индивидуальные отличия превышали 2 порядка: от 5,4 тыс. до 858 тыс. клеток в 1 мл молока. Мы разбивали все образцы на 2 группы, отличающиеся либо типом используемого молокоотсоса (одинарный или двойной), либо сроком гестации (родоразрешение на сроках 26–36 недель или 37–41 неделя), либо количеством плодов (1 или 2 ребенка). Для каждого варианта распределения между группами сравнивали содержание клеток в единице объема грудного молока. После статистической обработки данных было обнаружено, что количество клеток молока не зависело от способа сцеживания (p=0,319), срока гестации (p=0,874) или количества плодов (p=0,705), медианный показатель во всех группах составил около 80 тыс. клеток в 1 мл молока (рис. 1, Б).
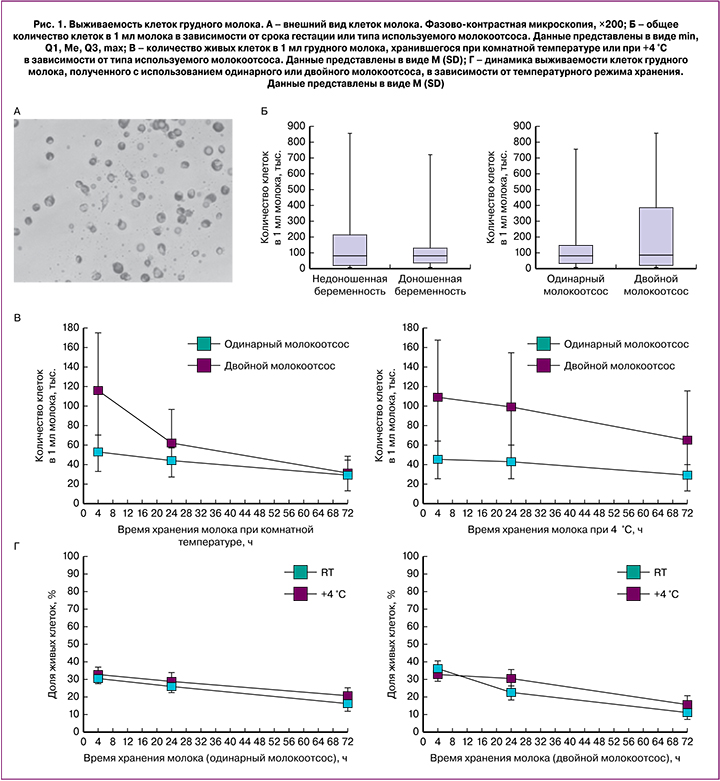
Таким образом, даже в случае преждевременных родов содержание клеток в грудном молоке находится на том же уровне, что и при своевременных родах, что еще раз подтверждает необходимость сохранения лактации и кормления недоношенных детей материнским молоком. В случае необходимости допустимо сцеживание молока, при этом использование двойного клинического молокоотсоса увеличивает как скорость сцеживания, так и объем сцеживаемого молока, по сравнению с одинарным молокоотсосом [13], однако само молоко при этом не снижает своего качества по общему содержанию клеток в единице объема.
Выживаемость клеток молока в зависимости от типа используемого молокоотсоса и режима хранения
Хранение при комнатной температуре приводило к постепенному снижению количества живых клеток в грудном молоке, через 72 ч среднее количество живых клеток в молоке составило около 30 тыс. клеток в 1 мл независимо от типа используемого молокоотсоса (p=0,895) (рис. 1, В).
При хранении молока при +4 °С среднее значение количества живых клеток в образцах, полученных с использованием двойного клинического молокоотсоса Symphony, было примерно в 2 раза выше во всех временных точках аналогичного показателя образцов, полученных с использованием одинарного молокоотсоса, однако отличия не достигали статистической значимости (p=0,178) (см. рис. 1, В).
При исследовании долей живых и погибших клеток было обнаружено, что в образцах, полученных при использовании одинарного молокоотсоса, температурный режим хранения влиял на динамику выживаемости клеток только в отдаленных временных точках, тогда как при хранении молока в течение 4 ч (рекомендуемое время для хранения молока при комнатной температуре с целью последующего кормления ребенка) этот показатель составил чуть более 30% (рис 1, Г).
В образцах, полученных при использовании двойного клинического молокоотсоса Symphony, наблюдали несколько иную динамику: охлаждение молока до +4 °С позволяло замедлить гибель клеток в течение первых 24 ч хранения (см. рис. 1, Г).
Таким образом, хранение молока, независимо от способа сцеживания, приводило к постепенному снижению количества живых клеток. В течение первых 4 ч хранения, независимо от выбранного температурного режима, около трети всех клеток оставались живыми. Охлаждение молока до +4 °С позволяло продлить период данного уровня выживаемости клеток, при этом в образцах, полученных с использованием двойного клинического молокоотсоса, данный эффект был более выраженным. Мы предполагаем, что на выживаемость клеток может влиять жировой компонент молока: известно, что фосфолипиды и триглицериды являются непроникающими криопротекторами. В сцеженном с помощью двойного клинического молокоотсоса Symphony грудном молоке содержание жира выше по сравнению с образцами, полученными с использованием одинарного молокоотсоса, что могло воздействовать на динамику выживаемости клеток в течение 24 ч при охлаждении до +4 °С [13].
Известно, что нативное молоко сохраняет свои защитные и нутритивные свойства, так как, помимо факторов гуморального иммунитета, содержит живые лейкоциты, что объясняет снижение количества бактериальных единиц в свежем молоке в течение нескольких часов. Именно поэтому, по мнению многих исследователей, сцеженное молоко может храниться при комнатной температуре по крайней мере в течение 4 ч без какой-либо обработки и использоваться для следующего кормления ребенка [14]. Некоторые авторы считают, что возможно хранение сцеженного молока в течение 4 ч и при более высокой температуре – 27–32 °С [9], а при охлаждении до 4 °C молоко можно хранить в течение 96 ч без существенных изменений не только количества бактериальных клеток, но и количества лейкоцитов, осмолярности, рН, концентраций IgA, лактоферрина, общего количества жира и свободных жирных кислот [15].
Внедрение современных организационных технологий по поощрению, поддержке и охране грудного вскармливания, наряду со сложнейшими лечебными мероприятиями, является одной из основных задач любого родовспомогательного учреждения и неонатологического стационара. К сожалению, в течение многих лет и до настоящего времени в РФ действуют нормативные документы, запрещающие хранение сцеженного грудного молока, а «…в случае необходимости отсроченного кормления новорожденного сцеженным молоком (отделение реанимации и т.п.) собранное грудное молоко подвергают пастеризации» [16]. Запрет на хранение и использование сцеженного материнского молока в акушерских и неонатологических стационарах вынуждает неонатологов назначать искусственные смеси для докорма новорожденных даже при достаточном количестве грудного молока у матери.
Полученные нами результаты позволяют утверждать, что с точки зрения сохранности клеточного компонента в течение первых 4 ч допустимо хранение сцеженного грудного молока при комнатной температуре, но более длительное хранение требует охлаждения до +4 °С, при этом оптимальное время хранения в таком режиме составляет 24 ч.
Гетерогенность клеток грудного молока
При исследовании с помощью световой микроскопии было подтверждено, что в грудном молоке содержится значительное количество гетерогенных по своим морфологическим и функциональным свойствам клеток. При переносе клеток в ростовую среду (DMEM/F12, содержащую 10% эмбриональной телячьей сыворотки) мы наблюдали прикрепление клеток к культуральной подложке (рис. 2, А). Большая часть клеток в дальнейшем откреплялась от подложки, оказавшись неспособной к пролиферации в условиях in vitro, однако через 5–7 суток мы наблюдали колонии клеток с характерным для эпителиальных культур рисунком поверхности типа «черепица», а через 2–3 недели появлялись колонии стромальных клеток, образующих характерный для фибробластоподобных клеток волновой рисунок (рис. 2, Б, В). Среди эпителиальных клеток присутствовали клетки, экспрессирующие маркер люминального эпителия цитокератин 18, а также миоэпителиальные клетки, экспрессирующие гладкомышечный актин (αSMA) (рис. 2, Г, Д). Стромальные клетки экспрессировали виментин (рис. 2, Е).
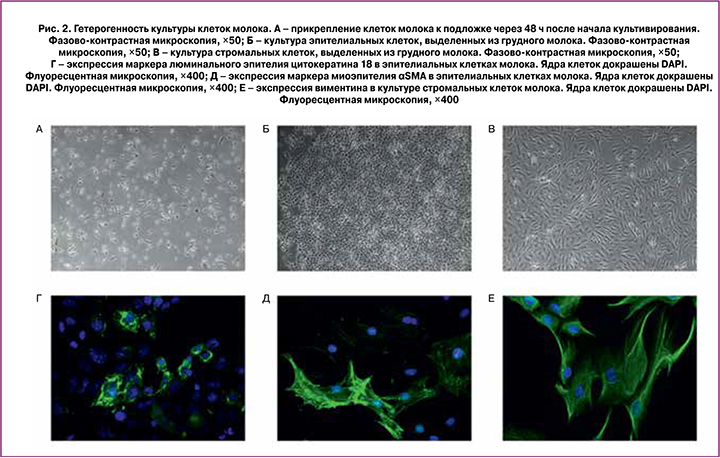
Все клетки молока по их происхождению предложено разделять на две группы – попавшие в молоко из крови матери или из тканей молочной железы. К первой группе относят клетки иммунной системы и гематопоэтические стволовые/прогениторные клетки, ко второй группе – лактоциты, люминальные эпителиальные клетки, миоэпителиальные клетки, эпителиальные прогениторные клетки, а также клетки, экспрессирующие маркеры мезенхимальных и эмбриональных стволовых клеток [17–19]. Основной популяцией клеток зрелого молока здоровой матери являются эпителиальные клетки (включая р63+ прогениторные клетки, миоэпителиальные клетки, клетки люминального эпителия и терминально дифференцированные лактоциты). Открытым остается вопрос иерархии этих эпителиальных клеток: некоторые исследователи считают, что люминальный эпителий в условиях in vitro может переходить в миоэпителий, другие предполагают, что к подобному взаимному переходу способны предшественники мио- и люминального эпителиев, третьи говорят о возможности одновременной экспрессии маркеров люминального эпителия и миоэпителия [1, 20–22]. Общим маркером для всех эпителиальных клеток грудного молока является EpCam (молекула клеточной адгезии эпителия) – мембранный белок, опосредующий Ca2+-независимую межклеточную адгезию в эпителии, который был выбран нами в качестве маркера эпителиальной фракции клеток молока.
Как в нашем, так и в сходных исследованиях стромальные клетки появлялись в первичной культуре значительно позднее эпителиальных; некоторые авторы предполагают, что столь позднее их появление в культуре может являться следствием эпителио-мезенхимального перехода, однако этот вопрос требует дальнейшего изучения [23, 24].
Известно, что в процессе внутриутробного развития происходит обмен стволовыми/прогениторными клетками между матерью и ребенком; возможно, что микрохимеризация продолжается и во время грудного вскармливания. Исследования на животных показали, что клетки молока способны выживать в незрелом желудочно-кишечном тракте потомства, мигрировать в кровоток и заселять органы in vivo, влияя на гомеостаз тканей, их развитие и регенерацию, а также обеспечивая уникальную толерантность новорожденного по отношению к материнским антигенам, реализуемую, например, в лучшей переносимости трансплантации материнских органов детям, которые находились на грудном вскармливании. Все вышеперечисленное подтверждает гипотезу о том, что с грудным молоком материнские клетки поступают к ребенку, где они в определенной мере влияют на его развитие в раннем возрасте [1, 3, 5, 6, 19].
Выживаемость популяций клеток в грудном молоке при различных режимах хранения
С помощью проточной цитофлуориметрии исследовали содержание различных типов клеток в образцах. Выбранные маркеры позволили выделить отдельные популяции EpCam+ эпителиальных клеток, CD45+ лейкоцитов и Vim+ стромальных клеток. Анализ результатов исследования был в значительной степени затруднен в силу высокой индивидуальной вариабельности образцов как по общему количеству клеток, так и по соотношению клеточных типов, что является следствием зависимости клеточного компонента молока от множества факторов: срока, прошедшего после родоразрешения, состояния здоровья матери и ребенка, степени опустошения груди перед сцеживанием и др.
Так как на предыдущем этапе исследования мы выявили, что выживаемость клеток имеет сходную динамику и при хранении в течение 72 ч не зависит от типа используемого молокоотсоса, мы сравнили образцы молока через 4 и 72 ч после сцеживания. Оказалось, что при такой длительности хранения молока двумя основными популяциями клеток являются эпителиальные клетки и лейкоциты, в то время как виментин-положительные стромальные клетки являются минорной популяцией (рис. 3, А). При длительном хранении охлажденного молока доля виментин-положительных клеток оставалась очень низкой, доля лейкоцитов снижалась (медианные значения уменьшались с 26 до 21%), а доля эпителиальных клеток соответствующим образом возрастала (рис. 3, Б).
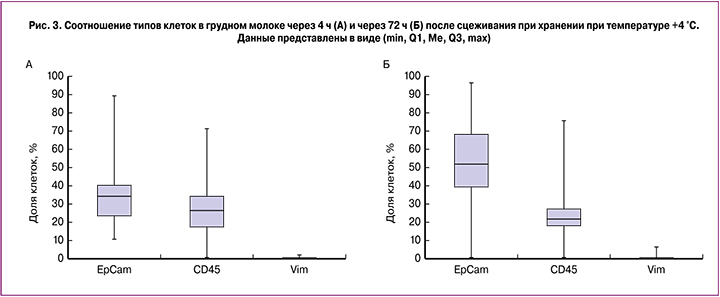
Лейкоциты преобладают в составе молозива (до 70% всех клеток) и представлены в основном макрофагами (до половины всех лейкоцитов), нейтрофилами (до 40–50%) и, в меньшей степени, Т-лимфоцитами (не более 8%) и В-лимфоцитами (менее 1%). В зрелом же молоке лейкоциты являются транзиентной популяцией: количество их в значительной степени зависит от состояния здоровья диады «мать–ребенок», а продолжительность жизни колеблется от нескольких часов до нескольких месяцев в зависимости от типа [22, 25–27]. Мы предполагаем, что при длительном хранении молока в первую очередь погибали короткоживущие субпопуляции лейкоцитов.
Заключение
Нами установлено, что общее количество клеток в единице объема грудного молока не зависит от способа сцеживания, срока гестации или количества плодов: медианный показатель во всех группах составляет около 80 тыс. клеток в 1 мл молока. При использовании двойного клинического молокоотсоса Symphony увеличиваются как скорость сцеживания, так и объем сцеживаемого молока по сравнению с одинарным молокоотсосом, однако эти условия не влияют на общее содержание клеток в единице объема.
Клетки молока гетерогенны по своим морфологическим и функциональным свойствам, основными популяциями клеток являются эпителиальные клетки (в том числе миоэпителиальные клетки и люминальный эпителий) и лейкоциты, в то время как виментин-положительные стромальные клетки являются минорной популяцией. Соотношение двух основных популяций имеет значительные отличия в зависимости от индивидуальных особенностей донора молока. Хранение молока приводит к небольшому сдвигу соотношения эпителиальных клеток и лейкоцитов в пользу первых за счет частичной гибели короткоживущих субпопуляций лейкоцитов.
Хранение молока, независимо от способа сцеживания, приводит к постепенному снижению количества живых клеток, однако в течение первых 4 часов хранения независимо от выбранного температурного режима около трети всех клеток остаются живыми. Охлаждение молока до +4 °С позволяет продлить период данного уровня выживаемости клеток до 24 ч, при этом в образцах, полученных с использованием двойного молокоотсоса, данный эффект был более выраженным, что, по-видимому, обусловлено более высоким содержанием жира в молоке, сцеженном при использовании двойного молокоотсоса.
В случае необходимости отсроченного кормления сцеженным материнским молоком при соблюдении гигиенических требований собранное грудное молоко можно хранить в индивидуальных контейнерах при комнатной температуре в течение 4 ч или в холодильнике при температуре +4 °C в течение 24 ч без пастеризации.



