После введения приказа Министерства здравоохранения и социального развития Российской Федерации от 27.12.11 №1687н «О медицинских критериях рождения, форме документа о рождении и порядке его выдачи» [1], в котором изменились критерии живо- и мертворождения, в России особенно актуальными стали проблемы сверхранних преждевременных родов (СПР) и выхаживания новорожденных с экстремально-низкой массой тела (ЭНМТ). Родоразрешение в сроке экстремально недоношенной беременности (22–27/6 недель) определяет основную причину перинатальной заболеваемости и смертности новорожденных.
В структуре перинатальной заболеваемости и смертности детей с ЭНМТ лидирующее место занимают синдром дыхательных расстройств, гипоксия, поражение головного мозга в виде внутрижелудочковых кровоизлияний, а также генерализованная инфекция [2]. В процессе реабилитации у таких новорожденных формируются психоневрологические нарушения, требующие специального длительного наблюдения и лечения. Трудности реабилитации новорожденных с ЭНМТ из-за их низкой жизнеспособности создают и социальные проблемы для семьи и общества. Поэтому, предупреждение перинатальных потерь и тяжелой инвалидизации экстремально-недоношенного новорожденного заключается в максимально возможном создании благоприятных условий для его постнатальной жизни. Выхаживание экстремально-недоношенных детей требует применения современного оборудования для осуществления первичной реанимации, проведения длительной респираторной поддержки, создания благоприятных условий для выхаживания новорожденного, обучения медицинского персонала и родителей особенностям ухода, кормления, мониторинга состояния и лечения [3].
Адекватная нутритивная поддержка недоношенных детей с первых дней жизни особенно важна, так как в значительной степени определяет прогноз развития. Известно, что материнское молоко и вскармливание ребенка до двух лет обеспечивают незаменимый источник питания и обеспечивают здоровье детей [4]. Вскармливание экстремально-недоношенных новорожденных является особо сложной задачей в связи с тяжелым или критическим состоянием, незрелостью всех органов и систем. Ограниченное поступление питательных веществ препятствует адекватному физическому и психомоторному развитию новорожденного [5]. Экстремальная недоношенность не должна являться абсолютным показанием к парентеральному питанию, поскольку организм такого новорожденного способен усваивать питательные вещества из молока матери. Раннее энтеральное питание способствует благоприятному развитию желудочно-кишечного тракта и формирует иммунитет, который повышает возможности организма недоношенного новорожденного. Обсеменение госпитальной микрофлорой на фоне нарушенной перистальтики кишечника обусловливает высокую частоту инфекционного поражения кишечника. Наличие иммуноглобулинов в материнском молоке препятствует формированию некротизирующего энтероколита у детей и стимулирует дозревание кишечника [6, 7]. Качественный состав материнского молока обеспечивает легкое усвоение питательных веществ и микроэлементов и хорошо переносится недоношенными детьми. Благодаря этому, возможно достичь полного объема энтерального питания молоком матери в ранние сроки после рождения. В связи с этим работа медицинского персонала должна быть направлена на сохранение грудного вскармливания, учитывая особую роль материнского молока для экстремально-недоношенного новорожденного.
Однако определено, что качественный и количественный состав грудного молока женщин после СПР ограничен и не обеспечивает необходимыми питательными веществами новорожденного, поэтому остро встает вопрос его коррекции [8]. Некоторые авторы предлагают фортифицировать (искусственно обогатить питательными веществами и витаминами) материнское молоко [9]. В обзорах Cochrane [10] показано, что обогащение грудного молока мультипитательными витаминизированными компонентами повышает темпы роста недоношенного новорожденного. Другие авторы [11] отмечают, что недоношенные дети при кормлении грудным молоком, укрепленным стандартными фортификаторами, получают количество белка, не удовлетворяющее их потребности. Ряд авторов предлагает использовать донорское грудное молоко, объясняя его преимущество по сравнению с низким качеством материнского молока женщин после преждевременных родов [12]. При изучении зарубежной и отечественной литературы, обращает на себя внимание, что поддержка энтерального питания экстремально-недоношенных новорожденных в основном направлена на искусственное улучшение качества сцеженного материнского молока, а не на естественное улучшение его качества, благодаря нормализации лактационной функции в период ее становления, а также полноценной и сбалансированной диете матери, богатой белковыми, энергетическими и электролитными компонентами.
На данном этапе проблема поддержки грудного вскармливания после СПР остается крайне актуальной в связи с трудностями, возникающими после родов. Раздельное пребывание матери и новорожденного, находящегося в отделении реанимации и интенсивной терапии, отсутствие постоянного тактильного и зрительного контакта, позднее становление лактации в связи с несовершенством организации ранних и регулярных сцеживаний, стресс и депрессивные состояния [13], отсутствие полноценной информации, все это формирует препятствия для полноценного вскармливания экстремально-недоношенного новорожденного. Поэтому необходима разработка и внедрение системы, которая способствует становлению лактационной функции и улучшению перинатальных исходов [14].
Цель: оценка эффективности внедрения системы профилактики и коррекции нарушений становления лактационной функции у женщин после СПР.
Материал и методы исследования
Было проведено исследование лактационной функции в динамике послеродового периода у 60 пациенток, родоразрешившихся в клинике НИИ ОММ за 2015–2016 гг. Основную группу составили 20 пациенток, родоразрешившихся в сроках 22–27/6 недель гестации, и их новорожденные. Пациентки основной группы получали комплексную психологическую помощь, применяли совместное пребывание с новорожденным, употребляли лактационные смеси. В группу сравнения вошли 20 пациенток, которые не получали методы коррекции лактационной функции, и их новорожденные. В качестве контрольной группы, для объективизации данных, было проведено исследование лактационной функции 20 пациенток, родоразрешившихся в сроке доношенной беременности в этот же период времени.
Исследование биохимического и электролитного состава материнского молока на 30-е сутки после родов проводилось на биохимическом автоматическом анализаторе Sapphire 400 (Япония) с помощью унифицированных тест-систем производства Cormay (Польша), Axis (Великобритания). Количественные характеристики выделения молока определялись с помощью мерной бутылочки со шкалой деления.
Основные вычисления и статистическая обработка полученных данных проводилась с помощью пакета Microsoft Excel 2010, а также с помощью пакета прикладных программ SPSS, версия 17. Для количественных показателей определяли М – среднее арифметическое, стандартное отклонение по выборке, ошибку среднего арифметического (m). Различия считались достоверными при р<0,05.
Результаты и обсуждение
Средний возраст женщин основной группы составил 32,1±6,06 года, средний срок родоразрешения 26,55±0,69 недель. В группе сравнения средний возраст женщин составил 30,4±2,12 года, а средний срок родоразрешения – 26,5±1,01 недель. Достоверных различий по этим параметрам между основной группой и группой сравнения не получено (p>0,05).
В контрольной группе средний возраст женщин составил 29±4,03 года (p>0,05), а средний срок родоразрешения 39,1±1,04 недель (p<0,05). Средняя масса тела при рождении у детей от пациенток основной группы составила 841,15±102,2 г, длина тела 33±1,3 см. В группе сравнения средняя масса тела новорожденных составила 864,38±96,9 г, длина тела 33±3,02 см, достоверных отличий по антропометрическим показателям между новорожденными от пациенток основной группы и группы сравнения не получено (p>0,05).
С сентября 2015 года в нашем учреждении применяется семейно-ориентированная система реабилитации лактационной функции у женщин после СПР. Данная система включает в себя следующие компоненты:
Лечебно-охранительный режим: пребывание пациенток после СПР в изолированном от палат «мать и дитя» реабилитационном блоке с возможностью свободного посещения родственниками. После выписки из роддома женщины переводятся в специальные материнские комнаты рядом с отделением реанимации новорожденных с возможностью круглосуточного посещения своих новорожденных и контактов с семьей. На втором этапе выхаживания женщины находятся с новорожденным круглосуточно в палатах «мать и дитя».
Психологическая реабилитация семьи после СПР: с первых суток после родов с пациентками и членами их семей работает перинатальный психолог. В первые пять суток после родов применяется персонифицированный подход и проводятся индивидуальные консультации. После перевода пациентки из роддома на базе детской клиники организованы групповые занятия для родильниц и членов их семей в школе «Любимый ребенок». Такие занятия направлены на повышение психических ресурсов и адаптационных возможностей человека, гармонизацию психического развития, охрану здоровья, профилактику и психологическую реабилитацию. Следствием комплексной психологической реабилитации является улучшение становления лактационной функции и более длительного грудного вскармливания.
Обучение родильниц правильному сцеживанию. Сцеживание молозива начинается при отсутствии противопоказаний с первых минут после родоразрешения: для этой цели инструктор по грудному вскармливанию при участии акушерок и неонатологов проводит раннее сцеживание (на родовом или операционном столе) с закапыванием молозива в ротовую полость экстремально-недоношенного новорожденного. В последующем на этапе послеродовой реабилитации родильницы проводят сцеживание с помощью современных молокоотсосов с возможностью подбора индивидуальной программы сцеживания и централизованной стерилизации расходных материалов. Такие молокоотсосы имеются на всех этапах пребывания родильницы. Сцеженное молозиво и молоко доставляется самой родильницей или медперсоналом в отделение реанимации новорожденных для их раннего энтерального вскармливания. При этом мать участвует в проведении вскармливания новорожденного.
Метод «Кенгуру», проведение которого начинается уже на этапе пребывания новорожденного в отделении реанимации и продолжается в отделении второго этапа выхаживания при совместном пребывании матери и экстремально-недоношенного новорожденного. Ритм материнского сердца, ее дыхания, ощущение ее запаха частично создает привычные условия внутриутробного существования. Тепло материнского тела позволяет недоношенному новорожденному не расходовать дополнительной энергии, чтобы согреваться. В таких условиях гораздо проще сохранять стабильное состояние организма. При этом женщина чувствует себя спокойнее, она испытывает тактильный и психологический контакт, который также способствует становлению лактационной функции. Поэтому необходимо поощрять более частое применение данного метода.
Организация полноценного питания родильницы с использованием лактационных смесей, которые используются в качестве дополнительного питания в период грудного вскармливания с целью нормализации качественного состава молока и увеличения объема лактации, необходимо. Это белковое питание по составу приближено к грудному молоку. Примером могут явиться сухие витаминизированные молочные смеси. Они обогащены полиненасыщенными жирными кислотами и таурином. Смеси применяются, как добавка к основному рациону матери в течение дня по 2–3 стакана.
На основании проведенных нами ранее исследований [8] в случаях СПР выявлено, что качественный состав грудного молока к окончанию первого месяца после родов беден питательными веществами и не способен полностью удовлетворить потребности недоношенных детей, поэтому нередко исключительно грудное вскармливание невозможно. Также для обеспечения полного энтерального питания необходим адекватный объем лактации, поддерживающийся на протяжении периода вскармливания. Поэтому необходимо применение комплексного подхода в разработке системы улучшения лактационной функции у женщин после СПР.
В нашем учреждении эти принципы с сентября 2015 года введены в организацию реабилитации родильницы после СПР и выхаживания экстремально недоношенных новорожденных.
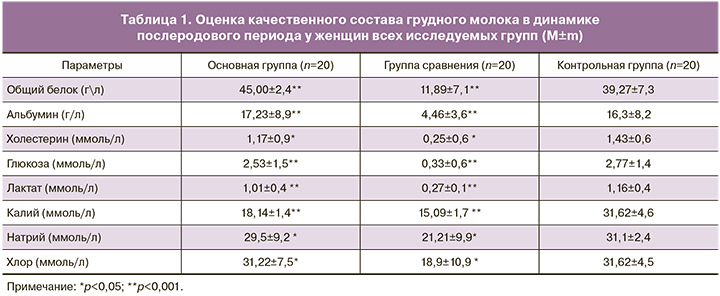
Основные результаты исследования качественного состава грудного молока родильниц после СПР при проведении комплекса реабилитационных мероприятий представлены в табл. 1.
На основании проведенных исследований было выявлено, что суточный объем секреции грудного молока на 30-е сутки у женщин основной группы, у которых применялась комплексная семейно-ориентированная реабилитация лактационной функции, увеличился в 1,7 раза (326,75±122,12 мл/сут), по сравнению с пациентками, которым реабилитация не проводилась (группа сравнения) (191,75±138,61 мл/сут). Прирост объема молока за первый месяц в обеих группах одинаков, увеличился равномерно в 1,5 раза. При этом соотношение объема дневного и ночного выделения молока сохранено в обеих группах.
Исследование биохимического состава молока у женщин основной группы, получавших системную реабилитацию лактационной функции, на 30-е сутки показало в 4 раза более высокий уровень общего белка (45,00±2,4 г/л) и альбумина (17,23±8,9 г/л), чем в молоке женщин группы сравнения, не получавших комплексную коррекцию лактационной функции (общий белок 11,89±7,1 г/л и альбумин 4,46±3,6 г/л) (р<0,001). Показатели общего белка и альбумина у пациенток основной группы выше их содержания в грудном молоке женщин, родоразрешившихся в срок (общий белок 39,27±7,3 г/л и альбумин 16,3±8,2 г/л). Это свидетельствует о том, что при применении комплексной реабилитации белковый состав даже небольшого объема сцеженного материнского молока после СПР достаточно насыщен для обеспечения оптимальной защиты от неблагоприятных воздействий, адекватного роста и развития новорожденного.
Энергетический состав грудного молока пациенток основной группы также улучшается. К 30-м суткам послеродового периода уровень холестерина увеличивается почти в 5 раз (1,17±0,9 ммоль/л) по сравнению с уровнем его содержания в молоке женщин после СПР, не получавших комплексную реабилитацию лактационной функции в течение первого месяца послеродового периода (0,25±0,6 ммоль/л) (р<0,05). В это же время, в группе женщин после срочных родов (контрольная группа) уровень холестерина незначимо выше (1,43±0,6 ммоль/л) по отношению к его содержанию в молоке пациенток после СПР, получавших комплексную реабилитацию. При таком уровне поступления липидов, содержавшихся в грудном молоке женщин после СПР, соответствующем уровню их содержания в грудном молоке женщин, родоразрешившихся в сроке доношенной беременности, будет возможно адекватное формирование структур головного мозга, когнитивных функций растущего организма, а также формирование иммунного ответа, что в итоге снижает риск перинатальных осложнений.
Содержание глюкозы, главного питательного компонента для головного мозга, в молоке у пациенток основной группы на 30-е сутки исследования было в 7,5 раза выше (2,53±1,5 ммоль/л) (р<0,001), чем на 30-е сутки в группе женщин группы сравнения (0,33±0,6 ммоль/л). В группе пациенток, родоразрешившихся в сроке доношенной беременности, на 30-е сутки послеродового периода уровень глюкозы был незначимо выше (2,77±1,4 ммоль/л) по сравнению с ее уровнем в грудном молоке женщин основной группы. Уровень лактата в грудном молоке у пациенток после СПР, получавших комплексную реабилитацию лактационной функции, к 30-м суткам увеличивался до 1,01±0,4 ммоль/л (р<0,001), в то время как у пациенток после СПР группы сравнения его уровень был практически в 4 раза меньше (0,27±0,1 ммоль/л). В молоке женщин после срочных родов содержание лактата (1,16±0,4 ммоль/л) соответствовало его содержанию в молоке женщин основной группы. Это свидетельствует о том, что углеводный состав грудного молока у пациенток основной группы способен стимулировать рост нормальной микрофлоры и ингибировать патогенную флору для адаптации организма глубоко недоношенного новорожденного.
Был исследован электролитный состав грудного молока: содержание кальция, калия, натрия, хлора. У пациенток основной группы на 30-е сутки уровень калия был значимо выше (18,14±1,4 ммоль/л) (р<0,001), чем у женщин после СПР, не получавших поддержку грудного вскармливания в течение первого месяца послеродового периода (15,09±1,7 ммоль/л). На 30-е сутки уровень натрия в грудном молоке пациенток после СПР, получавших комплексную реабилитацию лактационной функции (29,5±9,2 ммоль/л) (р<0,05), также как и в группе пациенток после срочных родов (31,1±2,4 ммоль/л), был выше, чем на 30-е сутки у пациенток группы сравнения (21,21±9,9 ммоль/л). Натрий способствует поддержанию осмотического давления в жидкостях организма и водного баланса. Адекватный уровень хлора, кроме поддержания кислотно-щелочного и водного баланса, улучшает работу желудочно-кишечного тракта. Его уровень в грудном молоке пациенток основной группы был почти в 2 раза выше (31,22±7,5 ммоль/л) по отношению к его содержанию у пациенток группы сравнения (18,9±10,9 ммоль/л) (р<0,05), и соответствовал его уровню в грудном молоке женщин после срочных родов (31,62±4,5 ммоль/л). Различий по содержанию кальция во всех трех группах не выявлено.
Качественный состав грудного молока у пациенток после СПР, получавших методы коррекции лактационной функции в течение первого месяца послеродового периода, значительно отличался от его состава у пациенток после СПР, не получавших системную реабилитацию. Оценивая качественный состав грудного молока женщин основной группы на 30-е сутки после родов, можно предположить, что экстремально недоношенные дети при вскармливании нативным молоком не испытывают дефицита в питательных веществах и электролитах. Сбалансированная диета матери, обогащенная белковыми, энергетическими и электролитными компонентами, индивидуальная и групповая психологическая помощь, а также максимально тесный и продолжительный контакт матери и новорожденного способствует улучшению становления лактационной функции и качественных характеристик грудного молока. Поэтому нами были оценены исходы для новорожденных у женщин основной группы и группы сравнения.
Состояние детей основной группы и группы сравнения, родившихся в сроках СПР, оценивалось как тяжелое. Всем детям проводился комплекс реанимационных мероприятий в родильном зале и перевод в отделение реанимации и интенсивной терапии для дальнейшего наблюдения и лечения. Средняя продолжительность пребывания детей в отделении реанимации, длительность проведения искусственной вентиляции легких в обеих группах не различались (р>0,05). После стабилизации общего состояния и основных витальных функций дети переводились в отделение патологии новорожденных, где проводилось выхаживание в соответствии с современными технологиями. Стоит отметить, что дети из основной группы выхаживались по новой системе реабилитации, а дети из группы сравнения по старой системе.
При анализе структуры заболеваний установлено, что у 100% детей основной группы и группы сравнения выявлено перинатальное поражение центральной нервной системы тяжелой степени. У 25% наблюдаемых детей в этих же группах выявлены внутрижелудочковые кровоизлияния разной степени тяжести (I–III степени). За время наблюдения более высокая частота неврологической патологии была у детей группы сравнения (45% детей), где исходом церебральной ишемии стали перивентрикулярный глиоз и формирование лейкомаляционных псевдокист, а у детей из основной группы этот показатель ниже в 2 раза и составил 25%. К 38–40 неделям постконцептуального возраста у детей основной группы достоверно реже встречались синдром двигательных нарушений и синдром вегето-висцеральных дисфункций, чем у детей из группы сравнения (р<0,05).
Также стоит отметить, что зарегистрированная анемия тяжелой степени в группе сравнения была диагностирована у 97,5%, а в основной группе этот показатель был в 1,5 раза ниже и составил 70% (р<0,05).
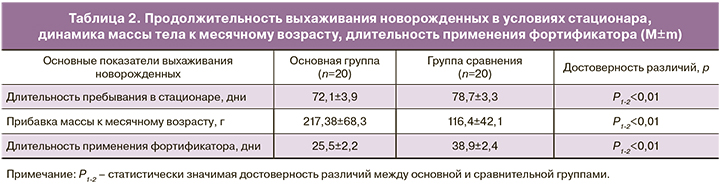
Продолжительность выхаживания детей в условиях стационара была достоверно ниже у детей основной группы (р<0,01). Также обращает на себя внимание более высокая прибавка массы тела к месячному возрасту у детей основной группы, чем у детей группы сравнения (р<0,01). Данные представлены в табл. 2.
При анализе биохимических показателей крови у детей к месячному возрасту выявлено, что у детей группы сравнения уровень общего белка в крови увеличивается в 1,2 раза (с 39,83±5,35 г/л до 49,8±2,07 г/л), тогда как его уровень в крови детей основной группы увеличивается практически в 2 раза (с 30,87±4,8 г/л до 52,2±1,57 г/л) (р<0,05). Также обращает на себя внимание динамика уровня глюкозы у детей обеих групп. Так, у детей группы сравнения уровень глюкозы в крови к месячному возрасту увеличивается в 2 раза (с 1,8±0,7 ммоль/л до 3,9±0,57 ммоль/л), тогда как этот показатель в основной группе увеличивается в 2,5 раза (с 1,79±0,61 ммоль/л до 4,27±0,72 ммоль/л) (р<0,05).
Недоношенные дети зачастую отстают по антропометрическим показателям от центильных норм. Для того чтобы обеспечить таким детям догоняющий рост, необходимо усиленное вскармливание: грудное молоко с обогатителем [15]. Дети, родившиеся в сроке СПР, как в основной группе, так и в группе сравнения вскармливались грудным молоком с обогащением грудного молока фортификаторм «ПреНаН». Этот гипоаллергенный обогатитель грудного молока благодаря своему составу способствует росту недоношенных новорожденных. В его состав входит глубоко гидролизированный белок молочной сыворотки, мальтодекстрин, дополнительный источник углеводов и витаминов и минеральные вещества, содержание которых соответствует последним научным рекомендациям.
Стоит отметить, что количество обогатителя и длительность обогащения фортификатором «ПреНаН» детей из основной группы были достоверно ниже, чем у детей из группы сравнения (р<0,01). Так длительность обогащения фортификатором детей основной группы в 1,5 раза меньше (25,5±2,2 дня), чем в группе сравнения (38,9±2,4 дня) (р<0,01). В связи с этим сроки выхаживания экстремально недоношенных новорожденных сокращаются. Так в основной группе выписка из стационара происходит на неделю раньше (72,1±3,9 дня), чем в группе сравнения (78,7±3,3 дня). Данные представлены в табл. 2. Это связано с тем, что у женщин основной группы показатели уровня общего белка, альбумина, глюкозы значительно выше, чем у женщин в группе сравнения.
Заключение
Научная новизна нашей работы заключается в комплексном подходе к организации системы поддержки грудного вскармливания у родильниц после СПР, а также в изучении качественного состава молока до и после применения системы. Результаты представленных исследований свидетельствуют об эффективности системы профилактики и коррекции нарушений становления лактационной функции у женщин после СПР. Это подтверждают улучшение качественных и количественных характеристик грудного молока, а также более высокие темпы прибавки массы тела новорожденных, нормализация их биохимических показателей, сокращение продолжительности пребывания детей в условиях стационара.
Комплексный подход в реабилитации лактационной функции родильницы акушером-гинекологом, совместно с психологом, специалистом по грудному вскармливанию и неонатологом способствует полноценному становлению лактации и, тем самым, созданию оптимальных условий и адекватного питания для успешного выхаживания экстремально-недоношенных новорожденных.



