Рак шейки матки (РШМ) является четвертым по частоте онкологическим заболеванием, диагностируемым во всем мире, и четвертой по значимости причиной смертности от рака у женщин [1]. Благодаря программам скрининга и доступной вакцинации против вируса папилломы человека (ВПЧ) за последние несколько десятилетий заметно снизилась частота заболеваемости и смертности от РШМ [2]. Пятилетняя выживаемость в основном зависит от стадии заболевания и достигает 92% при локализованном варианте. РШМ чаще всего диагностируют у женщин репродуктивного возраста (35–44 года) [3]. Противоопухолевая терапия часто приводит к развитию индуцированной менопаузы. Сохранение фертильности (конизация, трахелэктомия) возможно при ранних стадиях плоскоклеточного РШМ (ПРШМ): при IA1 стадии без инвазии в лимфоваскулярное пространство и стадии IA1 с инвазией в лимфоваскулярное пространство или стадиях от IA2 до IB1) с низким риском рецидива рака (размер поражения <2 см и отсутствуют метастазы в лимфатические узлы). Лечение на поздних стадиях заболевания представлено лучевой терапией (40–50 Гр), платиносодержащей химиотерапией и брахитерапией (30–40 Гр) [4]. Облучение чрезвычайно токсично для яичников и характеризуется дозозависимым эффектом. Доза облучения 2 Гр сопровождается гибелью половины популяции ооцитов, тогда как доза 6 Гр может вызывать необратимый гипогонадизм. Преждевременная менопауза у женщин, перенесших противоопухолевое лечение, сопровождается внезапным началом климактерических расстройств и увеличением риска метаболических нарушений, сердечно-сосудистых заболеваний и остеопороза. Пациентки с отягощенным онкологическим анамнезом находятся в состоянии психологического стресса, который утяжеляет симптомы менопаузы и ухудшает качество жизни. МГТ остается наиболее эффективным методом коррекции климактерических расстройств [5, 6].
Плоскоклеточный рак шейки матки
В клинических исследованиях были получены противоречивые результаты в отношении взаимосвязи экспрессии эстрогеновых рецепторов (ER)α и РШМ. В работе Zhai Y. отмечалась потеря экспрессии ERα в период прогрессирования РШМ (с CIN I и CIN II/III до инвазивной плоскоклеточной карциномы) – с 50, 15 и 3,7% положительных результатов ERα, соответственно. Потеря экспрессии ERα при прогрессировании заболевания указывает на туморсупрессирующую роль эпителиального ERα в канцерогенезе шейки матки [7]. Необходимы дополнительные исследования для формирования более глубокого представления о функциональных молекулярных путях, вовлеченных во взаимосвязи между эстрогенами, ERα и онкогенами ВПЧ.
ПРШМ обычно относят к гормононезависимой опухоли. Литературные данные показывают, что лишь очень ограниченная часть женщин получает МГТ в связи с индуцированной менопаузой [8, 9].
Целью этого систематического обзора является предоставление современной информации о рисках и преимуществах МГТ после перенесенного РШМ/рака эндометрия (РЭ).
В многочисленных работах, выполненных с целью оценки риска РШМ и смертности от него при использовании МГТ, были продемонстрированы обнадеживающие результаты (см. таблицу). В наблюдательном когортном исследовании Persson I. после 13 лет наблюдения пациенток не было обнаружено доказательств неблагоприятного влияния МГТ ни на один из гистологических вариантов РШМ. Широкое проведение биопсии шейки матки у пациенток, получавших МГТ, не отличалось более высоким уровнем выявления РШМ [11].
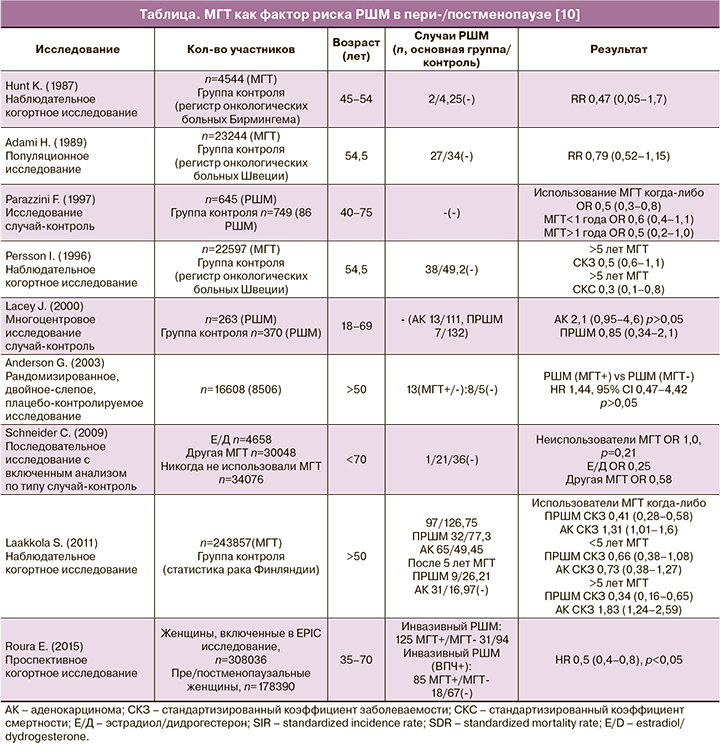
В последующем исследовании риск развития РШМ оценивали у пользователей различной по составу МГТ и сравнивали с группой контроля. Общая популяция исследования состояла из 69 412 женщин в пре- и постменопаузе: 4658 женщин, принимали эстрадиол/дидрогестерон (Э/Д), 30 048 женщин – другие виды МГТ, и 34 706 женщин составили группу контроля. Среднее время наблюдения составило 6,0 лет в основных группах и 5,7 лет для группы контроля. Анализ риска заболеваемости РШМ в зависимости от типа МГТ не выявил статистически значимой разницы между пользователями Э/Д и другими типами МГТ (Э/Д: OR 0,25, 95% ДИ 0,03–2,17; другая МГТ OR: 0,58, 95% ДИ 0,31–1,08) по сравнению с группой контроля [12].
В проспективном исследовании было показано, что у 308 036 женщин МГТ снижает риск инвазивного РШМ (OR 0,5, 05% ДИ 0,4–0,8), особенно в подгруппе плоскоклеточного подтипа вне зависимости от ВПЧ статуса. В работе была установлена слабая обратная взаимосвязь между приемом МГТ и аденокарциномой [13].
За последние 2 десятилетия резко увеличилась частота выявления плоскоклеточных карцином (ПК), связанных с ВПЧ. ПК (ВПЧ+) и ПК (ВПЧ-) отличаются друг от друга гено- и фенотипически с точки зрения их патологических/молекулярных механизмов канцерогенеза и их реакции на терапию. На культуре клеток ПК при ВПЧ положительном статусе пациенток было выявлено, что высокая экспрессия ER ассоциирована с лучшими показателями выживаемости. При обработке культуры клеток (ВПЧ+) эстрогенами отмечалось подавление экспрессии вирусной РНК, транскрипции вирусных генов, а также зафиксирована реактивация опухолевых супрессоров pRb и р53 [14].
Исследование Ploch E. – единственное исследование с анализом влияния МГТ на частоту рецидивов РШМ и общую выживаемость в качестве основного исхода продемонстрировало, что МГТ не влияет на онкологические исходы. В исследование было включено 120 женщин, больных РШМ (стадия I–II по FIGO), получивших хирургическое лечение или путем лучевой терапии. 80 пациенток использовали МГТ, а у 40 (группа контроля), коррекция климактерических расстройств проводилась негормональными средствами. Срок наблюдения составил не менее 5 лет. Анализ связи между МГТ и онкологическими исходами не показал существенной разницы в 5-летней выживаемости и частоте рецидивов между двумя исследованными группами (МГТ по сравнению с контрольной группой: общая 5-летняя выживаемость составила 80% против 65%, частота рецидивов – 20% против 32%). Частота осложнений после лучевой терапии была значительно ниже в группе получавших МГТ в сравнении с контролем. Осложнения после лучевой терапии у пользователей МГТ были менее тяжелыми и имели меньшую продолжительность (пострадиационные осложнения длительностью более 3 лет: 17% против 45%, p<0,01). Авторы пришли к выводу, что МГТ не ухудшает онкологические исходы РШМ и эффективна в контроле климактерических симптомов [15].
Аденокарцинома шейки матки
10–20% случаев РШМ составляют аденокарциномы (АШМ) и их биологическое «поведение» напоминает аденокарциному эндометрия. ER и рецепторы прогестерона (PR) гиперэкспрессированы при АШМ в 30–40% случаев. Однако, в большинстве исследований было показано, что их экспрессия не имеет значимых корреляций с безрецидивной или общей выживаемостью [7, 10]. Большинство эпидемиологических исследований проводилось с целью определения влияния комбинированных гормональных контрацептивов (КГК) на онкологические риски. Относительный риск развития АШМ оказался в 1,5–3,3 раза выше у пользователей КГК, особенно при использовании КГК более 5 лет и у женщин с ВПЧ-положительным тестом [16, 17].
В 2008 г. Frega А. et al. наблюдали пациенток после конизации шейки матки по поводу CIN в течение 5 лет, часть из которых использовали КГК, а другая часть входила в группу контроля. Разницы в риске развития РШМ в исследованных группах обнаружено не было [18].
В работе Lacey J. 24 женщин с АШМ сравнивали со 139 женщинами с ПРШМ и 307 женщин составили группу контроля. Среди пациенток с аденокарциномой – 10,5%, в группе ПРШМ – 5%, а в контрольной группе – 6,5% женщин ранее получали МГТ. Факт использования МГТ в прошлом положительно коррелировал с аденокарциной (OR 2,1, 95% ДИ 0,95–4,6), но не с ПРШМ (OR 0,85, 95% ДИ 0,34–2,1). Однако полученные результаты не достигли статистической значимости даже после поправки на ВПЧ статус (OR 2,0, 95% ДИ 0,39–10,7) [19].
В исследовании Richardson A. проводилась оценка безопасности использования МГТ у пациенток (38,5±6,6 лет), имеющих в анамнезе АШМ (1В–2В стадии). Исследование включало 58 пациенток, которые были разделены на 3 группы: 25 (43,1%) – с сохраненными яичниками (I группа); 20 (34,4%) – с ятрогенной менопаузой, получающих МГТ (II группа); 13 (22,4%) – с ятрогенной менопаузой, не получающих МГТ (III группа). Общая 5-летняя выживаемость в I группе составила 95%, во II – 95%, а в III – 73%. 5-летняя выживаемость без прогрессирования в I группе составила 81%, во II – 90%, в III – 68%. В этом небольшом исследовании МГТ не оказывала отрицательного влияния на выживаемость пациенток, имеющих в анамнезе АШМ. Полученная тенденция к улучшению показателя выживаемости на фоне использования МГТ не была статистически значимой [20].
Другое наблюдательное когортное исследование подтвердило, что частота АШМ увеличивается при использовании МГТ (стандартизированный коэффициент заболеваемости (СКЗ) составил: 1,31, 95% ДИ 1,01–1,67). Кроме того, СКЗ аденокарциномы увеличивался с продолжительностью воздействия МГТ: >5 лет приема МГТ 1,83 (1,24–2,59), >10 лет – 2,72 (1,09–5,59). Однако при увеличении периода приема МГТ более чем 10 лет, повышение уровня заболеваемости АШМ сопровождалось потерей статистической значимости. В исследовании старт МГТ приходился на возраст от 50 лет и старше (до 76 лет).
Циклический режим МГТ, которого придерживались пациентки после 50 лет, был ассоциирован с более распространенными формами аденокарциномы, а непрерывный режим – с более ранними стадиями заболевания на момент постановки диагноза. Непрерывное использование прогестагена сопровождалось замедлением роста АШМ и РЭ. Авторы исследования также отмечают, что у пользователей МГТ чаще проводился скрининг (забор мазка по Папаниколау), чем в основной популяции. Следовательно, частота предраковых поражений шейки матки была выше, а частота инвазивного рака ниже. Кроме того, эталонный уровень заболеваемости рассчитывался на популяцию, в которую также входили женщины с гистерэктомией. Было установлено, что данный факт способствует снижению заболеваемости РШМ на 11% у женщин в постменопаузе [21].
Рак эндометрия
Кандидатами на органосохраняющее лечение при РЭ являются: пациентки с атипической гиперплазией или высокодифференцированной (Grade 1) аденокарциномой эндометрия; если опухоль ограничена эндометрием у женщин с сохраненным овариальным резервом и нереализованной репродуктивной функцией; при условии информированности пациентки о последствиях нестандартного объема оперативного лечения, включая риск возникновения рецидива заболевания [22]. РЭ чувствителен к эстрогенам в 90% случаев (тип I) и является эстроген-независимым только в 10% (тип II). В соответствии с чем, можно было ожидать повышения частоты рецидивов заболевания на фоне использования МГТ; однако исследования, опубликованные за последние десятилетия, не подтверждают данную гипотезу. Несколько небольших наблюдательных исследований последовательно продемонстрировали более высокий уровень безрецидивной выживаемости у пациенток, получавших МГТ, в сравнении с контролем. Исследования были неоднородны по составу включенных пациенток: в большинстве случаев включали пациенток, имевших 2 гистологических варианта РЭ, с I и II стадией. В одном исследовании также включали женщин с III стадией РЭ. Время наблюдения составило 42–87 месяцев. МГТ была представлена либо монотерапией эстрогенами, либо комбинацией эстрогена и прогестагена [23].
Аналогичные результаты были получены в единственном проспективном рандомизированном контролируемом исследовании с участием более 1200 пациенток [24] и мета-анализе с участием почти 900 женщин на МГТ против 1100 человек контрольной группы [25]. В большинстве случаев МГТ назначали через 3–12 месяцев после оперативного этапа лечения. Последний мета-анализ показал, что комбинированная МГТ оказывала защитное влияние в отношении рецидива РЭ (ОШ 0,23; 95% ДИ 0,08–0,66), тогда как монотерапия эстрогенами не сопровождалась подобным влиянием [23]. Необходимо отметить, что эндометрий относительно устойчив к радиации и лучевой терапии. Поэтому при выполнении органосохраняющих операций в рамках консилиума возможно рассмотреть назначение непрерывной комбинированной гормональной терапии, которая не сопровождается увеличением риска рецидива заболевания [23, 26]. Исследований по изучению безопасности МГТ у выживших после эстроген-независимого агрессивного рака эндометрия II типа нами не обнаружено.
Необходимо отметить сходство эндоцервикального эпителия с эндометрием. АШМ с высокой экспрессией ER (39%) относится гормоночувствительным опухолями, однако в исследованиях не было показано влияния рецепторного статуса на онкологические исходы. В настоящее время роль МГТ в канцерогенезе шейки матки с поправкой на рецепторный и ВПЧ статус остается до конца неясной [27, 28]. В имеющихся исследованиях использование МГТ женщинами с положительным ВПЧ-статусом не приводило к дополнительному увеличению риска РШМ [29, 30].
Заключение
Данные, полученные в результате проведенного анализа, не подтвердили связи МГТ с общим риском РШМ. Кроме того, ряд исследований продемонстрировал протективное влияние МГТ в отношении ПРШМ. Единичные исследования подтверждают возможную связь МГТ и АШМ, однако полученные результаты не показали статистической значимости.
У молодых пациенток с преждевременной индуцированной менопаузой преимущества МГТ очевидны. По этим причинам клиницисты должны в первую очередь сосредоточить свое внимание на достижении наибольшего показателя выживаемости с учетом качества жизни пациенток. Необходимы дальнейшие проспективные и рандомизированные исследования для полноценной оценки влияния МГТ на онкологические исходы у выживших после РШМ/РЭ.
При гормонозависимых вариантах РШМ/РЭ у молодых женщин с ятрогенной менопаузой вопрос о возможности использования МГТ должен быть решен в пользу имеющихся преимуществ (снижение риска возраст-ассоциированной патологии и повышение качества жизни) и оценки онкологических рисков после окончания противоопухолевой терапии. В ситуации органосохраняющих операций рекомендуется назначение комбинированной МГТ с целью снижения риска гиперпластических процессов. Возможность назначения МГТ пациенткам с отягощенным онкологическим анамнезом должна обсуждаться в рамках врачебного консилиума в составе онкогинеколога, химиотерапевта и акушера-гинеколога.



