Менопаузальная гормональная и негормональная терапия имеет почти 40-летний опыт использования как в России, так и за рубежом. Одним из наиболее актуальных вопросов как для практикующего врача, так и для пациента является безопасность приема гормональных препаратов, особенно при длительном их использовании [1]. Основной причиной боязни применения гормональной терапии является канцерофобия в силу необъективной оценки рисков и преимуществ [2]. Такое отношение во многом обусловлено результатами исследований HERS (1998 год) и WHI (2002 год), где авторы отмечают увеличение частоты развития рака молочной железы, случаев тромбоэмболии и инсультов у женщин при приеме менопаузальной гормональной терапии. Несмотря на признание результатов данных исследований некорректными, резонанс после сделанных выводов остается и на сегодняшний день [3, 4].
Участие цитокинов в патогенезе онкопролиферативных заболеваний органов репродуктивной системы у женщин постменопаузального возраста доказано рядом исследований и сомнений не вызывает [5–7]. Однако данные о влиянии препаратов менопаузальной гормональной и негормональной терапии на секреторную активность клеток крови и сывороточные показатели провоспалительных и противовоспалительных цитокинов у женщин с климактерическим синдромом противоречивы [8, 9].
Раннее было показано, что в крови женщин, принимающих менопаузальную гормональную терапию, повышается уровень ассоциированного с беременностью α2-гликопротеина (АБГ) – транспортера цитокинов, обладающего выраженными иммуномодулирующими свойствами и являющегося неспецифическим маркером онкопролиферативных процессов в эстрогензависимых органах [10–12].
Цель данной работы заключалась в проведении сравнительного анализа уровней цитокинов (фактор некроза опухоли (ФНО)-α, интерлейкин (ИЛ)-6 и интерферон (ИФН)-γ) в сыворотке крови и в супернатантах клеток периферической крови при использовании препаратов менопаузальной гормональной (1 мг 17β-эстрадиол + 5 мг дидрогестерон) и негормональной (генистеин 60 мг) терапии и изучение корреляционной зависимости их концентраций от сывороточных уровней АБГ.
Материал и методы исследования
Под наблюдением находилось 40 женщин с климактерическим синдромом средней степени тяжести в возрасте 52±0,56 года. Из них 29 женщин принимали менопаузальную гормональную терапию (1 мг 17β-эстрадиол + 5 мг дидрогестерон) для купирования клинических симптомов заболевания. При этом 12 пациенток (I группа) обследованы спустя 3–6 месяцев применения препарата и 17 женщин (II группа) – спустя 2–5 лет. Третья группа была представлена 11 пациентками, принимающими препарат, содержащий генистеин в дозе 60 мг (аналог фитоэстрогена, близкий по составу 17β-эстрадиолу). Группу контроля составили 15 практически здоровых женщин сопоставимого возраста (50±0,7 года).
Для исследования взяты образцы периферической крови. Уровни ФНО-α, ИЛ-6, ИФН-γ в сыворотке крови и в супернатантах клеточных культур определяли методом твердофазного иммуноферментного анализа (ИФА) с использованием коммерческих тест-систем (ЗАО «Вектор Бест», Новосибирск). Концентрацию АБГ в сыворотке крови определяли методом ракетного иммуноэлектрофореза с использованием моноспецифической антисыворотки против данного белка [12].
Оценка функциональной активности мононуклеарных клеток цельной крови в реакции in vitro по суточной спонтанной и митоген-активированной продукции цитокинов (ФНО-α, ИЛ-6, ИФН-γ) проводилась с использованием наборов «Цитокин-Стимул-БЕСТ» и прилагаемых к ним инструкциям. В качестве митогенов использовалась смесь митогенов (2 мкг липополисахарида и по 4 мкг фитогемагглютинина и конканавалина А). Индекс стимуляции (И.С.) рассчитывался отношением концентраций исследуемых цитокинов в митоген-активированных супернатантах к спонтанной продукции.
Статистическая обработка результатов исследования проводилась с помощью лицензионной программы для биостатистики InStat – II (Sigma, США). Применялось парное межгрупповое сравнение показателей по критерию Стьюдента, корреляционный анализ проводился с помощью критерия Пирсона. Проверка нормальности распределения признаков проводилась с использованием критерия Колмогорова–Смирнова.
Результаты исследования
Как показали проведенные исследования, сывороточные концентрации всех изученных цитокинов оставались практически неизменными, не превышали пределов референсных значений здоровых женщин для каждого цитокина и не зависели от вида принимаемого препарата.
Совершенно иная картина наблюдалась при оценке секреторной активности клеток крови (таблица).
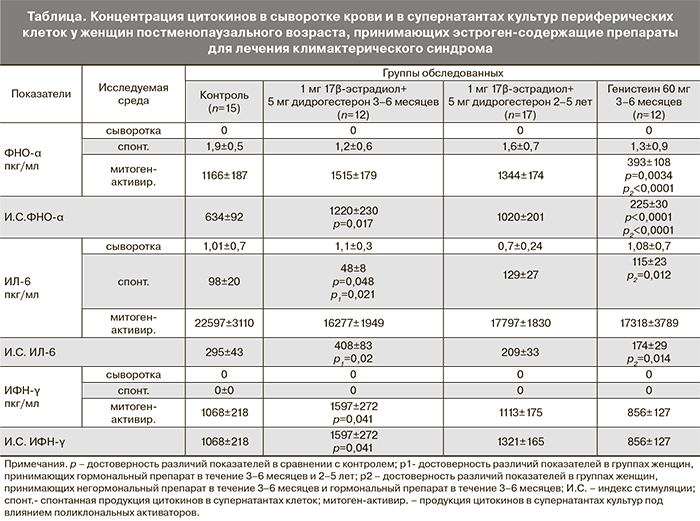
Спонтанная продукция цитокина ФНО-α клетками крови оставалась неизменной, не зависела от вида и длительности использования препарата и не отличалась от контроля. В ответ на стимуляцию поликлональными активаторами продукция данного цитокина изменялась только при приеме негормонального препарата: наблюдалось значимое снижение его концентрации по сравнению как с контрольной группой (р=0,0034), так и с группой женщин, принимающих гормональный препарат в течение 3–6 месяцев (р<0,0001). При этом индекс стимуляции синтеза ФНО-α был значимо ниже у женщин, принимающих генистеин как в сравнении с контрольными значениями (p<0,0001), так и в сравнении с показателями при приеме гормонального препарата в течение 3–6 месяцев (p<0,0001). Первые 6 месяцев приема гормонального препарата сопровождались значимым повышением И.С. ФНО-α, тогда как более длительный прием препарата (2–5 лет) на нем не отражался.
Нами установлено снижение спонтанной продукции ИЛ-6 у женщин, принимающих гормональный препарат не более 6 месяцев, по сравнению с группой контроля (р=0,048), а также по сравнению с коротким курсом приема генистеина (р=0,012) и с длительным приемом гормонального препарата (р=0,021).
Продукция ИФН-γ не активированными клетками (спонтанная) оставалась неизменной, по сравнению с контролем, у всех обследованных женщин независимо от вида препарата и длительности его приема. Митоген-активированная продукция ИФН-γ значимо повышалась лишь в группе женщин, принимающих гормональный препарат в течение 3–6 месяцев, в сравнении с группой контроля (р=0,04). И.С. был также повышен в данной группе обследованных в сравнении с группой контроля (р=0,04).
Таким образом, у женщин, принимающих препарат менопаузальной гормональной терапии в течение 3–6 месяцев выявлены определенные изменения функциональной активности клеток крови, в сравнении с группой контроля: снижение спонтанного синтеза ИЛ-6, увеличение митоген-индуцированного синтеза ИФН-γ, повышение И.С. ФНО-α и ИФН-γ не только в сравнении с контролем, но и с показателями в группе женщин, принимающих данный препарат в течение 2–5 лет.
У женщин, принимающих негормональный препарат в течение 3–6 месяцев, наблюдалась другая динамическая картина. Прежде всего, было установлено отсутствие каких-либо изменений в спонтанном синтезе всех изученных цитокинов относительно контроля. Наряду с этим, было установлено значительное снижение митоген-индуцированного синтеза и И.С. ФНО-α как в сравнении с группой контроля, так и в сравнении с группой женщин, принимавших гормональный препарат в течение 3–6 месяцев.
Прием генистеин-содержащего препарата не отражался на сывороточных уровнях АБГ (0,011±0,009 г/л) и был сопоставим с контрольными значениями (0,013±0,002 г/л). Прием гормонального препарата в течение 3–6 месяцев значимо повышал концентрацию АБГ у 26,3% женщин (0,04±0,003 г/л, р<0,0001), в сравнении с контрольными значениями. Использование гормонального препарата в течение 2–5 лет сопровождалось значимым повышением уровня АБГ у 44% женщин (0,049±0,003, р<0,0001).
Проведение корреляционного анализа между показателями АБГ в сыворотке крови и продукцией цитокинов клетками позволило установить: 1) положительную корреляционную зависимость между уровнем АБГ в крови и продукцией проопухолевого цитокина ФНО-α митоген-стимулированными клетками крови у женщин, принимающих менопаузальную гормональную терапию независимо от длительности использования (r=0,411; р=0,037); 2) отрицательную корреляционную зависимость в тех же группах женщин между АБГ и продукцией ИФН-γ, обладающего противоопухолевой активностью (r= –0,403; р=0,030); 3) отсутствие корреляционных связей между изученными показателями в группе женщин, принимающих генистеин.
Обсуждение
Данные о влиянии менопаузальной гормональной терапии на показатели иммунитета малочисленны и противоречивы. Рядом исследований доказаны иммуномодулирующие и противовоспалительные свойства препаратов менопаузальной гормональной терапии. Наряду с этим есть работы, не выявившие достоверных изменений в показателях клеточного и гуморального иммунитета при приеме менопаузальной гормональной терапии [9, 13, 14]. Установленное нами отсутствие влияния приема гормонального препарата, содержащего 1 мг 17β-эстрадиола и 5 мг дидрогестерона, и негормонального препарата, содержащего 60 мг генистеина, на сывороточные уровни изученных цитокинов (ФНО-α, ИЛ-6, ИФН-γ), подтверждает последнюю точку зрения.
Результаты нашего исследования выявили определенную зависимость функциональной активности клеток периферической крови от вида используемого препарата для коррекции менопаузальных расстройств. Увеличение продукции ФНО-α и ИФН-γ в ответ на стимуляцию в группе женщин, принимающих гормональный препарат и снижение активности синтеза ФНО-α в группе принимающих фитоэстроген в первые 3–6 месяцев приема препаратов, могут быть связаны с тем, что гинестеин, как аналог фитоэстрогенов, проявляет не только эстрогеноподобные свойства, но и антиэстрогенные [15]. Мы полагаем, что эти изменения также являются кратковременной адаптационной реакцией организма на прием экзогенного эстрогенсодержащего препарата либо аналога фитоэстрогенов. И именно поэтому нами не выявлено существенного влияния препарата менопаузальной гормональной терапии на функциональную активность клеток крови при приеме его в течение 2–5 лет.
Полученные нами данные о повышении сывороточных концентраций АБГ на фоне приема менопаузальной гормональной терапии: от 26,3% до 44%, в зависимости от длительности приема препарата, подтвердили более ранние исследования по влиянию препарата, содержащего 1 мг 17β-эстрадиола и 5 мг дидрогестерона, на уровни АБГ в крови женщин [10]. Мы полагаем, что женщины с повышенной концентрацией «белка беременности», обладающего выраженной иммуносупрессивной активностью, могут составлять группу риска по развитию онкопролиферативных процессов эстрогензависимых органов, особенно при длительном использовании препаратов менопаузальной гормональной терапии. Данное предположение основано на ранее полученных результатах, установивших повышенные сывороточные уровни АБГ при раннем рецидиве рака молочной железы и неблагоприятном прогнозе рака яичников [11, 12].
Нами установлено, что стимулированные митогеном клетки крови женщин, длительно принимавших гормональный препарат и имевших повышенную концентрацию АБГ в крови (в 3,8 раза по сравнению с контролем), активнее продуцировали цитокин ФНО-α и слабее ИФН-γ. Учитывая мнение ряда авторов о проопухолевом эффекте ФНО-α и противоопухолевом ИФН-γ [16, 17] мы полагаем, что выявленная корреляционная зависимость между концентрациями белка, обладающего иммуносупрессивными свойствами – АБГ и изученными цитокинами подтверждает общую негативную тенденцию у отдельных индивидуумов с неадекватной чувствительностью к компонентам препаратов и позволяет выделить группу риска онкопролиферации эстрогензависимых органов из числа женщин, принимающих препараты менопаузальной гормональной терапии.
Таким образом, результаты нашего исследования не выявили существенного влияния приема гормонального препарата (1 мг 17β-эстрадиол + 5 мг дидрогестерон) в течение 2–5 лет у женщин с климактерическим синдромом на изучаемые показатели гуморального и клеточного иммунного ответа, что позволяет говорить о безопасности его использования. Наряду с этим, установленная корреляционная зависимость между сывороточным уровнем эстроген-зависимого белка – АБГ, являющегося ранним неспецифическим маркером онкопролиферации и продукцией цитокинов, участвующих в развитии онкопролиферации, позволяет рекомендовать более тщательное наблюдение и контроль за женщинами с повышенной концентрацией данного белка в крови при использовании препаратов менопаузальной гормональной терапии для купирования климактерического синдрома.
Выводы
- Использование препарата менопоузальной гормональной терапии, содержащего 1 мг 17β-эстрадиола и 5 мг дидрогестерона, и негормонального, содержащего генистеин в дозе 60 мг, не влияло на сывороточные показатели некоторых цитокинов (ФНО-α, ИЛ-6 и ИФН-γ) независимо от длительности их применения.
- У женщин, принимающих гормональный препарат в течение 3–6 месяцев, уменьшалась спонтанная продукция ИЛ-6, повышалась митоген-индуцированная продукция ИФН-γ, увеличивался И.С. ФНО-α и ИФН-γ. Прием гормонального препарата в течение 2–5 лет не оказывал влияние на спонтанную и митоген-активированную продукцию исследуемых цитокинов.
- Использование препарата, содержащего генистеин в дозе 60 мг, в течение 3–6 месяцев не изменяло спонтанную продукцию цитокинов клетками, снижало митоген-стимулированную продукцию и И.С. ФНО-α.
- Прием гормонального препарата, содержащего 1 мг 17β-эстрадиола и 5 мг дидрогестерона, в течение 3–6 месяцев сопровождался значимым повышением сывороточной концентрации АБГ, обладающего иммуномодулирующими свойствами у 26,3% женщин и в 44% – при приеме этого же препарата в течение 2–5 лет.
- Установлена корреляционная зависимость между уровнем АБГ в крови и продукцией митоген-индуцированными клетками цитокинов: положительная с ФНО-α (r=0,41; р=0,037) и отрицательная с ИФН-γ (r=-0,4; р=0,03) независимо от длительности приема гормонального препарата, что позволяет выделить группу риска женщин по развитию эстрогензависимых пролиферативных заболеваний.



