Работа частично поддержана Государственным контрактом Министерства образования и науки РФ №16.522.12.2009 от 29.09.2011.
Проблема гиперплазии эндометрия (ГЭ) не теряет актуальности ввиду широкой ее распространенности, ассоциации с маточными кровотечениями и риском малигнизации. Ее решение особенно важно при нереализованной генеративной функции, ввиду неуклонного роста заболеваемости раком эндометрия (РЭ) среди социально активных женщин [1]. По данным National Institute Cancer 7,5% случаев РЭ приходится на возраст до 45 лет [2]. По данным статистики в Российской Федерации за пятилетие (2004–2009 г.) заболеваемость РЭ увеличилась на 17,3%. В структуре злокачественных новообразований у женщин он занимает 2-е место после рака молочной железы (Россия, Белоруссия, Украина) [1].
Течение ГЭ может иметь разнонаправленный характер – от рецидивирования и прогрессирования до спонтанной регрессии, которая наблюдается в 40–60% случаев [3, 4]. Данные информационной базы PubMed свидетельствуют об увеличении публикаций по проблеме ГЭ. Основное внимание уделяется поиску новых информативных диагностических маркеров, исходя из патогенетической роли гиперэстрогении, активации ангиогенеза, дисбаланса процессов пролиферации и апоптоза, молекулярно-генетических и эпигенетических нарушений. Однако надеяться на существование универсального диагностического признака едва ли возможно, об этом свидетельствуют разноречивые результаты исследований. В одних работах указывается на роль потери экспрессии PTEN, мутации генов репарации, нарушения соотношения апоптотического индекса BCL2/BAX [5], в других – на снижение экспрессии COX2 и увеличение экспрессии р16 [6], в третьих отмечается низкая прогностическая значимость всех предложенных маркеров [7]. Вероятно, причиной этих разногласий является многообразие клинических форм ГЭ, что приводит к отсутствию единых международных рекомендаций по тактике ведения больных с ГЭ. Можно полагать, что не во всех случаях оправдана гормонотерапия, в одних своевременно должно проводиться оперативное лечение, в других тактика ведения может быть выжидательной.
На сегодняшний момент в качестве прогностических критериев рассматривается широкий спектр показателей, связанных с разными звеньями патогенеза ГЭ. Однако для практического применения актуально создание интегрального прогностического критерия на основе наиболее значимых предикторов. Такие задачи решаются путем применения статистических методов многофакторного анализа для оценки полученных в эксперименте данных. Этот подход был выбран для достижения поставленной цели.
Цель исследования: на основе наиболее информативных показателей экспрессии мРНК генов, предположительно участвующих в развитии гипер- и неопластических процессов эндометрия, определить вероятность малигнизации различных типов ГЭ.
Материал и методы исследования
Проведено клинико-лабораторное обследование 58 женщин с ГЭ (средний возраст 44,2±4,6 года, индекс массы тела (ИМТ) 28,6±4,6 кг/м2); 59,2% из них находились в репродуктивном возрасте, 40,8% – в пременопаузе. В соответствии с типом ГЭ (по классификации ВОЗ) [8] были сформированы группы: в 1-ю включена 31 пациентка с простой ГЭ (ПГЭ), во 2-ю – 15 с комплексной ГЭ (КГЭ), в 3-ю – 12 с атипической (АГЭ) (во всех случаях комплексной).
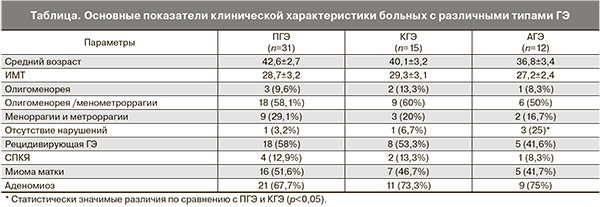
Клиническая характеристика больных по группам представлена в таблице. Как видно, ПГЭ и КГЭ клинически схожи, для них характерны маточные кровотечения, возникающие после задержек менструаций. Существенных различий по возрасту, ИМТ, частоте пролиферативных процессов миометрия не обнаружено (p>0,05). АГЭ по сравнению с ПГЭ и КГЭ выявлялась у женщин более молодого возраста, в каждом четвертом случае не имела клинической манифестации, формировалась на фоне регулярного ритма менструаций (p<0,05). В этих случаях показаниями к проведению гистероскопии и раздельного диагностического выскабливания были результаты ультразвукового исследования или ановуляторное бесплодие.
Для построения статистической модели неопластической трансформации исследовано 16 образцов ткани высокодифференцированной эндометриоидной аденокарциномы эндометрия (ЭА). Средний возраст пациенток в этой группе составил 46,2±2,1 года, 30,8% находились в позднем репродуктивном возрасте, 69,2% – в пременопаузе, средний ИМТ составил 30,1±4,2. Контролем послужили образцы эндометрия фазы пролиферации (n=26) и секреции (n=21), полученные от здоровых женщин репродуктивного возраста без воспалительных заболеваний органов малого таза и внутриматочной патологии. Исследование одобрено этическим комитетом ФГБУ Научный центр акушерства, гинекологии и перинаталогии им. академика В.И. Кулакова Минздрава России.
В качестве маркеров, характеризующих функциональное состояние клеток, были выбраны показатели экспрессии генов, регулирующих пролиферацию и клеточный цикл (MKI67 (KI67), CCNB1, BIRC5, AURKA, MYBL2, CDKN2A (p16), NDRG1), инвазию (CTSL2, MMP11), апоптоз (BCL2, BAX, BAG1), рецепторный фенотип клетки – эстрогеновый (ESR1) и прогестероновый рецептор (PGR), CD68), опухолевую супрессию – PTEN, синтез простагландинов PTGS2 (COX2), ароматазы (CYP19A1), сигнального пептида (SCUBE2).
Измерение уровня экспрессии мРНК вышеперечисленных генов и 4 референсных генов B2M, TBP, GUSB, HPRT1 проводилось методом количественной полимеразной цепной реакции в режиме реального времени с предварительной стадией обратной транскрипции (ОТ-ПЦР) согласно инструкции (ООО «НПО ДНК-Технология», Россия). Взятие материала осуществлялось аспирационной кюреткой пайпель в пробирки со средой для стабилизации РНК (раствор гуанидинизотиоционата). Экспрессию каждого гена определяли в двух повторах с последующим вычислением средних значений пороговых циклов (Cq). Для количественной оценки уровня экспрессии мРНК генов использовали метод сравнения индикаторных циклов (∆ΔСq) c нормировкой по референсным генам и медиане (Ме) значений уровня экспрессии гена в контрольной группе стадии пролиферации, которое было принято за 1.
Статистическая обработка проводилась с помощью SPSS17 Statistics 17.0.
В качестве меры центральной тенденции всех количественных показателей использовали Me, в качестве интервальной оценки – нижний Q1 (25-й процентиль) и верхний Q3 (75-й процентиль) квартили.
Достоверность межгрупповых различий количественных показателей определяли с помощью критерия Манна–Уитни для несвязанных совокупностей, качественных показателей – χ2-критерия с поправкой Йейтса для малых выборок.
Для оценки вероятности неопластической трансформации эндометрия был использован метод регрессионного анализа (бинарная логистическая регрессия). Вероятность события определялась по формуле, где p – вероятность принадлежности к одной из анализируемых групп классификации; z – регрессионная функция, имеющая вид: z = b1×X1 + b2×Х2+ ...+ bn×Хn+ а (2); Х1 ... Хn – уровень экспрессии мРНК генов; b1 ... bn – регрессионные коэффициенты; а – константа.
Выбор наиболее информативных генов и значения регрессионных коэффициентов были получены путем многофакторного анализа.
Результаты исследования
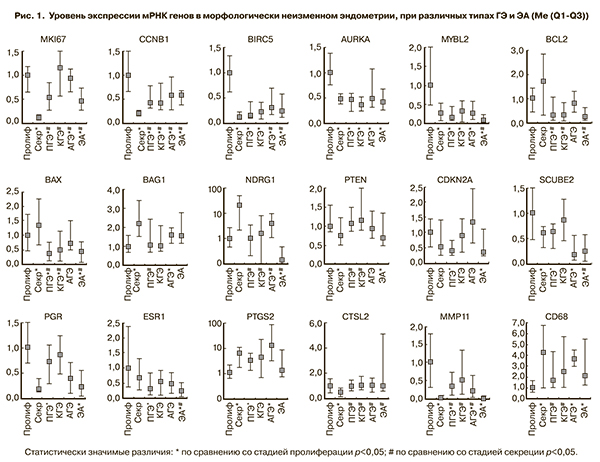
Уровень экспрессии 19 генов, участвующих в регуляции клеточного цикла, пролиферации, апоптоза, рецепторного фенотипа клетки, опухолевого роста и инвазии, представлены на рис. 1.
При оценке маркеров пролиферации и регуляторов клеточного цикла (MKI67, CCNB1, BIRC5, AURKA, MYBL2) выявлена высокая пролиферативная активность в фазу пролиферации и низкая в фазу секреции. Уровень экспрессии MKI67, CCNB1, BIRC5 при ГЭ и ЭА был низким в сравнении с фазой пролиферации и высоким – с фазой секреции. Достоверных различий между разными типами ГЭ и ЭА не обнаружено.
Уровень экспрессии общепринятых маркеров апоптоза BCL2, BAX, BAG1 не различались в фазе пролиферации и секреции. Содержание мРНК NDRG1 (активатора апоптоза) оказалось в 22 раза выше в фазу секреции (p<0,005). Как видно из данных рис. 1, экспрессия мРНК генов BCL2 и BAX при различных типах ГЭ и ЭА существенно не различалась, однако она была несколько ниже, чем в эндометрии стадии пролиферации (p<0,05) и секреции (p<0,005). Экспрессия ингибитора апоптоза BAG1 оказалась сравнимой при ПГЭ, КГЭ и стадии пролиферации. Наблюдалась тенденция к ее повышению при АГЭ и ЭА. В группах ПГЭ и КГЭ экспрессия NDRG1 была сравнима со стадией пролиферации, при АГЭ оказалась выше, чем при ПГЭ, в 3,7 раза (р=0,038), при КГЭ – в 2,4 раза (р=0,22), при стадии пролиферации – в 4 раза (р=0,017). В образцах неопластического эндометрия наблюдалась обратная ситуация – экспрессия NDRG1 была снижена в 7,7–28 раз (р<0,05) в сравнении с разными типами ГЭ (ПГЭ, КГЭ и АГЭ соответственно) и в 7,2 раза (р=0,0022) – с образцами пролиферативного эндометрия. По сравнению с эндометрием стадии секреции при разных типах ГЭ экспрессия NDRG1 была ниже в 5,5–22 раза (р<0,05), а при ЭА – более чем в 150 раз (р=2,3×10–7).
Экспрессия мРНК опухоль-супрессорного гена PTEN не различалась между неизмененным эндометрием и разными типами ГЭ. При ЭА выявлено снижение этого показателя по сравнению со стадией пролиферации, ПГЭ и КГЭ (p<0,05). Не обнаружено циклических изменений локальной экспрессии мРНК гена CDKN2A. Четких различий в экспрессии CDKN2А при ГЭ не выявлено, отмечено снижение при ПГЭ, сопоставимое с ЭА, и отсутствие различий при других типах ГЭ.
Уровень экспрессии мРНК SCUBE2 был ниже в эндометрии стадии секреции в сравнении со стадией пролиферации. При АГЭ и ЭА экспрессия SCUBE2 достоверно снижалась (по сравнению с нормальным эндометрием и ГЭ без атипии).
Наиболее значимые различия установлены в экспрессии мРНК PGR: как между фазами пролиферации и секреции (p<0,05), так и между гипер- и неопластическим эндометрием. Это проявлялось достоверным снижением уровня экспрессии мРНК при АГЭ в 3 раза (p=1,0×10–3) и при ЭА в 3–5 раз (p=4,1×10–6) по отношению к стадии пролиферации и не атипической ГЭ. Уровень экспрессии ESR1 был наиболее низким при ЭА, прослеживалась тенденция к его понижению по сравнению с неизмененным эндометрием при ГЭ независимо от ее типа.
В соответствии с полученными данными экспрессия COX2 – основного фермента синтеза простагландинов была выше в фазу секреции по сравнению с пролиферацией. При ГЭ четкой закономерности не прослеживалось, при ЭА экспрессия оказалась ниже, чем в пробах секреторного эндометрия.
Не выявлено различий в уровне экспрессии мРНК гена ароматазы в нормальном, гиперплазированном и неопластическом эндометрии.
Уровень экспрессии многофункционального гена CTSL2 был сопоставим при различных типах ГЭ, ЭА, стадии пролиферации и в два раза ниже в эндометрии стадии секреции.
Наиболее высокий уровень экспрессии мРНК MMP11 выявлен в фазу пролиферации, наиболее низкий – в фазу секреции и ЭА. Существенных различий между различными типами ГЭ не выявлено.
По сравнению со стадией пролиферации уровень экспрессии мРНК CD68 был в 2–4 раза более высоким в фазу секреции при разных типах ГЭ и ЭА.
Достоверных межгрупповых различий между последними выявлено не было.
Для создания интегрального диагностического критерия ЭА при помощи бинарной логистической регрессии построена следующая статистическая модель (прогностическое решающее правило), включающая уровень экспрессии 5 генов PTEN, PGR, NDRG1, CTSL2, SCUBE2. Уравнение регрессии имело вид: z=4,2×ln[PTEN] – 2,5×ln[PGR] – ln[NDRG1] + 1,7×ln[CTSL2] – 2,4×ln[SCUBE2] – 11. (3), где [PTEN] [PGR] [NDRG1] [CTSL2] [SCUBE2] – уровень экспрессии мРНК соответствующих генов.
На основании полученной функции для каждого образца была рассчитана вероятность наличия неопластической трансформации. Для определения критического значения вероятности (точка cut-off) был выполнен ROC-анализ. Площадь под ROC-кривой составила AUC=0,984±0,16, p<0,0001, что позволило оценить модель как отличную. Результаты классификации пациенток с помощью разработанной модели представлены на рис. 2.
Пороговое значение функции в точке cut-off – 72,3%. Образцы, где рассчитанная вероятность была больше пороговой, оценивались как имеющие признаки неопластической трансформации. Чувствительность и специфичность предложенной модели в области порогового значения составила 93,8 и 100%.
В результате применения разработанного классифицирующего правила 93,8% женщин с морфологически верифицированной ЭА были классифицированы верно. Вместе с тем 19% образцов ПГЭ, 20% КГЭ и 42% АГЭ были оценены как имеющие признаки неопластической трансформации.
Был проведен клинико-анамнестический анализ данных пациенток, классифицированных как имеющие высокую вероятность неопластической трансформации эндометрия. В группе ПГЭ их оказалось 6, в группе КГЭ – 3. У всех женщин была рецидивирующая ГЭ и ожирение различной степени выраженности. Одной из них, не ответивших на многократно проводимую терапию прогестагенами, была произведена гистерэктомия и диагностирована АГЭ. Согласно проведенному математическому распознаванию, было 5 случаев попадания в группу высокого онкогенного риска при АГЭ, в 4 из них была произведена гистерэктомия, по результатам гистологии выявлена ЭА. Одна пациентка 33 лет с рецидивирующей АГЭ находится на терапии левоноргестрел-содержащей внутриматочной системой, учитывая нереализованную репродуктивную функцию.
Обсуждение
В течение последних лет прослеживается тенденция к углубленному изучению молекулярно-генетических основ развития ГЭ, поиску предикторов ее формирования и прогрессии в ЭА. Полученные результаты оказались неоднозначными, что не способствовало решению проблемы. Исследователями из США была проведена оценка более 60 молекулярно-генетических маркеров, лишь три из них были отобраны в качестве прогностически значимых: потеря экспрессии PTEN, мутации гена репарации MSH1, апоптотический индекс BCL2/BAX [5]. В другом исследовании (2011) авторы применили многофакторный анализ для оценки прогностической значимости морфометрического D-показателя (D-score) и 16 молекулярно-генетических маркеров при различных типах ГЭ. Были определены иные показатели прогрессии ГЭ в ЭА: D-показатель<1, снижение экспрессии COX-2 и увеличение экспрессии р16 [6]. В обзоре 2012 г. проводилась оценка экспрессии PGR (изоформы А и Б), PAX2, BCL2 и PTEN. Сделано заключение о прогностической значимости низкого уровня экспрессии обеих изоформ PGR для развития ЭА на фоне АГЭ [9]. Иной взгляд на проблему изложили J.V. Lacey Jr. и соавт., с их точки зрения молекулярно-генетические маркеры, идентифицированные для ЭА (MSI, MSH1, KRAS, b-катенина и др.), едва ли могут рассматриваться в качестве надежных предикторов возникновения ЭА на фоне ГЭ [7]. Свой вклад в решение проблемы внесли и отечественные авторы. Им удалось выделить наиболее информативные клинические характеристики и лабораторные показатели, отражающие метилирование генов-супрессоров опухолевого роста (MLH1, RASSF1, p16, GSTP1, RAR-b, CDX1). На их основе была создана прогностическая модель риска развития РЭ на фоне хронического эндометрита, полипов и ГЭ [10]. Подобный подход был применен в настоящем исследовании. Была протестирована экспрессия 19 предположительно информативных генов, участвующих в регуляции клеточного цикла, пролиферации, апоптозе, инвазии, опухолевом росте. В результате статистического анализа были отобраны 5 показателей: PTEN, PGR, NDRG1, CTSL2, SCUBE2, уровень экспрессии которых был положен в основу созданной статистической модели, применена бинарная логистическая регрессия с последующим ROC-анализом для выбора точки cut-off, обеспечивающей наибольшую суммарную чувствительность и специфичность метода.
Выделение именно этих показателей нам показалось вполне логичным, на них было обращено внимание и других исследователей [5, 9]. На начальном этапе нами выявлено возрастание экспрессии NDRG1 при ГЭ и снижение при ЭА. Функция этого гена до конца не изучена, его относят и к активаторам р53 опосредованного апоптоза [11], и к ингибиторам пролиферации [12]. Не исключено, что длительное снижение NDRG1 может способствовать подавлению механизмов апоптоза и активации клеточной пролиферации. Это играет важную роль в генезе гипер- и неопластических процессов эндометрия [12].
Информативным оказался показатель SCUBE2, снижение его экспрессии выявлено при АГЭ и ЭА. Есть данные о том, что SCUBE2, воздействуя на сигнальные пути β-катенина, подавляет рост опухолевой ткани [13]. В некоторых исследованиях экспрессия SCUBE2 рассматривается в качестве благоприятного прогностического фактора течения рака молочной железы [14]. Не исключено, что подобную роль он играет и в развитии ЭА.
В проведенном исследовании выявлено достоверное снижение экспрессии PGR при ЭА по сравнению с ГЭ без атипии. Это согласуется с результатами ряда других авторов [15, 16]. В обзоре 2012 г. указывается, что именно уровень экспрессии PGR является важным предиктором развития ЭА [9]. Считается, что от уровня экспрессии PGR во многом зависит эффективность терапии прогестагенами [9].
Во многих работах сообщается о патогенетической роли супрессорного гена PTEN в развитии злокачественных новообразований эндометрия [17–19]. Проведенный статистический анализ позволил отобрать уровень экспрессии этого гена в качестве одного из наиболее информативных. Поскольку в большинстве случаев к онкопатологии приводят соматические мутации, велика вероятность генетической неоднородности исследуемой ткани. Учитывая, что большинство клинически значимых мутаций гена PTEN приводят к формированию функционально неактивного гена, оценка уровня экспрессии косвенно отражает интегральную степень повреждении генома эндометрия с учетом мозаицизма.
 Катепсины играют важную роль во многих клеточных процессах: рост, пролиферация, дифференцировка и апоптоз [20, 21]. Уровень катепсина L2 (CTSL2) повышается в злокачественных тканях, например, при раке молочной железы, толстой кишки и других локализаций [22, 23]. Однако при ЭА его роль остается до конца неясной. В нашем исследовании этот показатель, как и вышеперечисленные, оказался одним из наиболее значимых.
Катепсины играют важную роль во многих клеточных процессах: рост, пролиферация, дифференцировка и апоптоз [20, 21]. Уровень катепсина L2 (CTSL2) повышается в злокачественных тканях, например, при раке молочной железы, толстой кишки и других локализаций [22, 23]. Однако при ЭА его роль остается до конца неясной. В нашем исследовании этот показатель, как и вышеперечисленные, оказался одним из наиболее значимых.
Доказано, что информативность нескольких показателей гораздо выше, чем каждого отдельно взятого. Применение многомерных статистических моделей для диагностики и прогнозирования развития заболеваний позволяет интегрировать информативность каждого из показателей в единый прогностический коэффициент. В данной работе предложена статистическая модель на основе уровня экспрессии мРНК 5 генов: PTEN, PGR, NDRG1, CTSL2, SCUBE2. Чувствительность и специфичность предложенной модели в области порогового значения составила 93,8 и 100% соответственно. На ее основе сформированы группы повышенного риска малигнизации эндометрия среди пациенток с ГЭ.
В результате применения разработанного прогностического правила 19% образцов ПГЭ, 20% КГЭ и 42% АГЭ были отнесены в группу ЭА, как и 93,8% женщин с уже диагностированной ЭА. Рассмотрение клинических характеристик пациенток, попавших в группу высокого онкогенного риска, показало, что это схожая и достаточно однородная группа с ожирением и рецидивирующим течением ГЭ. У ряда больных, отнесенных к категории высокого онкологического риска, наряду с АГЭ при гистерэктомии была выявлена ЭА. Можно сделать предварительное заключение, что созданная модель позволяет определить вероятность малигнизации различных типов ГЭ. Понятно, что для непосредственной оценки риска необходимо длительное динамическое наблюдение за обследованными пациентками для учета случаев возникновения ЭА. Важным этапом оценки прогностических возможностей модели является также ее проверка на контрольной группе пациенток, которые не использовались для построения данного правила. В настоящее время ведется работа в этом направлении.
Заключение
В результате проведенного исследования отобрана группа генов, предположительно участвующих в развитии гипер- и неопластических процессов эндометрия. Применены объективные математические критерии, позволившие оценить информативность и выделить наиболее значимые из них: PTEN, PGR, NDRG1, CTSL2, SCUBE2. На их основе предложена статистическая модель в виде линейного уравнения, дающая возможность объективно определить группу пациенток, имеющих экспрессию мРНК, характерную для ЭА. Данная группа пациенток (предположительно повышенного онкологического риска) заслуживает особого внимания, диагностического мониторинга, модификации факторов риска, проведения длительной адекватной гормонотерапии или оперативного лечения.