Эпидемиология рака шейки матки
По данным CDC (Центр контроля и предотвращения распространения заболеваний, США) за период 2004–2008 гг., каждый год регистрируется около 33 300 ВПЧ (вирус папилломы человека)-ассоциированного рака [1]. Ежегодно диагностируется 21 300 случаев ВПЧ-ассоциированного рака среди женщин и около 12 100 – среди мужчин. Рак шейки матки (РШМ) является наиболее распространенной формой ВПЧ-ассоциированного рака у женщин. В мире ежегодно регистрируются 470 000 новых случаев РШМ, 233 000 из которых заканчиваются смертельным исходом. Так, в США в 2012 г. зарегистрировано 12 340 новых случаев РШМ, в мире – 528 000, а в России – 15 051 случаев [2]. РШМ является четвертой наиболее распространенной формой рака у женщин и седьмой в целом. В 2013 г. в США зарегистрировано 12 340 новых случаев РШМ, около 4030 женщин умерли от него. Заболеваемость РШМ в странах Европы различна, так в странах восточной Европы она выше в 2–5 раз, чем в первоначальных 15 государствах Европейского Союза. Эти различия в значительной степени обусловлены наличием или отсутствием программ профилактики РШМ в стране. Отсутствие эффективных моделей прогнозирования исхода РШМ, делает затруднительным определение индивидуальных протоколов лечения пациенток.
Патогенез предраковых заболеваний и РШМ
ВПЧ-инфекция начинается с внедрения вирусных частиц в недифференцированные базальные эпителиальные клетки через ссадины или раны. Амплификация внехромосомной вирусной ДНК и экспрессия капсидных белков происходят последовательно в средних и поверхностных клетках многослойного плоского эпителия [3]. Стойкое, активное заражение ВПЧ высокого риска (ВПЧ ВР) может привести к аномальному увеличению глубины пролиферативной активности в многослойном плоском эпителии шейки матки, то есть к цервикальной интраэпителиальной неоплазии (CIN) 1-й, 2-й или 3-й степени [4].
Гистологически, зона аномально пролиферирующих клеток при CIN 1 ограничена по глубине 1/3 эпителия. CIN 2 и CIN 3 отличаются проникновением в более глубокие слои эпителия: на 2/3 его глубины (CIN 2) и глубже (CIN 3). CIN 2 и CIN 3 развиваются у 10–20% женщин с CIN 1.
Когда неопластические процессы затрагивают подлежащую строму, CIN 3 превращается в инвазивный РШМ [5].
Патогенетической основой вирус-индуцированного онкогенеза является интеграция вирусной ДНК в хромосому инфицированных клеток с активным синтезом онкобелков Е6 и Е7, которые нарушают нормальный процесс дифференцировки клеток [6]. Два вирусных онкобелка – E6 и E7, продуцируемые ВПЧ ВР, дестабилизируют, соответственно, два основных клеточных белка-супрессора опухолей: р53 и белок ретинобластомы (Rb). Установлено, что онкобелок Е6 вызывают деградацию белков-супрессоров генов р53 и ВАХ, предотвращение апоптотических процессов, деградации тирозинкиназы, активации теломеразы и подавление выработки интерферона. Е7 взаимодействует с продуктами гена-супрессора Rb105 и способствует высвобождению транскрипционного фактора Е2F, стимуляции клеточной пролиферации, синтезу р16INK4a. Оба вирусных белка функционируют в продуктивную фазу инфекции в постмитотических дифференцированных шиповатых клетках, однако вторичное повышение экспрессии Е6 и Е7 в недифференцированных базальных или стволовых клетках нарушает регуляцию клеточного цикла, подавляет клеточную дифференцировку, вызывает повреждения хромосом и предотвращает апоптоз, в результате чего клетки эпителия преобразуются в клетки РШМ [7, 8]. Итак, экспрессия ВПЧ ВР онкобелков Е6 и Е7 с течением времени приводит к РШМ [5].
Диагностика предраковых заболеваний и РШМ
Мазок с шейки матки на онкоцитологию по Папаникалау (ПАП-тест), разработанный Джорджем Папаникалау в 20-х годах ХХ в., значительно снизил уровень заболеваемости РШМ. Однако ограничения, связанные с точностью метода и выявлением особенностей каждого отдельного случая, привели к необходимости поиска особых биомаркеров дисплазии клеток плоского и железистого эпителия шейки матки. Ученые надеются, что эти биомаркеры можно будет использовать вместе с обычными массовыми обследованиями женщин с целью профилактики злокачественных заболеваний шейки матки, обусловленных ВПЧ-инфекцией.
Принцип скрининга РШМ базируется также на обнаружении персистенции ВПЧ, что впервые было описано C.J. Meijer и соавт. в 1992 г. [9]. Распространенность ВПЧ коррелирует с увеличением частоты CIN. Результаты исследований показали, что неопластические процессы шейки матки всегда связаны с длительной персистенцией ВПЧ ВР, в связи с чем был предложен скрининг РШМ, основанный на обнаружении ВПЧ. Убедительные доказательства прогностической ценности определения ВПЧ были представлены в результатах 10-летнего наблюдения 20 810 женщин: CIN 3 развились у 17,2% женщин с ВПЧ 16-го типа, у 13,6% с ВПЧ 18-го типа (отрицательных на ВПЧ-16), и только у 0,8% ВПЧ-отрицательных обследуемых [10]. Тем не менее, существует мнение, что ВПЧ-инфекция сама по себе недостаточна для развития злокачественных изменений. Необходимы генетические факторы, которые играют важную роль в прогрессировании CIN и развитии РШМ. Канцерогенез характеризуется молекулярно-генетическими изменениями, которые могут стать прогностическими и диагностическими маркерами прогрессирования процесса и основой для создания новых тестовых систем для скрининга.
N. Murphy и соавт. в 2005 г. исследовали 3 потенциальных биомаркера CIN: p16 (INK4A), CDC6 и MCM5 [11]. Самым надежным из них оказался p16 (INK4A), уровни экспрессии которого изменялись при всех видах плоскоклеточных и железистых поражений шейки матки и были тесно связаны с высоким риском ВПЧ-инфекции. Однако неспособность p16 (INK4A) к избирательному выявлению CIN 3 и сообщения о его гиперэкспрессии в доброкачественных железистых образованиях, таких как метаплазия эндометрия, значительно понизили его шансы стать самостоятельным тестом для прогноза развития РШМ из дисплазии шейки матки.
Результаты исследования p16 (INK4A) R. Klaes и соавт. [12] показали, что использование данного биомаркера для диагностики CIN может значительно снизить количество сомнительных цитологических мазков при скрининге и помочь в постановке диагноза и оценке прогноза течения ВПЧ-инфекции. Вместе с тем в отечественной литературе есть только единичные работы по изучению особенности маркера в клетках РШМ, и совсем нет работ, отражающих его уровень при разных стадиях CIN в комплексе с другими молекулярными маркерами, что могло бы стать основой для применения его в качестве предиктора малигнизации.
Для диагностики и прогнозирования течения ВПЧ-инфекции и неопластических процессов изучаются различные молекулярно-генетические маркеры, в том числе и микро-РНК (миРНК), которые могут иметь важное клиническое значение. Проведенные исследования показали, что миРНК функционирует в качестве важного компонента естественной защиты клетки от вирусной инфекции. В настоящее время известны физиологические функции и гены-мишени большинства миРНК, однако их роль в прогнозировании течения неопластических процессов шейки матки и РШМ практически не изучена и представляет большой интерес с научной и практической точки зрения.
Микро-РНК
МиРНК была впервые открыта в 1993 г. в нематоде Caenorhabditis elegans и охарактеризована как маленькая, некодирующая РНК-молекула, регулирующая белковую экспрессию гена lin-14 [13, 14]. А несколько лет спустя в С. Elegans была обнаружена вторая миРНК (let-7) [15].
Эти два открытия миРНК побудили продолжать исследования по открытию новых миРНК, и вскоре был охарактеризован большой класс малых некодирующих РНК с разнообразным спектром биологических функций, таких как регуляция клеточного цикла, пролиферации и гибели клеток, гематопоэза и канцерогенеза [16, 17].
МиРНК представляют собой 22–25-нуклеотидные некодирующие РНК, контролирующие экспрессию генов у многоклеточных животных, растений, вирусов и бактерий, как правило, на транскрипционном и посттранскрипционном уровне. До настоящего времени были обнаружены и изучены более 700 миРНК. Анализ данных литературы показал, что некоторые миРНК регулируют процесс канцерогенеза. Предполагается, что они играют важную роль в биологии стволовых клеток, ангиогенезе, эпителиально-мезенхимальной трансформации и метастазировании. МиРНК продемонстрировали свой потенциал в качестве диагностических опухолевых маркеров достаточно давно, когда было показано, что их профили коррелируют с опухолями эмбрионального происхождения [18].
В различных моделях канцерогенеза профили экспрессии миРНК связывались с клиническим исходом за счет их способности модулировать такие процессы, как прогрессирование опухоли и ее метастазирование. Методы количественного определения миРНК, такие как гибридизация in situ или полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР) в режиме реального времени, могут позволить использовать миРНК в качестве диагностических и прогностических маркеров онкологических заболеваний [19].
миРНК в патогенезе и диагностике рака
Развитие рака связано с комбинированным действием опухолевых супрессоров и индукторов. МиРНК может рассматриваться в качестве нового класса онкогенов и генов-супрессоров опухолей. При повышеной экспрессии в опухолях миРНК, как полагают, функционируют как онкогены (онко-миРНК). Эти миРНК подавляют гены-супрессоры опухолевого роста, которые контролируют дифференцировку клеток или апоптоз и тем самым способствуют развитию опухоли. Другие миРНК проявляют сниженную экспрессию в раковых клетках и рассматриваются как гены-супрессоры опухолей [20].
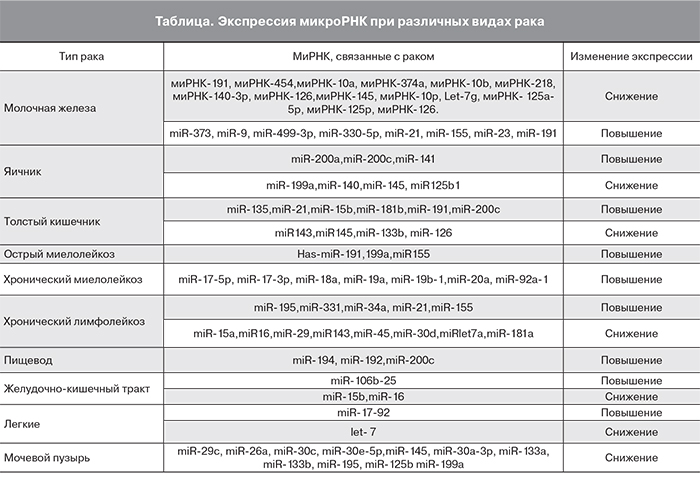
Выявление миРНК, уровни экспрессии которых различаются в опухолевых и нормальных тканях, может помочь идентифицировать те миРНК, которые вовлечены в онкогенез и в результате создать диагностическую прогностическую панель, а также предложить новые терапевтические агенты. Например, при раке молочной железы, уровень miR-125b, miR-145, miR-21 и miR-155 значительно снижен в опухолевых тканях по сравнению с нормальными тканями [21]. При раке молочной железы нарушения регуляции miR-145 и miR-121 связаны с прогрессированием опухолевого процесса, в то время как экспрессия let-7 связана с повышением риска метастазирования в лимфатические узлы и указывает на потенциальную роль этой миРНК в качестве диагностического биомаркера. miR-155 и miR-21 также были предложены в качестве биомаркеров для диагностики рака легких [22]. При колоректальной неоплазии (рак толстой кишки) также обнаружены характерные изменения в экспрессии миРНК. Значимым стало последовательное снижение экспрессии двух миРНК (miR-143 и miR-145), что наблюдалось на аденоматозной и раковой стадиях колоректальной неоплазии [23]. Профили экспрессии миРНК значительно разнятся при различных типах опухолей, что указывает на их диагностический и прогностический потенциал (таблица) [18, 24, 25].
Таким образом, открытие новых миРНК сможет изменить картину генетики опухолевого процесса. Различные миРНК могут быть ассоциированы с развитием различных видов новообразований, служить фенотипическими признаками различных стадий онкопатологии и применяться в диагностике, прогнозировании развития предраковых процессов и рака.
Методы анализа миРНК
Основные методы, в настоящее время используемые для анализа миРНК – это секвенирование, микроматричный анализ и подход, основанный на ПЦР в режиме реального времени. Материал, используемый для этих исследований, представляет собой свежезамороженные образцы ткани, требующие особых условий хранения, а также фиксированные в формалине и залитые парафином (ФФЗП) образцы [26]. Как правило, ткани состоят из клеток разных типов, каждый из которых обладает определенным профилем генной экспрессии. Для чистоты эксперимента при профилировании гетерогенных образцов опухоли следует рассортировать клеточные линии опухоли и отдельные клеточные типы, которые могут присутствовать в образце опухоли, или определять клеточную локализацию миРНК методом гибридизации in situ.
Роль миРНК в прогнозировании неопластических процессов шейки матки
По данным многочисленных исследований, уровни экспрессии некоторых миРНК использованы для прогнозирования исходов таких видов рака, как рак легких и рак молочной железы. Однако на сегодняшний день мало данных о возможности использования миРНК в прогнозировании течения предрака и РШМ. Одним из препятствий в исследовании биомаркеров РШМ является небольшой объем опухолевых тканей, так как большинство цервикальных биоптатов имеют малый размер. Кроме того, большинство препаратов тканей РШМ хранятся в виде ФФЗП, что приводит к серьезной деградации РНК в опухолевых клетках. Все это сильно осложняет профилирование экспрессии миРНК в тканях РШМ. Для решения этой проблемы был разработан новый метод определения профилирования экспрессии миРНК на основе ПЦР, превосходящий по чувствительности и специфичности традиционные методы профилирования [27]. Этот новый метод также успешно применяется для профилирования незначительного количества РНК в клинических образцах очень низкого качества [27]. В работе ряда авторов данный метод был применен для профилирования миРНК ФФЗП-образцов РШМ с целью идентификации миРНК, с целью прогнозирования выживаемости при РШМ. Кроме того, прогностическая ценность миРНК при РШМ была подтверждена при исследовании контрольных ФФЗП и быстро замороженных образцов. Таким образом, предложена новая перспективная стратегия выявления пациенток с высоким риском неблагоприятного исхода при РШМ и требующих индивидуального подхода в лечении.
Группой исследователей было высказано предположение, что miR-200a, является ведущим регулятором нескольких онкогенов и может играть важную роль в развитии РШМ. Результаты недавних исследований показывают, что миРНК семейства miR-200 препятствуют процессу эпителиально-мезенхимального перехода (который рассматривается как важный шаг, инициирующий метастазирование опухоли), непосредственно снижая экспрессию E-кадгерин-транскрипционных репрессоров ZEB1 и ZEB2 [27–29].
Кроме ZEB1 и ZEB2, были определены и другие гены-мишени miR-200a, участвующие в процессе метастазирования РШМ. В частности, TGFβ2 (трансформирующий фактор роста β2) повышает скорость метастазирования разнообразных видов рака [30, 31]; EXOC5 (компонент 5 экзоцистового комплекса) участвует в системе ремоделирования актинового цитоскелета и играет важную роль в биогенезе полярности поверхности эпителиальной клетки [32]. Данное исследование также показало, что miR-200a также может влиять на гены, которые обусловливают метастатический потенциал клеток РШМ. Таким образом, miR-200a может потенциально выступать в качестве базового супрессора метастазирования РШМ. Так, при гиперэкспрессии miR-200a подвижность клеток РШМ значительно снижалась. Следовательно, одной из потенциальных стратегий противоопухолевого лечения могут быть манипуляции с экспрессией miR-200a. Можно ожидать, что введение miR-200a станет перспективной новой стратегией лечения РШМ. Аналогичные исследования, проведенные раннее, показали, что введение с терапевтической целью miR-26a и miR-31 подавляет опухолевый процесс при раке печени и раке молочной железы, соответственно [33, 34].
B.H. Li и соавт. была подтверждена роль miR-100 в цервикальном канцерогенезе у пациенток с CIN и РШМ [35]. Экспрессия белка PLK1 отрицательно коррелировала с экспрессией miR-100 у пациенток с CIN3, в то время как вирусные онкобелки E6/E7 не оказывали прямого влияния на регуляцию и экспрессию миРНК. Таким образом, экспрессия miR-100 влияет на клеточную пролиферацию, апоптоз и уровень белка PLK1 у пациенток с CIN [35].
В ряде исследований [36–38, 39] были получены противоречивые результаты: оба вирусных онкобелка (E6 и E7) изменяли экспрессию miR-92, но для сверхэкспрессии miR-25 достаточно одного онкобелка E7. Проведенный анализ исследований показал, что миРНК 25, 27, 92а и 378 являются онкогенными, а миРНК 16, 22, 29, 100 подавляют опухолевый процесс, так как изменение их экспрессии происходит под влиянием белков р53, E2F и c-Myc [39, 40–42]
В медицинском центре по исследованию рака ученные, используя микроматричный анализ, провели сравнительную оценку профилей миРНК кератиноцитов влагалища у пациенток с ВПЧ-инфекцией [40]. При наличии ВПЧ высоко онкогенных типов отмечалось изменение профилей экспрессии ряда миРНК. Путем использования нозерн-блотинга авторы потвердили нарушение экспрессии miR-16, -25, -22 и -29 в кератиноцитах влагалища у пациенток с высоко онкогенными типами ВПЧ. Изменение экспрессии miR-25, -22, -92а и -29а более чем 1,5 раза позволило предложить их в качестве диагностического маркера CIN различной степени тяжести и РШМ.
МиРНК могут выступать в качестве как онкогена, так и онкосупрессора, что позволяет предложить их в качестве биомаркеров для ранней диагностики предраковых заболеваний и рака [43–47]. Нарушение регуляции экспрессии miR-9, -127, -145, -146a, -199a, -200a и -886-5p может быть связано с развитием ВПЧ-ассоциированных заболеваний шейки матки (CIN, РШМ) [45–55]. Кроме того, у 171 пациенток с CIN было выявлено снижение экспрессии miR-218 по сравнению с контрольной группой (отсутствие ВПЧ). Повышенная экспрессия miR-375 способствовала подавлению пролиферативной активности клеток и последующему переходу опухоли в стадию in situ [51]. J.H. Li и соавт. [52] пришли к выводу, что повышенная экспрессия miR-5p и miR-127 связана со снижением экспрессии белка BAX, апоптозом и усиленной пролиферацией атипических клеток у пациенток с персистенцией ВПЧ 16-го типа. Повышение экспрессии miR-127 у 31 пациенток с РШМ на ранней стадии также ассоциировано с метастазированием в лимфоузлы (p=0,006).
X. Hu и J.K. Schwarz [49] проанализировали 102 случая РШМ и предложили использовать модель логистической регрессии на основе miR-200a и miR-9 для предсказания исхода лечения. Трансфекция miR-200a в клетки HELA способствует регуляции некоторых генов, связанных с метастазированием, таких как Е-кадгерин-транскрипционные репрессоры ZEB1 и ZEB2 [27–29]. Кроме того, миРНК семейства miR-200 могут блокировать перемещение и миграцию раковых клеток и распространение метастазов опухоли.
Для определения роли миРНК в патогенезе РШМ был проведен микроматричный анализ 924 тестовых образцов миРНК из биоптатов РШМ и прилежащих здоровых тканей у 13 пациенток [28]. Было выявлено достоверное повышение экспрессии miR-18 и значительное снижение экспрессии miR-19. Результаты исследования продемонстрировали, что экспрессия этих миРНК не связана с метастазированием в лимфатические узлы, инвазией сосудов и гистологической дифференцировкой опухоли.
Таким образом, анализ данных литературы позволил нам выделить миРНК, экспрессия которых изменяется при ВПЧ-ассоцированных заболеваниях шейки матки (CIN, РШМ): miR-22, -27а, -29а, -100, -25, -92а, -378, -16, -141, -143, -145, -122, -199а, -504. Для определения роли миРНК в патогенезе ВПЧ-ассоциированных заболеваний шейки матки необходимы дальнейшие исследования с увеличением статистической выборки, которые помогут выделить миРНК, непосредственно ассоциированные с неопластическими процессами и РШМ и приведут к разработке новых подходов к ранней диагностике, прогнозированию течения процесса и ведения больных.
Заключение
На сегодняшний день миРНК прочно закрепились как мощные посттранскрипционные регуляторы экспрессии генов, способные одновременно модулировать ряд генов-мишеней. С тех пор как в исследованиях C. elegans были открыты первая миРНК lin-4 и явление интерференции РНК, наши знания о механизме и патогенетической роли миРНК-опосредованной регуляции генов растут в геометрической прогрессии. Хотя мы все еще далеки от четкого понимания ролей различных миРНК в модуляции специфических клеточных процессов, ясно, что функции миРНК в патогенезе заболеваний, а также механизм их действия могут изменяться при различных патологических процессах. Последние исследования показали, что существуют различные профили экспрессии миРНК в тканях при неопластических процессах и вирусных поражениях. Появились убедительные данные о связи дисрегуляции миРНК с возникновением и развитием рака, возможно, за счет модуляции апоптоза, метастазирования, трофики злокачественных клеток, а также предложено использование миРНК в диагностике, прогнозировании и лечении рака [56].
Нарушение регуляции миРНК в тканях может играть важную роль в онкогенезе РШМ, потому исследования миРНК в качестве как прогностического фактора, так и терапевтической опции РШМ, остаются чрезвычайно актуальными. Не менее актуальным является изучение профилей экспрессии миРНК для прогнозирования течения неопластического процесса шейки матки и выявления корреляции между степенью тяжести CIN, ВПЧ-нагрузкой и уровнем указанных маркеров в динамике наблюдения.



