Белки и пептиды являются природными химическими биополимерами, играющими важнейшую роль в функционировании организмов. Исследованием структуры и функций белков занимается недавно возникшая наука – протеомика. Белки в организме подвергаются посттрансляционному модифицированию, таким образом, многообразие белков в организме превышает количество кодирующих их генов на несколько порядков. По этой причине идентификация белков и пептидов является значительно более сложной задачей, чем идентификация генов. В геномике разработаны разнообразные методики мультиплицирования молекул ДНК, однако нет возможности мультиплицирования белков, что значительно повышает требования к чувствительности анализа.
Метод масс-спектрометрического анализа является одним из старейших физических методов анализа веществ, обладает высокой чувствительностью и специфичностью. Открытие новых методов недеструктивной ионизации больших биомолекул, включая ДНК, РНК, белки и пептиды, позволило масс-спектрометрии стать одним из основных инструментов молекулярной биологии и биохимии, в том числе в протеомных исследованиях биологических жидкостей сложного гетерогенного состава (кровь, моча, слюна, спинномозговая жидкость, тканевые экстракты и др.).
Моча представляется исключительно удобным объектом для протеомного исследования благодаря неинвазивности методики сбора и большим объемам анализата, что позволяет повторять отбор образцов много раз и в течение длительного времени. Несмотря на то что исследованию белкового состава мочи посвящено множество работ [1–9], на данный момент отсутствуют стандартизированные подходы сбора и протеомного анализа мочи беременных. Лишь небольшая часть исследований протеома мочи имеет отношение к изучению физиологических закономерностей формирования ее белкового состава в силу ограничения доступа исследователей к биологическим образцам здоровых лиц. Чаще всего в качестве «контрольных» групп в исследованиях, посвященных поискам маркеров (или созданию диагностических «панелей» белковых маркеров) различных заболеваний, используются группы пациентов с исключенным диагнозом основного изучаемого заболевания, которые не могут быть отнесены к категории здоровых индивидуумов. Таким образом, целью данной работы стало получение экспериментальных данных о протеоме мочи беременных при физиологической беременности для повышения диагностической значимости выявляемых в моче маркеров различных заболеваний. В рамках данной задачи нами разработан протокол выделения белковых экстрактов из проб мочи. Для этого стандартизированы процедуры первичного отбора проб мочи у пациенток и процедура экстрагирования белковых смесей из проб мочи. Процедуры сбора мочи/выделения белка разрабатывались с целью минимизировать время анализа при сохранении достаточно высокого (несколько сотен) количества белков для последующего проведения сравнительного скрининга.
Материал и методы исследования
Белок выделялся из образцов согласно протоколу пробоподготовки, разработанному нашей группой для мочи небеременных женщин и здоровых мужчин [8]. Пробы мочи анализировались на базе нанопоточного высокоэффективного жидкостного хроматографа (нано-ВЭЖХ, nano-HPLC) Agilent 1100 (Agilent, США) и масс-спектрометра FinniganLTQ FT (ThermoElectron, Бремен, Германия). Комбинация высокоточного ИЦР (ион-циклотронного резонанса) масс-спектрометрии [9] и высокоэффективной жидкостной хроматографии дает возможность реализовать метод быстрого протеомного скрининга методом AMT (точной массовой метки и времени хроматографического удержания) [8, 10, 11]. Объем вводимой на колонку пробы составлял 1 мкл образца, использовалась колонка 75 мкм×12 см с фазой Reprosil-PurBasic C18, 3 мкм (Аммербух-Энтринген, Германия), изготовленная в лаборатории. Проводилась градиентная хроматография с линейным увеличением относительного содержания растворителя B в потоке от 3 до 50% за 40 минут (растворитель А: 0,1% муравьиной кислоты, растворитель В: 0,1% муравьиной кислоты). Масс-спектрометрический анализ фракций пептидов после трипсинолиза осуществляется при помощи программы Xcalibur (ThermoElectron, Бремен, Германия) в 2-стадийном режиме автоматического измерения спектров. На первом этапе в ИЦР масс-спектрометре ИЦР измерялись точные массы пептидов (m/z 300–1600, R=50000 для m/z 400, число ионов в ячейке ИЦР 5×106), затем из ИЦР масс-спектра выбирались четыре максимальных пика с динамическим исключением, для которых производилась столкновительно-индуцированная фрагментация (CID).
Поиск и идентификация белков проводился по базе данных IPI-human (версия 3.82; 06.04.2011) при помощи программы Mascot (MatrixScience, Лондон, Великобритания; version 2.0.04). Считалось, что белок достоверно идентифицирован, если для него нашлось более 2 пептидов (Score>24). Обнаруженные белки и пептиды валидировались с использованием программы Scaffold 4.0 (версия Scaffold-01_07_00, ProteomeSoftwareInc., Portland, OR). Считалось, что пептид идентифицирован верно, если вероятность его определения была более 95,0% согласно алгоритму PeptideProphet [12]. Считалось, что для надежной идентификации вероятность определения белка должна быть более 99,0% согласно алгоритму PeptideProphet [13].
Клинические характеристики пациенток
Образцы мочи пациенток были получены в ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России. Предварительно процедуры и методики исследований были рассмотрены Комиссией по биомедицинской этике при ГНЦ РФ ИМБП РАН и ФГБУ НЦАГиП им. академика В.И. Кулакова. От пациенток, принимавших участие в исследовании, получено письменное информированное согласие в соответствии с Хельсинской декларацией прав человека. При отборе пациенток контрольной группы исключали пациентов с заболеваниями почек, мочевыводящих путей, артериальной гипертензией, диабетом, предшествующим лечением диуретиками. Следует отметить однородность контрольной группы по возрастному, этиологическому критериям, уровню жизни и индексу массы тела.
Влияние параметров сбора мочи
Для стандартизации протокола сбора мочи были отобраны образцы мочи 10 небеременных женщин в возрасте от 24 до 34 лет. При этом варьировали время сбора (первая, вторая утренняя моча, произвольная проба в течение дня), время хранения пробы на льду до предварительной обработки пробы. Исследования проводились в течение двух недель, сбор проб проводился каждый день. Так как контроль времени сбора мочи и времени нахождения мочи в комнатных условиях до начала процедур предварительной обработки важен, то этот параметр отслеживался специально. Не позднее чем через 30 минут образцы передавались в лабораторию для первичной обработки. При данном предварительном исследовании мы показали, что наиболее воспроизводимыми являются образцы второй утренней мочи. Несмотря на то что первая утренняя моча имеет высокую клиническую значимость, ее высокая вариабельность, видимо, связана с повышенным уровнем белка и солей по сравнению с другими пробами. После выбора второй утренней мочи как объекта исследования мы проанализировали влияние времени хранения мочи на льду на воспроизводимость результатов (от 5 до 30 минут). Оказалось, что даже небольшое отклонение (в 5 минут) значительно изменяет результаты анализа (количество белков и их состав), что может быть объяснено действием протеаз в моче и соответственной деградацией белков. Выбирали 20 минут в качестве рекомендуемого времени хранения образца на льду до предварительной обработки.
В двух независимых исследованиях Schaub и соавт. [1] и Theodorescu и соавт. [2] было показано, что протеом мочи не подвергается существенным изменениям при хранении образцов мочи в течение трех дней при 4°C или в течение шести часов при комнатной температуре соответственно. По-видимому, это говорит о том, что белки мочи относительно более устойчивы к действию неблагоприятных факторов (таких как протеазы, окисление бактериями), чем белки сыворотки или плазмы. Группа G. Candiano показала, что под действием протеаз, присутствующих в моче, альбумин и антитрипсин расщепляются на более чем 100 фрагментов [3]. Таким образом, в ходе пробоподготовки мочи необходимо учитывать возможное действие протеолитических ферментов и, соответственно, производить операции с мочой при 4°C или добавлять в образец ингибиторы протеаз. Кроме того, могут наблюдаться существенные изменения в протеоме мочи в течение дня, наиболее вероятно в результате изменений в диете, а также вследствие циркадных ритмов гормональной активности [4]. Были показаны также ясные различия в составе протеома между первой и средней частью фракции, отделяемой при мочеиспускании [5].
Разработка методики сбора мочи беременных женщин
Для стандартизации протокола сбора мочи беременных для последующего протеомного анализа были отобраны образцы мочи 10 женщин на 15–17-й неделе беременности в возрасте от 23 до 35 лет, с нормально протекающей беременностью, с общим содержанием белка в моче не выше 100 мкг/мл (отсутствие протеинурии). В ходе исследования показана корректность использования ранее разработанного протокола для небеременных женщин. Однако специфика исследуемой группы (беременные женщины) требует сбора мочи с помощью катетера (средняя струя). Использование катетера позволяет исключить попадание бактериальной флоры влагалища в мочу и ухудшение результатов анализа. Таким образом, для достижения указанных целей может быть применена в том числе инвазивная методика сбора мочи, тем более что реализация сбора мочи в условиях клиники при помощи катетера не представляет каких-либо сложностей, а по результатам представляется наиболее предпочтительной в случае группы беременных.
Была проведена оценка различий в протеомных данных при заборе мочи с помощью катетера и без него (на 5 пациентках контрольной группы). Значимых различий (выше предела вариабельности протеома, характерного для контрольной группы) в протеоме мочи, полученной с использованием катетеризации и неинвазивным методом (средняя струя) не было обнаружено. Однако следует отметить, что катетеризация необходима при работе с пациентками с нарушенной функцией почек (и/или мочевыводящих путей), в частности, при преэклампсии, так как в этом случае моча, полученная неинвазивным путем, содержит как обильные слизистые выделения, так и высокий бактериальный фон, что сильно осложняет протеомный анализ.
Результаты и обсуждение
Оценка intra- и inter-day вариабельности LC-MS/MS анализа
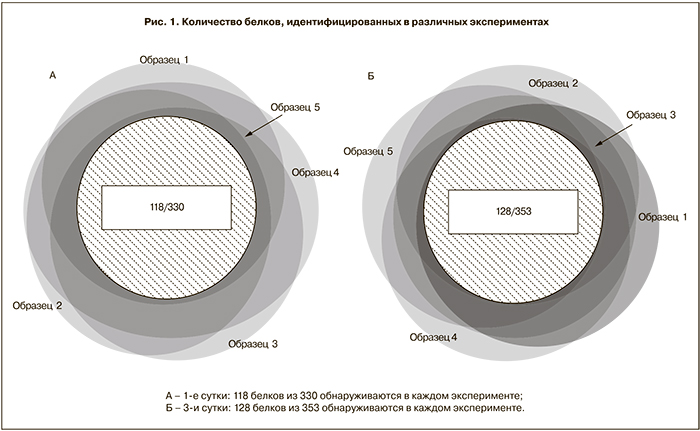
Воспроизводимость результатов является необходимым условием любого сравнительного эксперимента. Диаграмма Вена (рис. 1) показывает соотношение белков, идентифицированных в 5 последовательных различных экспериментах. Всего было идентифицировано 320 белков. Из них 118 присутствовали во всех образцах.
Следует отметить, что при автоматизированном введении проб на современных хромато-масс-спектрометрах проба может довольно долгое время находиться при комнатной температуре до анализа. При этом пробы гидролизата белков мочи остаются достаточно стабильными (рис. 1). При 5 последовательных введениях пробы после хранения в течение двух дней при Ткв целом обнаружено 353 белка, из них 128 присутствовали во всех образцах. Таким образом, в двух сериях экспериментов идентифицировано всего 417 белков, из них 256 присутствовали в обеих сериях. Сравнение белков, присутствующих во всех образцах, дало следующие результаты: всего 141 белок, присутствующих везде – 105. Таким образом, для повышения воспроизводимости LC-MS/MS анализа и снижения технической вариабельности необходимо проводить не менее 3 последовательных заколов образца и объединять результаты.
Биоинформационный анализ протеома мочи беременных женщин
Информация о протеомном составе мочи контрольной группы (здоровые беременные женщины) необходима для поисковых работ по определению маркеров патологических процессов. Были отобраны образцы мочи 12 беременных женщин в возрасте от 24 до 34 лет (34±6 лет), на втором и третьем триместре беременности (27±3 недели).
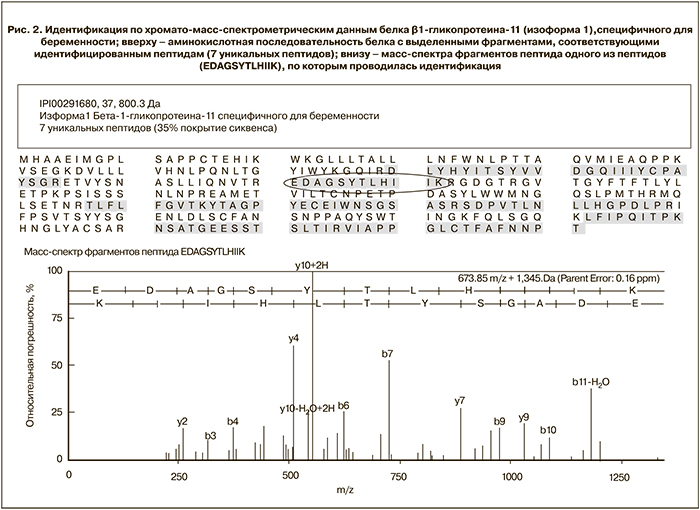
Адаптированный под исследуемую задачу (протеом мочи беременных) метод пробоподготовки и последующего хромато-масс-спектрометрического анализа позволил достигнуть высокой степени хроматографического разделения пептидов из гидролизата мочи. На рис. 2 показан пример идентификации по хромато-масс-спектрометрическим данным белка β1-гликопротеина-11 (изоформа 1), специфичного для беременности. Результаты масс-спектрометрического анализа образцов мочи были объединены в 48 HTML-файлов (каждый из 12 образцов закалывали 4 раза), с отчетами по IPI (International Protein Index) идентификации белков с помощью программы Mascot. Данные файлы содержат более 450 белков (каждый) при score в диапазоне от 20 до 1700. Для последующего анализа в Scaffold 4.1 критерием достоверности идентификации белка было наличие двух уникальных триптических пептидов, у которых score>24. Суммарное количество таких белков оказалось равным 293 при 0,7% FDR (поиск по decoy базе данных), а количество уникальных пептидов – 1940. В среднем в каждом образце обнаружено 188±28 белков при p<0,05.
Для определения функций и клеточной локализации обнаруженных белков использовалась GeneOntology (GO) база данных. Оказалось, что около 30,5% белков вовлечены в метаболические процессы, 47,4% – в процессы роста и поддержания гомеостаза клеток, 19,5% участвуют в системе транспорта, 14% ответственны за межклеточные взаимодействия, 3,4% представляют антивирусную систему защиты. Что касается молекулярных функций, то большинство идентифицированных белков (60%) участвует в связывании и транспорте макромолекул и метаболитов, а 35% – в регуляции клеточных процессов.
Сравнительный анализ протеомных данных показал, что 61 белок присутствует во всех образцах (>95%). Следует отметить, что в данной группе белков, постоянно присутствующих в моче, обнаруживаются следующие почечные белки: EGF (фактор роста эпителия) и белки каликреин-кининовой системы: кининоген-1 (KNG1, МВ 71,957 Da) и каликреин-1 (KLK1, МВ 28,890 Da).
Калликреин-кининовая система состоит из калликреина, кининогена, кининовых рецепторов и кининазы и играет важную роль в регуляции различных физиологических функций организма человека. Это ключевой компонент протеолитической системы. KLK1 синтезируется во многих органах, в том числе в почках и артериях, где он может инициировать выделение сосудорасширяющих агентов, брадикинина и каллидина. В почках калликреины синтезируются в проксимальных эпителиальных клетках почечных канальцев и выделяются в мочу в ответ на определенные стимулирующие сигналы [14]. Экспериментальные и клинические исследования показали обратную корреляцию между содержанием в моче калликреина и кровяным давлением. KLK1, вероятно, участвует в поддержании нормальной сердечной, почечной и неврологической функций [15]. Было высказано предположение, что физиологическая роль калликреин-кининовой системы заключается в предотвращении развития гипоксии, интерстициального фиброза, а также является одним из медиаторов расширения сосудов, развития воспалительного ответа и активации иммунной системы.
Эпидермальный фактор роста (EGF, 133994 Da) регулирует пролиферацию клеток посредством связывания с EGF-рецептором. Было показано, что EGF стимулирует реабсорбцию магния в дистальном извитом канальце [16].
Остеопонтин (OST, 35423 Da) – гликопротеин с высокой степенью фосфорилирования обнаруживается во многих тканях и жидкостях организма. В моче OST является мощным ингибитором образования, роста и агрегации кристаллов оксалата кальция; это говорит о возможной роли в профилактике почечного камнеобразования. Остеопонтин оказался одним из мажорных компонент белкового состава почечных камней [17], но его роль в нефролитиазе до сих пор не выяснена.
Уромодулин (белок Тамма–Хорсфолла, 69761 Da) является одним из наиболее мажорных белков мочи при физиологических условиях. Его биологические функции связаны с поддержанием водно-солевого баланса и почечным врожденным иммунитетом. Уромодулин является гликозилфосфатидилинозитол-связывающим белком. Экспрессия уромодулина приводит к значительному увеличению адгезии нейтрофилов (при связывании тяжелой и легкой цепей IgG) и транс-эпителиальной миграции как в апикально-базолатеральном, так и в базолатерально-апикальном направлениях [18].
Таким образом, восемь белков почечных тканей постоянно присутствующих в моче, обладают регуляторными функциями, а также являются мембранными белками и участвуют в реабсорбции белков в проксимальных канальцах эпителиальных клеток.
Среди белков, присутствующих в моче постоянно и характерных для беременности, следует выделить кластер характерных для беременности β1-гликопротеоинов (1, 2, 7, 11) и остеопонтин. Изменение уровня экспрессии данных белков в моче может представлять диагностическую значимость для определения осложнений беременности.
Среди идентифицированных нами белков также можно выделить группу энзимов, выделение которых из проксимальных канальцев в мочу может служить маркером дисфункции фильтрующей системы нефронов: аминопептидаза N, глутамиламинопептидаза, лизосомальная α-глюкозидаза, лизосомальная кислая фосфатаза, глутамил-пептид цитотрансфераза, αN-ацетилглюкоаминидаза, простагландин-H2-D-изомераза. Недавние исследования показали, что уровень простагландин-H2-D-изомераза в крови и моче может служить чувствительным индикатором поражения почек при диабете и артериальной гипертензии, а следовательно, и при преэклампсии. При развитии патологии беременности обнаруживается изменение экспрессии данного фермента в амниотической жидкости. Аминопептидаза N относится к группе ферментов щеточной каймы проксимальных почечных канальцев. Данный белок ассоциирован с дисфункцией почечных канальцев, которая может быть следствием интервальной гипоксии почек [19].
Заключение
С развитием биохимических и физических методов исследования в протеомике/пептидомике стал возможным анализ изменений, происходящих в процессе жизнедеятельности организма, патофизиологических путей развития различных заболеваний и физиологических состояний организма (в частности, беременности). Современные методы протеомного анализа (в частности, масс-спектрометрия сверхвысокого разрешения) позволяют не только идентифицировать биомаркеры ранних стадий заболевания/физиологических состояний организма, но и применять эти методы и обнаруженные панели биомаркеров в рутинной клинической диагностике с более высоким по сравнению с иммуноферментными методами уровнем диагностической значимости, достоверности и воспроизводимости полученных результатов.
Протеом мочи содержит как белки плазмы (1/3 общего количества), так и почечные белки. Следовательно, моча является хорошим материалом для анализа патологических/физиологических процессов, происходящих в организме. Анализ литературных данных по исследованию протеома мочи позволяет выделить несколько групп ученых, исследующих в основном биомаркеры различных патологий и заболеваний, таких как раковые заболевания [1, 4, 6–9] и заболевания мочеполовой системы [2, 3, 5]. При этом изменения протеома мочи при беременности остаются неосвещенными.
В ходе данного исследования разработан и стандартизирован протокол выделения белковых экстрактов из проб мочи, включающий процедуру первичного отбора проб мочи у пациенток и экстрагирование белковых смесей из проб мочи. Процедуры сбора мочи/выделения белка разрабатывались с целью минимизировать время анализа, но при сохранении достаточно высокого (несколько сотен) количества белков для последующего проведения сравнительного скрининга. Показано, что точность и воспроизводимость результатов протеомных исследований образцов мочи прежде всего зависят от того, насколько соблюден протокол сбора биологических образцов, условия их хранения и последующая обработка. В процессе разработки методики сбора мочи беременных женщин была подтверждена корректность использования ранее разработанного протокола для небеременных женщин с определенными изменениями процесса сбора образцов.
В ходе исследования показана высокая воспроизводимость и информативность протеомных данных состава мочи беременных, что позволяет нам предложить данный протокол для определения изменений протеома мочи, связанных с беременностью, определения характерных качественных изменений белкового профиля мочи при беременности, исследования возможности использования выявленных белковых молекул в качестве биомаркеров для ранней диагностики различных заболеваний, связанных с беременностью. Протеомный анализ изменений в моче беременных женщин на разных сроках гестации с использованием биоинформационного подхода позволяет выделять группы белков, возможных маркеров патологии почек, беременности, сердечно-сосудистых нарушений, а также дает новый материал для развития наших представлений о биомедицинских механизмах функционирования почечной системы при беременности.



