Гиперплазия эндометрия (ГЭ) – фенотипически различный спектр морфологических изменений слизистой оболочки матки, характеризующийся чрезмерной пролиферацией железистого и в меньшей степени стромального компонентов.
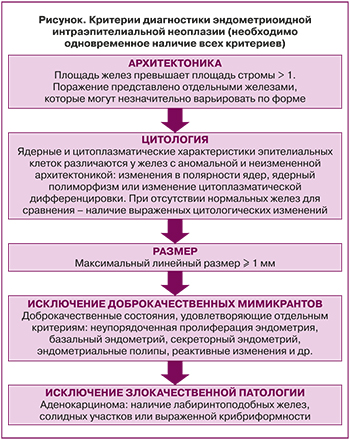 Длительное время в практике использовалась гистологическая классификация опухолей женского полового тракта, разработанная экспертами ВОЗ в 1975 г. и позднее дополненная Б.И. Железновым. В 1994 г. была принята вторая редакция классификации опухолей женской половой системы ВОЗ, а в 2014 г. экспертами ВОЗ была утверждена классификация гиперпластических процессов эндометрия, в рамках которой было предложено выделить доброкачественную гиперплазию эндометрия, имеющую незначительный риск озлокачествления, и атипическую гиперплазию эндометрия, а также признать ее синонимом эндометриоидную интраэпителиальную неоплазию (ЭИН), обладающую 40% риском трансформации в карциному в течение одного года наблюдения [1]. В 2020 г. данная классификация была утверждена вновь [2], хотя Американская коллегия акушеров-гинекологов рекомендовала использование иной классификации, основанной на морфометрических параметрах [3]. При гистологическом разграничении доброкачественной гиперплазии и ЭИН ключевой отличительной чертой является наличие клеточной атипии. Компьютерная морфометрия позволила разработать более точные диагностические критерии ЭИН, которые могут быть использованы для постановки клинико-морфологического диагноза [3], причем диагностически значимым является одновременное наличие всех из них (рисунок).
Длительное время в практике использовалась гистологическая классификация опухолей женского полового тракта, разработанная экспертами ВОЗ в 1975 г. и позднее дополненная Б.И. Железновым. В 1994 г. была принята вторая редакция классификации опухолей женской половой системы ВОЗ, а в 2014 г. экспертами ВОЗ была утверждена классификация гиперпластических процессов эндометрия, в рамках которой было предложено выделить доброкачественную гиперплазию эндометрия, имеющую незначительный риск озлокачествления, и атипическую гиперплазию эндометрия, а также признать ее синонимом эндометриоидную интраэпителиальную неоплазию (ЭИН), обладающую 40% риском трансформации в карциному в течение одного года наблюдения [1]. В 2020 г. данная классификация была утверждена вновь [2], хотя Американская коллегия акушеров-гинекологов рекомендовала использование иной классификации, основанной на морфометрических параметрах [3]. При гистологическом разграничении доброкачественной гиперплазии и ЭИН ключевой отличительной чертой является наличие клеточной атипии. Компьютерная морфометрия позволила разработать более точные диагностические критерии ЭИН, которые могут быть использованы для постановки клинико-морфологического диагноза [3], причем диагностически значимым является одновременное наличие всех из них (рисунок).
Доброкачественная гиперплазия эндометрия (ДГЭ) диагностируется у 6–114 пациенток на 100 тыс. женщин репродуктивного возраста. Можно предположить, что ее частота значительно выше с учетом бессимптомных женщин, не обратившихся к специалистам для проведения диагностического поиска [4]. Суммарно в структуре гинекологической патологии гиперпластические процессы эндометрия составляют от 15 до 40%. Вероятность трансформации ДГЭ в ЭИН и рак эндометрия невысока и составляет соответственно 3–10% и 1–5%, при этом в 80% наблюдений может отмечаться полный спонтанный регресс [5, 6].
ДГЭ является полиэтиологическим заболеванием, развитию которого может способствовать множество причин, однако необходимым условием является длительная абсолютная или относительная гиперэстрогения [6]. Как мы указывали в своих более ранних публикациях [7] и в соответствии с заключением ВОЗ от 2014 г., на фоне гиперэстрогении на первых этапах происходит нерезкое расширение желез на фоне нормального пролиферативного эндометрия. Данные изменения эндометрия получили название «пролиферативный эндометрий с нарушениями». Они не относятся к истинной гиперплазии, являются обратимыми, захватывают весь эндометрий и характеризуются сохранением нормального соотношения железистого и стромального компонентов.
При более длительной стимуляции эстрогенами, на смену которой не приходит воздействие прогестерона, в пролиферативном эндометрии с нарушениями развивается истинная доброкачественная гиперплазия (ДГЭ, «активная фаза»). Появляются участки эндометрия, в которых объем желез превышает объем стромы, что принципиально отличает истинную гиперплазию от предыдущих изменений. Дальнейшая цитодинамическая трансформация эндометрия может включать в себя его «истощение» на фоне снижения концентрации эстрогенов, появление «дополнительных эффектов прогестерона» или вступление в фазу «отторжения» при десквамации. Эти изменения имеют достаточно четкие гистологические признаки и должны быть отражены в отчете патоморфолога [8].
Гиперэстрогения является важным условием развития гиперплазии эндометрия и может быть результатом гонадного и внегонадного эндогенного или экзогенного поступления эстрогенов или их предшественников в организм [7]. Доказано, что к развитию ГЭ может приводить локальная активность ароматазы, увеличивающая концентрацию как эстрогенов, так и эстрогеновых рецепторов (ЭР) [6].
Как видно из работ, посвященных изучению нормального эндометрия, распределение в нем рецепторов к половым гормонам гетерогенно в разных клеточных популяциях и меняется в зависимости от фазы цикла. Данные литературы относительно экспрессии ЭР и рецепторов прогестерона (ПР) при гиперплазии эндометрия более скупы [6]. Рядом исследователей выявлены выраженная экспрессия ЭР в неизмененном эндометрии фазы пролиферации и значительное ее снижение при ГЭ. Ряд авторов отмечают, что по мере увеличения степени клеточной атипии содержание ЭР и ПР в эндометрии снижается [6]. Эти факты могут объясняться ростом клеточной атипии, но заставляют задуматься о том, что же поддерживает пролиферацию клеток на фоне снижения их чувствительности к половым стероидам.
В регуляции пролиферативной активности эндометрия важную роль играют факторы роста (ФР) [6], инициирующие включение внутриклеточных сигнальных путей, оказывающих как стимулирующее, так и подавляющее влияние. В настоящее время выделяют два семейства ФР, оказывающих ключевое влияние на эндометрий. Это представители семейства инсулиноподобного ФР (IGF) и эпидермального ФР (EGF, a-трансформирующий ФР (a-ТGF) и ряд других структурно схожих пептидов). У пациенток с ГЭ отмечена вариабельность экспрессии EGF на фоне невысокого уровня выработки ТGF в цитоплазме клеток с атипической гиперплазией. В ряде научных исследований установлено, что в нормальной и гиперплазированной ткани эндометрия экспрессия a-ТGF сочетается с экспрессией ЭР [6].
В небольшом числе наблюдений также установлено, что одной из причин развития пролиферативных заболеваний эндометрия является дисбаланс процессов пролиферации и апоптоза [6]. Активация программируемой клеточной гибели осуществляется за счет синтеза цитокинов или взаимодействия рецепторов семейства фактора некроза опухоли TNF (TNFR1, TNFR2, FasR/APO-1 (CD95)) с лигандами (TNFa, FasL). Другой путь передачи сигнала реализуется через специализированные гены. Показано, что по мере увеличения тяжести патологического процесса в эндометрии возрастает частота мутаций гена подавления роста опухоли PTEN, ряда онкогенов (k-ras, b-катенина), прогрессивно накапливаются микросателлитные нестабильности, отмечаются аномалии генов репарации (hMLN-2, hMSH-1) [6].
Важным условием развития гиперпластических процессов эндометрия становятся обменно-эндокринные нарушения. Ановуляция, нарушение жирового обмена, гиперкортицизм наблюдаются у 51–75% женщин с ГЭ [6]. Не только количество, но и характер распределения жировой клетчатки могут влиять на риск развития ГЭ. Андроидный тип ожирения, которому часто сопутствуют инсулинорезистентность, гиперинсулинемия, дислипидемия и артериальная гипертензия, составляющие в совокупности метаболический синдром, является независимым фактором риска гиперплазии и рака эндометрия [6].
Имеющийся в настоящее время объем данных о молекулярно-биологических механизмах развития гиперплазии эндометрия не может удовлетворить специалистов, так как не дает единого представления о патогенезе заболевания и его пусковых механизмах. Снижение научного интереса к данной проблеме не соответствует потребностям клиницистов и требует актуализации. Упор, сделанный на изучение эндометрия с позиции решения проблемы повышения эффективности программ вспомогательных репродуктивных технологий или изучение патогенеза рака эндометрия, встречаемость которого значительно уступает ГЭ, оставил без ответов вопросы о патогенезе и совершенствовании терапевтических подходов для огромного числа женщин, сталкивающихся с проблемой ДГЭ.
Еще одним фактом, демонстрирующим невысокий интерес к проблеме, стало то, что после утверждения в 2014 г. экспертами ВОЗ новой классификации ГЭ клинические рекомендации по ведению пациентов не обсуждались столь широко, как этого требуют распространенность и актуальность вопроса. В 2015 г. Гонконгской коллегией акушеров-гинекологов были опубликованы первые клинические рекомендации по ГЭ. Затем в 2016 г. Королевской коллегией акушеров-гинекологов совместно с Британским обществом гинекологической эндоскопии был выпущен протокол, который долгое время не подвергался пересмотру и в неизмененном виде применялся почти во всем мире. Обновленные рекомендации Канадского общества акушеров-гинекологов [8] были опубликованы лишь 2019 г. с указанием на то, что их пересмотр планируется через 5 лет.
При лечении ГЭ первым этапом в подавляющем числе наблюдений проводится кюретаж полости матки в сочетании с гистероскопией, хотя в последние годы не утихают споры о правомочности использования пайпель-биопсии, доказывающей свою экономическую целесообразность при сопоставимости гистологических результатов, согласно ряду исследований. Терапия, направленная на профилактику рецидива заболевания, назначается после получения гистологического заключения и оценки факторов риска. Согласно рекомендациям Королевской коллегии акушеров-гинекологов от 2016 г. [7], в их отсутствие при первичном эпизоде выявления ДГЭ возможно ограничиться динамическим наблюдением и проведением контрольной биопсии эндометрия через полгода. При наличии факторов риска, таких как ожирение, бесплодие, ановуляторные состояния, прием тамоксифена, назначают внутриматочную систему, содержащую левоноргестрел (ЛНГ-ВМС), или пероральные прогестины (ПП) в непрерывном режиме [7]. К гормональной терапии следует прибегать и тогда, когда у пациенток без факторов риска после 6-месячного периода наблюдения без гормонального лечения вновь выявляется ГЭ. Согласно результатам метаанализа, применение ЛНГ-ВМС по сравнению с ПП более эффективно подавляет пролиферативную активность в эндометрии на протяжении 3–24 месяцев лечения. Пациентки, применявшие ЛНГ-ВМС, реже нуждались в проведении гистерэктомии (ОР 0,26 (95% ДИ 0,15–0,45)) [9]. Длительность лечения ЛНГ-ВМС должна составлять 6 месяцев (уровень доказательности В) и при хорошей переносимости и потребности в контрацепции может быть продлена до 5 лет.
В силу персональных предпочтений или особенностей экономических моделей организации здравоохранения разных стран применение ЛНГ-ВМС возможно далеко не всегда. Прогестины в непрерывном режиме следует назначать пациенткам, у которых применение ЛНГ-ВМС невозможно (уровень доказательности В) [9].
Среди пациенток, получавших противорецидивное гормональное лечение, оценка состояния эндометрия проводится с интервалом 6 месяцев. Наблюдение продолжается до получения двух отрицательных проб эндометрия (уровень доказательности D). Пациентки должны быть проинформированы о симптомах ГЭ и необходимости незамедлительно обратиться к гинекологу в случае их появления. Для женщин группы риска в отношении рецидива заболевания (например, при индексе массы тела более 35 кг/м2), помимо двух биопсий с интервалом 6 месяцев, рекомендовано ежегодно проводить исследование биоптатов эндометрия (уровень доказательности D). Длительность наблюдения для каждой пациентки устанавливается индивидуально, с учетом клинической картины и факторов риска.
Радикальное хирургическое лечение, согласно вышеупомянутым рекомендациям, предлагается пациенткам, не нуждающимся в сохранении фертильности, при выявлении атипической гиперплазии в период наблюдения; при отсутствии регресса на фоне гормональной терапии, проводимой 12 месяцев; при рецидиве ГЭ по окончании курса гормональной терапии; при сохраняющихся маточных кровотечениях на фоне проводимой терапии; при отказе пациентки от медикаментозной терапии. В период постменопаузы оптимальным методом лечения можно считать лапароскопическую/влагалищную гистерэктомию с двусторонней аднексэктомией. В пременопаузе вопрос об удалении яичников в каждом конкретном случае решается индивидуально, однако тубэктомия может быть рекомендована всем пациенткам, поскольку позволяет снизить риск развития злокачественных новообразований яичников [7]. Рутинное выполнение трансцервикальной аблации/резекции эндометрия не рекомендуется, так как данная процедура не гарантирует радикальности и может формировать картину «мнимого благополучия» в отсутствие клинических проявлений ДГЭ и стертости эхографических изменений.
В соответствии с более поздними канадскими рекомендациями первым необходимым этапом считается проведение пайпель-биопсии эндометрия, после которой, при отсутствии атипии, пациентке может быть предложена выжидательная тактика. Гормональное лечение предусмотрено в случае появления аномальных маточных кровотечений (АМК) или персистенции ГЭ. Первой линией терапии также признается ЛНГ-ВМС в связи с хорошей переносимостью (А) и возможностью пролонгировать лечение на 5 лет у пациенток, хорошо отвечающих на терапию (В). Низкодозированные пероральные или инъекционные прогестины являются альтернативой для пациенток, предпочитающих другие пути введения препарата (А). Гормональная терапия, независимо от пути введения препарата, рекомендуется на срок 6 месяцев с забором контрольной биопсии через 3 месяца от начала лечения и через 3 недели после его окончания (С).
Показания и рекомендованный объем хирургического лечения в данном документе не отличаются от рекомендации Королевской коллегии акушеров-гинекологов, но имеют указание на необходимость избегать проведения субтотальной лапароскопической гистерэктомии с морцелляцией у пациенток с ГЭ.
Исходя из современных рекомендаций становится очевидным, что ДГЭ чаще требует консервативного ведения пациенток, что диктует рутинную необходимость выбора и назначения гормональных препаратов. В том случае, если не планируется применение ЛНГ-ВМС, врач стоит перед выбором из широкой палитры различных типов гестагенов.
Согласно новым клиническим рекомендациям Российского общества акушеров-гинекологов (РОАГ) по гиперплазии эндометрия, терапия прогестагенами назначается до 6 месяцев с учетом отсутствия атипии после исследования эндометрия. Далее при необходимости возможна пролонгация гормонотерапии прогестагенами на 6 месяцев с дальнейшей оценкой динамики лечения [10]. В клинических рекомендациях РОАГ по АМК прописан алгоритм действий врачей при АМК как наиболее часто встречающемся симптоме при ГЭ. Назначение прогестагенов показано при верифицированной ГЭ с противорецидивной целью [11]. В рекомендациях Королевской коллегии акушеров-гинекологов упомянуты мегестрол ацетат, медроксипрогестерон ацетат, микронизированный прогестерон. В разделе, посвященном ЭИН, дается ссылка на те же гестагены, однако указано, что на сегодня не определен оптимальный тип терапии [7]. Это может указывать на то, что прочие гестагены могут также рассматриваться в рамках противорецидивного лечения ГЭ. Так, в 2015 г. в исследовании эффективности дидрогестерона в лечении ГЭ [12] было показано, что через 6 месяцев лечения регресс патологических изменений эндометрия происходил в 80% наблюдений. При сравнении с группой ЛНГ-ВМС частота побочных эффектов была невысока и сопоставима, однако межменструальные кровянистые выделения и аменорея чаще встречались в группе ЛНГ-ВМС (P=0,01 и 0,0001) [12]. Ряд исследователей показали, что для женщин с выраженными метаболическими нарушениями сочетанное применение дидрогестерона, повышающего чувствительность к инсулину, и метформина значительно повышает эффективность патогенетической терапии ДГЭ [13], а также у женщин с ДГЭ, развившейся на фоне синдрома поликистозных яичников (СПКЯ), комбинация метформина с дидрогестероном может давать дополнительные лечебные эффекты за счет синергизма действия [14]. Дидрогестерон обладает прогестагенной антипролиферативной активностью с минимальными побочными эффектами и нейтральным влиянием на метаболизм липидов и углеводов, что позволяет использовать его у пациенток с различной соматической патологией [15–19] с целью эффективного лечения АМК, ассоциированного с ДГЭ, нормализации менструального цикла [20–23], а также с целью предотвращения рецидивов ДГЭ [24]. При появлении климактерических симптомов с заместительной целью к дидрогестерону могут быть добавлены эстрогены, то есть осуществлен переход к менопаузальной гормональной терапии (МГТ) [19]. В настоящее время дидрогестерон может быть назначен согласно текущим клиническим рекомендациям с целью персонализированного лечения и профилактики ДГЭ [10, 11]. Целесообразно проведение дальнейших исследований, что даст возможность обогатить наши представления о персонализации, эффективной и безопасной тактике ведения пациенток и профилактике рецидивов ДГЭ. Ниже мы приводим сводные данные по исследованиям эффективности различных гестагенов в лечении ГЭ, проведенным ранее (таблица).

Обсуждая отдаленные исходы ГЭ, необходимо оценивать не только вероятность малигнизации, но и иные сценарии. На сегодняшний день нельзя сделать вывод о том, имеет ли ГЭ какое-либо неблагоприятное влияние на фертильность и частоту наступления беременности в протоколах ВРТ (D) [25], начало которых рекомендовано не ранее чем через 6 месяцев после гистологической регрессии (D). В недавнем обзоре Gadducci [26] было отмечено, что применение после завершения гормонального лечения позволяет не только увеличить шансы на успешное зачатие, но и сократить интервал до него.
ГЭ не следует рассматривать как противопоказание к применению препаратов для лечения бесплодия, так как нет убедительных доказательств того, что существует связь между их приемом и возрастающим риском карциномы эндометрия (D) [25]. На данный момент нет исследований, посвященных влиянию препаратов для стимуляции овуляции на прогрессирование ГЭ. Такая взаимосвязь изучалась на более широких выборках пациентов [27]. С другой стороны, известно о повышении риска развития карциномы эндометрия в группе женщин, страдающих бесплодием [7].
При необходимости назначения контрацепции противопоказаний к применению любых гормональных и негормональных методов у женщин с ГЭ в настоящее время или в анамнезе нет (D) [25]. Исследований, посвященных использованию МГТ, на сегодня нет, однако полагают, что МГТ у женщин с ГЭ в анамнезе безопасно при отсутствии других медицинских противопоказаний (C) [25].
Очевидно, что потребуются длительное время и большой объем исследований в направлении изучения патологической физиологии эндометрия для того, чтобы стало возможным сделать значимый прорыв в вопросе диагностики и лечения ГЭ. Несовершенство классификации ГЭ, о котором упоминается во многих публикациях, обусловлено отсутствием четких гистологических и иммуногистохимических маркеров данной патологии. С учетом того, что эндометрий является крайне изменчивой тканью и может трансформироваться за очень короткий промежуток времени под влиянием большого числа факторов, поиск таких маркеров и критериев может занять много времени и даже не увенчаться успехом. Большие надежды на успех могут быть, вероятно, возложены на молекулярно-генетические исследования, которые позволят выделить геномные, транскриптомные и протеомные характеристики различных типов гиперплазии, которые отражали бы особенности течения заболевания и его прогноз.
На данном этапе широкое внедрение данных методов в клиническую практику ограничено. Однако проводимые генетические исследования укрепляют уверенность в том, что в научных кругах интерес к теме ГЭ не угасает. За последний год были опубликованы результаты генного секвенирования при ГЭ, показавшие, что даже при доброкачественной пролиферации эндометрия возможно появление мутации генов PTEN, PIK3CA и FGFR2 [28]. Также в 2020 г. было опубликовано исследование прогностического потенциала гиперметилирования генов ADCYAP1 и HAND2 при доброкачественной патологии эндометрия [29]. Обнаруженные генетические изменения в обоих случаях рассматриваются как предикторы неопластической трансформации.
Заключение
Накопление научных данных о патогенезе ГЭ, выделение на основании новых молекулярно-генетических данных прогностически благоприятных и неблагоприятных типов заболевания с созданием прогностических моделей будет способствовать оптимизации диагностики и тактики ведения пациенток. Совершенствование и возможности персонализации терапевтических подходов в лечении ГЭ позволят эффективно и безопасно минимизировать риск рецидивов заболевания.



