В развитии бактериального вагиноза (БВ) состояние иммунной системы играет определяющую роль. Иммунная система слизистых оболочек женских половых органов осуществляет первую линию локальной защиты от патогенов. Лимфоциты, нейтрофилы, макрофаги слизистой оболочки синтезируют цитокины, секреторные иммуноглобулины и другие биологически активные молекулы,
которые секретируются в цервикальную слизь. Исследование цервикальной слизи перспективно
в плане активного поиска методов неинвазивной диагностики, особенно у беременных женщин. Для определения биологически активных молекул в цервикальной слизи используется метод экстракции, стандартизация полученных данных проводится различными методами [8,15,18].
Для БВ характерно отсутствие признаков воспаления, в том числе лейкоцитарной реакции. Однако наблюдаемое при БВ патологическое изменение равновесия влагалищных микроорганизмов приводит к их цитоадгезии к слизистой оболочке вследствие измененной рецепторной активности влагалищного эпителия. Вытеснение лактобактерий при БВ способствует формированию среды с более высокой вирулентностью, что может отрицательно сказываться на развитии беременности и течении родов. Поэтому представляет интерес изучение местного иммунитета у беременных для совершенствования профилактики и лечения этого наиболее распространенного заболевания нижних отделов половых путей женщины.
Так, сравнение эндоцервикального уровня провоспалительных цитокинов ИЛ-1b, ИЛ-6, ИЛ-8 у беременных и небеременных пациенток с БВ и одинаковым соматическим статусом в обеих группах показало, что у беременных уровень цитокинов был значительно выше, чем у небеременных, что, возможно, связано с иммунным компромиссом беременности [6].
Преобладание дисбиотических изменений в микрофлоре влагалища и перситенция микроорганизмов в цервикальном канале у беременных с привычным невынашиванием приводят к достоверному превышению провоспалительных цитокинов ФНО-α, ИФН-γ ИЛ-6 над регуляторными ИЛ-4, ИЛ-10 в противоположность здоровым беременным [4].
В шведской популяции беременных с преждевременным разрывом плодных оболочек в сроке менее 34 нед при амниоцентезе исследованы внутриматочная микрофлора и цитокины ИЛ-6, ИЛ-8. Бактериальная флора в амниотической жидкости обнаружена у 25% беременных. Концентрация
в водах ИЛ-6 более 0,80 нг/мл ассоциировалась с внутриматочной инфекцией и высоким риском
наступления преждевременных родов в ближайшие 7 дней, а повышение концентрации ИЛ-8 указывало на роды ранее 34 нед [11, 13].
Полученные данные перекликаются с другими аналогичными исследованиями, свидетельствующими о том, что низкие концентрации провоспалительных цитокинов ИЛ-1α, ИЛ-1b, ИЛ-6, ИЛ-8 в цервикальном отделяемом в сроки гестации 22–34 нед, особенно уровень ИЛ-8, представляют высокий риск раннего инфекционного заболевания новорожденных. Среди других маркеров преждевременных родов исследование содержания ИЛ-6 в вагинальном отделяемом позволит идентифицировать беременных с высоким риском неонатальной инфекции и прогнозировать наступление родов ранее 34 нед гестации [10, 14, 19]. По некоторым данным, уровни ИЛ-1b, ИЛ-6 в вагинальном отделяемом были достоверно выше у беременных с БВ [12].
Другое исследование, касающееся частоты выявления 7 провоспалительных цитокинов и полиморфизма гена Toll-подобного рецептора у беременных с наличием и отсутствием БВ при сроке
гестации менее 30 нед, показало, что полиморфизм на выделенных локусах ИЛ-1b, ИЛ-6, ИЛ-8 связан
с изменением степени выраженности БВ при беременности [7, 9].
Для клинических вариантов заболеваний, вызванных оппортунистической инфекцией, желательно опираться на иммунологические факторы, которые могли бы быть объективными маркерами в оценке эффективности лечения. Поскольку цитокины являются ключевыми факторами в фазах индукции и развития иммунного ответа, а также уклонения от него, то количественное определение их содержания в секреторных компонентах репродуктивного тракта имеет большое значение. Целью настоящего исследования явилось определение в отделяемом цервикального канала провоспалительных и противовоспалительных цитокинов как показателей состояния местного иммунитета у беременных с БВ. ‹ ‡ Œ
Материал и методы исследования
В исследование были включены 45 беременных, обратившихся в ранние сроки гестации. Основную
группу составили 32 беременные, у которых был верифицирован диагноз БВ, группу сравнения –
13 беременных с нормальным микробиоценозом влагалища. Уровень цитокинов в отделяемом
цервикального канала определяли в I триместре беременности до лечения БВ, затем повторяли
после лечения в 22–23 и в 33–34 нед гестации. В эти же сроки определяли содержание цитокинов
в отделяемом цервикального канала и у пациенток контрольной группы.
Оценку состояния микробиоценоза влагалища проводили на основании микроскопии вагинальных мазков, окрашенных по Граму, и культурального исследования вагинального содержимого на факультативно-анаэробные бактерии, дрожжеподобные грибы, генитальные микоплазмы и лактобактерии. Степень микробной обсемененности определяли методом секторного посева отделяемого влагалища на 5% кровяной агар, среду Сабуро и МРС. Видовую идентификацию микроорганизмов проводили общепринятыми методами.
Микробиологическая диагностика БВ при микроскопии вагинальных мазков базировалась на следующих критериях: наличие ключевых клеток; отсутствие выраженной лейкоцитарной реакции; массивное микробное обсеменение с преобладанием морфотипов облигатно-анаэробных бактерий (бактероидов, мобилункуса, фузобактерий, лептотрихий) и гарднереллы; отсутствие или выявление единичных в поле зрения грамположительных палочек морфотипа лактобактерий.
Слизь из цервикального канала брали универсальным зондом, спонж со слизью отделяли ножницами и помещали в пробирку типа Эппендорф с 1 мл буфера, содержащего 5 мМ этилендиаминтетрауксусной кислоты, 10 мМ трис-гидроксиметиламинометана, 1% бычьего сывороточного альбумина и немедленно 0,5 мМ ингибитора протеиназ (PMSF) в 100 мл дистиллированной воды, рН 7,4. Затем проводили экстракцию встряхиванием на вортексе в течение 1 мин. Смесь центрифугировали в течение 5 мин при 900 g и отбирали надосадочную жидкость, которую немедленно замораживали и хранили до анализа при - 80ºС.
В слизи цервикального канала определяли содержание провоспалительных (ФНО-α, ИФН-γ, ИЛ-1α, ИЛ-2, ИЛ-6, ИЛ-8) и противовоспалительных цитокинов (ИЛ-4, ИЛ-10) методом иммуноферментного анализа (ELISA). Для проведения анализа использовали наборы фирмы «Цитокин» (Санкт-Петербург). Оптическую плотность измеряли на планшетном анализаторе фирмы BioTek (США) при длине волны 450 нм.
Количественное содержание цитокинов в цервикальной слизи нормировали путем пересчета на общий белок в пробах. Определение белка в пробах проводили колориметрическим методом с помощью бицинхониновой кислоты (Sigma, США).
Статистическую обработку данных проводили по общепринятым методам вариационной статистики. Значимость наблюдаемых отклонений оценивали с помощью t-критерия Стьюдента. †„ Œ
Результаты исследования и обсуждение€
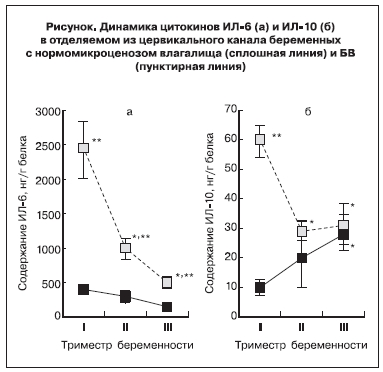
Данные о содержании цитокинов в цервикальной слизи беременных в разные сроки гестации представлены в таблице.
Таблица. Содержание цитокинов (в нг/г белка) в отделяемом цервикального канала у беременных с нормомикроценозом влагалища и БВ (М±m).
Как видно из таблицы, имелись достоверные различия в содержании цитокинов в отделяемом цервикального канала в I триместре у беременных с БВ и у беременных с нормальным микробиоценозом влагалища: уровни как про-, так и противовоспалительных цитокинов в основной группе в 2 раза и более превышали аналогичные показатели в группе сравнения.
Анализ изменений содержания цитокинов в цервикальной слизи в группе пациенток с нормомикробиоценозом влагалища показал, что в I триместре беременности практически все
исследованные цитокины количественно характеризуются минимальными значениями. Далее, при отсутствии достоверных различий обнаруживаются разные тенденции в изменении содержания исследованных цитокинов в последующие триместры (за исключением ИЛ-10, уровень которого достоверно повышается в III триместре по сравнению с содержанием в I триместре). Однако, несмотря на это, очевидно, что при нормомикроцинозе влагалища локальные иммунные реакции проявляют тенденцию к поддержанию некоторой постоянной концентрации секретируемых цитокинов в течение всего срока беременности. Это несколько отличается от картины, описываемой рядом исследователей относительно содержания этих цитокинов в крови женщин при физиологической беременности, в том числе и не осложненной БВ [5, 16]. По наблюдениям этих авторов, в крови женщин при физиологической беременности наблюдаются признаки воспалительной реакции с повышением содержания ряда цитокинов. Вероятно, это различие объясняется адекватным функционированием гистогематического барьера и как следствие созданием наиболее благоприятных условий для развивающейся беременности.
При обследовании женщин во II и III триместрах беременности достоверное различие в содержании цитокинов между группами отсутствовало. Исключение составили ИЛ-6 и ИЛ-2. Следует отметить, что после лечения БВ микрофлора влагалища у беременных основной группы по данным микробиологического обследования соответствовала показателям у здоровых беременных. Достоверное снижение уровня ряда цитокинов у беременных основной группы в динамике беременности, за исключением уровней ФНО-α и ИЛ-8, возможно, также связано с отсутствием выраженного воспаления слизистой влагалища при БВ, следствием которого могло бы быть изменение опосредуемого данными цитокинами активного синтеза адгезивных молекул и киллерной активности фагоцитирующих клеток. Известно также, что существует антагонистическое взаимодействие между ФНО-α и ИЛ-6 [1]. Повышение продукции ФНО-α в I триместре приводит к усилению выработки ИЛ-6. Однако стабильно повышенные концентрации ИЛ-6 во II и III триместрах беременности вызывают
уменьшение секреции ФНО-α и как следствие подавление миграции лейкоцитов в ткань.
Детальный анализ динамики цитокинов по триместрам в основной группе беременных показал, что изменение содержания ИФН-γ, ИЛ-1α, IL-8 и ИЛ-10 имеет следующую тенденцию: повышенное содержание в I триместре, снижение во II триместре (после лечения) и вновь повышение содержания в цервикальной слизи в III триместре беременности. Причем отмечается, что при достоверном снижении их концентрации после лечения средние значения содержания ИФН-γ, ИЛ-8, ИЛ-10, а также
ИЛ-1α во II триместре беременности остаются повышенными по сравнению с аналогичными показателями в группе беременных с нормомикробиоценозом влагалища. Отсутствие достоверных различий между группами в содержании данных цитокинов дает право предположить, что изменения, вызванные патогенными микроорганизмами, а также произошедшие вследствие сдвига микроэкологических ниш в половых путях беременных, не являясь критическими для беременности, создают более высокий фоновый провоспалительный уровень. Следует отметить, что средние показатели содержания данных цитокинов в III триместре беременности в основной группе максимально приближены к значениям в группе сравнения.
Также заслуживает внимания высокий уровень в цервикальной слизи ИЛ-1α. Известно, что ИЛ-1α представляет собой трансмембранный белок, в свободной форме он находится внутри клетки и секретируется при различных патологических состояниях. Обнаружение его в биологических жидкостях организма говорит об активации макрофагального звена иммунитета. Выявленный в данном исследовании уровень секреторной формы ИЛ-1α у беременных основной и контрольной группы свидетельствует об антигенной стимуляции бактериальными продуктами.
Особенно активно по мере увеличения срока беременности у пациенток с БВ снижались уровни ИЛ-6, ИФН-γ, ИЛ-2. В то же время обращает на себя внимание достоверное повышение концентрации противовоспалительного цитокина ИЛ-10 у здоровых беременных в поздние сроки гестации, что, возможно, обусловлено изменением состояния иммунной системы организма перед родами. Динамика ИЛ-10 отражена на рисунке. Важным свойством ИЛ-10 является подавление активности иммунных клеток, что приводит к завершению воспалительной реакции, элиминации патогена и восстановлению
структуры поврежденной ткани [1]. Высокое содержание ИЛ-10 при БВ в I триместре беременности, вероятно, связано с реализацией регуляторной функции на фоне активной продукции провоспалительных цитокинов.
Следует отметить, что из всех исследованных цитокинов особого внимания заслуживает ИЛ-6, точнее, характер изменения его содержания (см. рисунок). Динамика его при нормомикроценозе совпадает с динамикой при БВ, однако становится очевидным его повышенное содержание у беременных с БВ во всех триместрах беременности. Известно, что ИЛ-6 вырабатывается различными клетками, в том числе децидуальными клетками и амниоцитами, и является маркером внутриутробного инфицирования [3].
Однако перинатальные исходы у женщин с БВ не отличались от таковых в контрольной группе. Повышенный уровень провоспалительных цитокинов в цервикальном секрете наблюдается у женщин с привычным невынашиванием беременности. Обнаружение выраженных отличий в содержании этого цитокина в цервикальном секрете, по нашим данным, не означает наличия внутриутробной инфекции.
Результаты, полученные при определении ИЛ-2 и ИЛ-4 в цервикальной слизи при БВ, свидетельствуют о достоверном снижении содержания обоих цитокинов после лечения с сохранением минимальных концентраций к родам. О достоверных отличиях между группами и динамике ИЛ-2 и ИЛ-4 при нормомикроценозе влагалища говорить сложно в связи с малым числом исследований этих цитокинов в данной группе беременных.
Таким образом, анализ полученных результатов показал, что содержание про- и противовоспалительных цитокинов в отделяемом цервикального канала у беременных с БВ достоверно выше, чем в группе сравнения, на этапе, предшествуюшем медикаментозному лечению. Наблюдаемая при данной патологии потеря функции влагалища проявляется в активации местного иммунитета с секрецией молекул, оказывающих аутокринное, паракринное и эндокринное влияние. Выявление данных молекул в цервикальной слизи не означает, что они активны в ней. Вероятно их опосредованное действие на клетки иммунной системы и рецепторный аппарат клеток, формирующих слизистую оболочку влагалища и эндоцервикса. При устранении защитного барьера, которым являются лактобактерии, создаются условия для несбалансированной продукции цитокинов и как следствие для формирования микросреды, в которой происходит изменение конечных продуктов обмена клеток, что сказывается на качестве и составе выделяемой слизи. С учетом этого ремоделирование цервикса, происходящее при беременности и перед родами, может иметь особенности у беременных с БВ. Дисбиотические нарушения во влагалище приводят к снижению функционального резерва клеток и вследствие этого к изменению их метаболической активности.
В свою очередь изменение синтеза белка клетками эндоцервикса приводит к варьированию
соотношения фракций растворимого и нерастворимого коллагена в тканях и в итоге к изменению (ухудшению) биомеханических свойств шейки матки [17].
Считается, что нарушенный баланс микрофлоры влагалища может спонтанно нормализоваться
без назначения корригирующей терапии. Однако возникающее при беременности состояние иммуносупрессии, которое обусловливает иммунную толерантность матери к аллоантигенам плода,
способствует активации латентной инфекции и условно-патогенной микрофлоры, присутствующей во влагалище. В большинстве случаев системные эффекты, возникающие вследствие развития восходящей инфекции, в отношении внутренних половых органов и органов малого таза, не находят развития. Но развиваются локальные иммунные реакции, центральным звеном которых является цитокиновый каскад [2]. Качественные и количественные изменения в уровнях цитокинов отражают степень активации иммунокомпетентных клеток при любом патологическом процессе. Полученные в данном исследовании результаты отражают определенную автономность иммунных реакций в нижних
отделах половых путей женщины.



