Вирусы папилломы человека (ВПЧ) высокого канцерогенного риска (ВКР) являются главным этиологическим фактором рака шейки матки (РШМ) [21]. ВПЧ ВКР обнаруживают в 96,4–99,7% образцов опухолевой ткани шейки матки [7, 15, 19]. Возникновению РШМ предшествуют в течение многих лет предраковые эпителиальные повреждения – цервикальные интраэпителиальные неоплазии (cervical intraepithelial neoplasia, CIN), отражающие этапы вирусного канцерогенеза. Условно выделяют три степени CIN, соответствующие легкой (CIN1), умеренной (CIN2), тяжелой дисплазии и преинвазивному раку (CIN3).
Если CIN1, относящиеся к легким эпителиальным повреждениям, имеют высокую вероятность спонтанной регрессии (до 60%), то тяжелые повреждения – CIN2–3, включая преинвазивный
рак (carcinoma in situ, CIS), – регрессируют редко, имеют высокую вероятность исхода в инвазивный рак (до 37,5%) и требуют хирургического лечения в виде деструкции или эксцизии зоны трансформации [10, 18].
ВПЧ ВКР использует природный пролиферативный потенциал естественного метапластического процесса в зоне трансформации, чаще в сторону плоскоэпителиальной дифференцировки [2]. Длительно персистируя и размножаясь в стволовых и амплифицирующихся резервных клетках зоны трансформации шейки матки, ВПЧ ВКР стимулирует чрезмерную пролиферацию, генетическую нестабильность, нарушает репарацию ДНК и апоптоз, имморализирует незрелые эпителиальные клетки, формируя CIN [8, 12].
Таким образом, ВПЧ ВКР не только инициирует CIN, но и поддерживает прогрессию неоплазии до инвазивного рака.
Существуют иммунологические проблемы, специфичные для ВПЧ-инфекции, ассоциированной с CIN, такие как:
1) нейтрализация белком Е7 противовирусной и противоопухолевой активности интерферона-α2;
2) низкая антиген-презентация вирусов, отсутствие виремии;
3) ингибирование белком Е7 экспрессии генов
основного комплекса гистосовместимости;
4) медленный и в малом количестве синтез капсидных белков, обеспечивающих иммуногенность;
5) нарушение продукции интерлейкинов [13].
В связи с этим разрабатываются варианты консервативного лечения ВПЧ-инфекции – иммуномодулирующей терапии [5, 17].
Основным диагностическим и лечебным мероприятием при CIN2–3/CIS является адекватное изъятие зоны трансформации с очагами неоплазии, в частности, в виде различных вариантов петлевой эксцизии – электро- или радиохирургической (loop electrosurgical excision procedure – LEEP/large loop excision of the transformation zone – LLETZ). Максимальным вариантом LLETZ является конизация, глубина которой все же может оказаться недостаточной для изъятия всех очагов CIN [5], так как объем вмешательства определяется эмпирически по размерам поражения эктоцервикса, не всегда отражающим большую глубину распространения по эндоцервикальным криптам [2, 3]. Очаги персистирующей ВПЧ-инфекции находятся и вне иссекаемой зоны трансформации (в том числе в эпителии влагалищных стенок), являясь источником новых вирионов [2].
Все это патогенетически оправдывает применение иммуномодуляторов не только для лечения продуктивной ВПЧ-инфекции, но и в комплексной терапии CIN тяжелой степени. Применение иммуномодуляторов оправдано с целью уменьшения количества реплицирующегося вируса.
Аллокин-альфа — отечественный противовирусный препарат нового типа с локальным иммуномодулирующим действием (фармакотерапевтическая группа: противовирусное, иммуномодулирующее средство). Действующим веществом препарата является цитокиноподобный пептид аллоферон, представитель нового семейства противовирусных пептидов природного происхождения. [1, 6] Его действие направлено на усиление распознавания вирусных антигенов и
инфицированных клеток натуральными (естественными) киллерами, нейтрофилами и другими эффекторными системами естественного иммунитета, ответственными за элиминацию вируса. Препарат усиливает антиген-презентацию вируса.
В отличие от известных индукторов интерферона (ИФН) аллокин-альфа выступает в качестве кофактора, позволяя продуцирующим ИФН-α лейкоцитам эффективно реагировать на вирусный антиген. Анализ изменений иммунного ответа после лечения аллокином-альфа больных гепатитом С выявил нормализацию титров циркулирующего в сыворотке крови (90%) и спонтанно вырабатываемого ИФН (80%), увеличение продукции ИФН-α и ИФН-γ, появление мРНК фактора некроза опухоли-α, интерлейкина (ИЛ)-12, ИЛ-4 и снижение встречаемости ИЛ-6 и ИЛ-10, увеличение или восстановление функциональной активности Т-лимфоцитов с нормализацией ответа по Th1-типу [1].
Характеристики общего иммунитета, безусловно, отражающие улучшение иммунного статуса, показательны в случае гепатитов В и С, сопровождающихся виремией. Однако инфекция ВПЧ ВКР развивается в пределах эпителиального пласта, и виремия отсутствует, поэтому эффективность лечения CIN целесообразно оценивать по динамике вирусной нагрузки (ВН), определяемой с помощью методики гибридного захвата ДНК ВПЧ ВКР (Hybride capture 2 DNA HPR-HR, HC2, Digene/Qiagen). HC2 ВПЧ-тест получил признание во многих развитых странах [9, 14, 16, 20]. НС2 – полуколичественный метод, материал для которого забирают именно из зоны трансформации шейки матки или ее остатков
после эксцизии. Результат отображается в относительных световых единицах (relative light units,
RLU), определяются только клинически значимые концентрации вируса [11]. В отличие от легких эпителиальных повреждений, при которых в процессе спонтанной элиминации можно ожидать снижения ВН без лечения, тяжелым CIN не свойственна регрессия и нет оснований для изменений ВН без лечения. Показателем эффективности иммуномодулирующей терапии у больных CIN2–3/CIS будет снижение ВН в зоне трансформации до эксцизионных манипуляций на шейке матки. Короткая отсрочка эксцизии на один – два менструальных цикла, вполне обычная для лечения таких пациенток на фоне многолетнего существования CIN2–3/CIS, не может сказаться на прогнозе заболевания.
Цель исследования – оценить эффективность предэксцизионной противовирусной и иммуномодулирующей терапии аллокином-альфа в комбинированном лечении больных CIN2–3/CIS по изменению вирусной нагрузки HC2.
Материал и методы исследования
В исследование с информированного согласия были включены 32 больные CIN2–3/CIS (8 больных
CIN2, 24 – CIN3/CIS), получавшие предэксцизионную терапию аллокином-альфа, а также 28 больных
контрольной группы (6 – CIN2, 22 – CIN3/CIS), у которых конизация была отсрочена на 40–60 дней
по личным обстоятельствам. У всех пациенток процесс был гистологически верифицирован. Все больные были дважды обследованы цитологически, кольпоскопически и вирусологически методом
гибридного захвата (HC2) – в момент первичного осмотра и через 40–60 дней перед выполнением
радиохирургической конизации после лечения аллокином-альфа в основной группе или без иммуномодулирующего лечения в контрольной группе. Все больные были ВПЧ ВКР-позитивны, и основным критерием включения в исследование была вирусная нагрузка не менее 20 RLU. В основной группе средний возраст больных составил 33,4±1,7 года. Преобладающим типом ВПЧ был 16 – у 26 пациенток из 32.
Аллокин-альфа вводили по 1 ампуле на 1 мл физиологического раствора для инъекций подкожно 1 раз в 48 ч – всего 6 инъекций. Группа контроля – 28 больных CIN2–3/CIS, не получивших перед радиохирургической конизацией лечения иммуномодуляторами, была сравнима по возрасту (32,8±1,6 года), степени неоплазии (6 больных – CIN2, 22 – CIN3/CIS), типу вируса, состоянию репродуктивной функции и другим факторам с группой больных, которым было выполнено предоперационное лечение аллокином-альфа (p>0,05).
Статистический анализ результатов проводили непараметрическим методом (парный критерий
Wilcoxon), в качестве центральной характеристики HC2-теста применяли медиану, в качестве меры
разброса значений – квартили.
Результаты исследования и обсуждение
Побочных эффектов, аллергических реакций и осложнений от введения препарата аллокин-альфа
не наблюдалось.
Исходные значения HC2 у больных CIN2–3/CIS до лечения колебались от 24 до 2047 RLU. Медиана
составила 340 RLU. При этом у 4 (12,5%) больных значения были менее 50, у 5 (15,6%) – 51–100,
у 6 (18,8%) – 101–300, у 11 (34,4%) – 301–1000 и у 6 (18,8%) более 1000 RLU.
После лечения аллокином-альфа значения НС2 значимо снизились (р=0,035), при этом наблюдали
снижение медианы в 5 раз (340 и 68 ед. соответственно), снижение нижней квартили в 9 раз (91,5 и
10 единиц соответственно), в то же время верхняя квартиль до и после лечения не изменилась (905 и
909 ед. соответственно). НС2 после лечения аллокином-альфа стал отрицательным у 3 (9,4%) больных,
у 8 (25%) больных значения стали низкими – менее 50 RLU, у 6 (18,8%) значения теста были в пределах от 51 до 100 RLU, по 5 (15,6%) больных было со значениями теста 101–300, 301–1000 и >1000 RLU. Таким образом, частота выявления значений НС2 менее 50 RLU после лечения увеличилась с 12,5 до 34,4%, а более 300 RLU уменьшилась с 53,2 до 31,2%, различия значимы (р=0,018) (рис. 1).
Рисунок 1. Частота выявления различных значений CH2 у больных CIN2-3/CIS до и после лечения аллокином-альфа.
ВН до лечения в группе больных, ответивших снижением ВН, колебалась от 24 до 2047, а после
лечения – от 0 до 1570. До лечения в этой группе ВН до 100 RLU имели 8 больных, от 101 до 500 RLU –
7 больных и более 501 RLU – 8 больных. После лечения в первой подгруппе число больных увеличилось до 16, во второй и третьей уменьшилось до 3 и 4 соответственно, то есть после лечения аллокином-альфа больные «перешли» из группы с высокой и средней ВН в группу с низкой ВН. Изменение числа больных с уменьшением вирусной нагрузки статистически значимо (p<0,05).
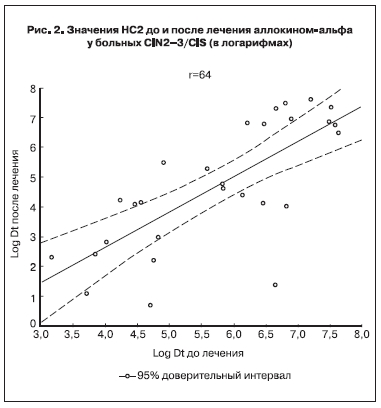
У больных CIN2–3/CIS выявлена прямая достоверная корреляционная зависимость между исходными уровнями HC2 и таковыми после лечения (r =0,64; p=0,0001; рис. 2, см. на вклейке, значения HC2 представлены в логарифмах для наглядности). При этом важно отметить, что у 23 (71,9%) из 32 больных CIN2–3/CIS через 2 мес после лечения аллокином-альфа выявлено снижение ВН, у 1 больной значение HC2 не изменилось, у 8 – выросло. Частота снижения ВН (71,9%) значимо превысила частоту отсутствия эффекта (28,1%) (р<0,001).
В группе контроля из 28 больных, не получавших лечение аллокином-альфа, у 26 выявлено повышение HC2, у 2 – значения теста не изменились, снижение ВН не отмечено ни у одной больной (рис. 3, см. на вклейке). Таким образом, частота снижения HC2 в группе больных CIN2–3/CIS, получавших аллокин-альфа, составила 71,9% (95% ДИ 53,2–86,2%), а в группе контроля – 0% (95% ДИ 0–15,9%), различия высоко значимы (р<0,0001).
Следует отметить, что медиана величины снижения HC2 у 23 больных CIN2–3/CIS, ответивших на
лечение аллокином-альфа до конизации, составила 107 RLU (абсолютная величина снижения) или в
3,3 раза от исходного уровня. Медиана повышения HC2 у 7 больных, не ответивших на аллокин-альфа,
составила 421 RLU (абсолютная величина повышения) или в 1,7 раза, различия значимы (p>0,05), то
есть снижение ВН было более выраженным, чем повышение.
Не выявлено связи частоты эффекта с такими факторами, как возраст, длительность заболевания,
число половых партнеров, родов, абортов, курениe, прием оральных контрацептивов, степень CIN.
При анализе связи частоты наступления эффекта с исходными уровнями HC2 обнаружено, что в группе
с низкими значениями HC2 менее 100 RLU эффект наступал наиболее часто – у 88,9% больных (8 из 9).
Частота наступления эффекта у больных с исходными значениями HC2 до 300 RLU снизилась до 80%
(4 из 5) и была наименьшей у больных с исходными значениями более 300 RLU – 64,7% (11 из 17 больных). Имеется тенденция к меньшей частоте эффекта при высоких значениях ВН (р=0,058). Медиана значений теста у больных с отсутствием эффекта была более чем в 3 раза больше по сравнению с группой больных, имевших эффект.
У 9 больных основной группы при кольпоскопии после лечения аллокином-альфа наблюдалось некоторое уменьшение площади поражения и толщины ацетобелого эпителия. У 5 из 8 больных, имевших кондиломы вульвы, отмечено их исчезновение. У 7 больных отмечено изменение результатов цитологического исследования – уменьшение тяжести повреждений от HSIL/LSIL до ASCUS или нормы. У больных контрольной группы изменений площади поражения, улучшения результатов цитологических исследований не наблюдалось.
В то же время не обнаружено корреляционной зависимости между видимой площадью поражения шейки матки и значением HC2 до лечения аллокином-альфа (r=0,16). Это связано с тем, что при небольшой видимой площади поражения шейки высокая ВН HC2 отражает возможное поражение CIN канала шейки матки.
У всех больных, независимо от величины ВН перед операцией, через два мес после эксцизии НС2-тест
был отрицательным. Таким образом, решающее значение в лечении CIN имеет адекватное изъятие зоны трансформации, однако противовирусное и иммуномодулирующее лечение оправдано патогенетически для воздействия на очаги репликации вируса и даже фокусы CIN, которые могут сохраняться в остатках зоны трансформации после эксцизии.
Исследование контрольной группы больных CIN2–3/CIS показало, что тяжелые CIN, которым
не свойственна регрессия, отличаются стабильной или прогрессивно растущей ВН. Снижение ВН в
зоне трансформации после лечения аллокиномальфа у большинства больных CIN2–3/CIS свидетельствует об эффективности иммуномодулирующего лечения продуктивной вирусной инфекции, вызванной ВПЧ ВКР. Если эффект от лечения получен у больных CIN тяжелых степеней, то тем более его можно ожидать у пациенток с легкими повреждениями, персистирующей и транзиторной папилломавирусной инфекцией.
Таким обазом, проведенное исследование по изменению показателей HC2-теста у больных CIN2–3/CIS под влиянием аллокина-альфа показало снижение ВН у большинства пациенток (71,9%). При этом в группе без лечения ВН не снизилась ни у одной больной, у 26 из 28 отмечен ее рост.
Лечение аллокином-альфа может быть эффективно в предоперационной подготовке больных CIN2–
3/CIS перед процедурой эксцизии зоны трансформации или конизации и приводит к снижению ВН
у большинства больных. Фактически, уменьшение ВН является отражением лечебного действия на
продуктивную папилломавирусную инфекцию, инициирующую, сопровождающую и поддерживающую CIN. Возможно также применение препарата с целью уменьшения ВН, индукции элиминации
вируса у больных с ВПЧ-инфекцией и CIN легкой степени. Планируется дальнейшее исследование с
увеличением числа больных CIN разной степени.



