Несмотря на свое название, железодефицитная анемия (ЖДА) не является исключительно результатом дефицита только железа [1]. Сложность молекулярных механизмов синергизма железа с микронутриентами приводит к тому, что данный вопрос остается без внимания большинства врачей. Существует по меньшей мере четыре заблуждения, связанные с нехваткой информации по основам молекулярной биологии, физиологии, биохимии и фармакологии.
Во-первых, гомеостаз железа поддерживается 1760 белками протеома человека, уровни которых зависят от экспрессии соответствующих генов [2]. На экспрессию генов влияют многочисленные факторы генетики (полиморфизмы генов, кодирующих белки гомеостаза железа) и факторы внешней среды (поступление витаминов – прежде всего фолатов, цинка и др.). Поэтому, даже если пациентки характеризуются достаточным поступлением железа в организм, у них, тем не менее, риск развития ЖДА может быть повышен.
Во-вторых, результаты детального анализа протеома человека позволяют утверждать, что биологические роли белков гомеостаза железа осуществляются не только при участии ионов железа, но также и гема, и железосерных кластеров 4Fe-4S. Белки гомеостаза железа нуждаются в ионах Cu2+, Mn2+, Zn2+, производных молибдена, витамина В9 (фолиевая кислота), витамина В2, витамина В6, витамина РР, L-аскорбата и др. [2]. Дефициты соответствующих микронутриентов будут снижать активность белков/ферментов гомеостаза железа и повышать риск ЖДА.
В-третьих, субстанция, лежащая в основе того или иного препарата железа, в существенной мере определяет эффективность и безопасность его использования.
В-четвертых, фармакологические показатели всасывания железа определяются присутствием в пище/растворе ионов цинка [3], хелаторов железа (фитиновая кислота и др.), содержанием в пище насыщенных жиров, кислотностью желудочного сока, наличием у пациентки заболеваний желудочно-кишечного тракта [4]. Дефициты железа, фолатов, рибофлавина, витамина В12 вызываются пероральным приемом антибиотиков, эстрогенсодержащих и ряда других препаратов [5].
В настоящей работе представлены результаты системно-биологического анализа синергизма между железом и фолатами – двумя микронутриентами, наиболее часто использующимися для нутрициальной поддержки беременности. Систематический компьютерный анализ литературы был проведен в рамках топологического подхода к распознаванию школы Ю.И. Журавлева [6].
В рамках системно-биологического подхода синергизм между любыми двумя микронутриентами рассматривается с трех точек зрения: (1) воздействие обоих микронутриентов как кофакторов на один и тот же белок протеома человека; (2) воздействие обоих микронутриентов на один и тот же молекулярный каскад/процесс; (3) физиологический синергизм, т.е. воздействие на один и тот же физиологический процесс (дыхание, кроветворение, регенерация тканей и др.) [1].
Анализ кофакторов
Анализ 20 500 белков, формирующих протеом человека, показал, что только два белка (а именно, транспортер фолатов SLC46A1 и АТФ-кассетный транспортер ABCG2) непосредственно взаимодействуют и с фолатами, и с ионами железа. Транспортер SLC46A1 может переносить и фолаты, и гем, тем самым увеличивая содержание железа в клетке. Рассмотрим более подробно воздействие обоих микронутриентов на молекулярные каскады и физиологические процессы.
Воздействие на один и тот же молекулярный каскад
В работе по молекулярной фармакологии синергистов железа [2] был установлен список наиболее типичных молекулярных ролей железа, включающий 36 категорий Gene Ontology (GO). Более детальный анализ указал на то, что функциональная категория белков «GO:0006749 Метаболизм глутатиона» является центральным механизмом осуществления синергизма между железом и фолатами.
Важнейший антиоксидантный фермент глутатионпероксидаза-1 (ген GPX1) опосредует синергидные эффекты фолатов и железа. Этот важнейший фермент в защите оксидативного стресса мембран клеток относится к функциональной категории «GO:0006749 Метаболизм глутатиона» и катализирует восстановление гидроперекисей липидов в соответствующие спирты, одновременно восстанавливая перекись водорода до воды, тем самым защищая ткани организма матери и плода от повреждающего воздействия перекисного окисления липидов (ПОЛ) и токсических продуктов метаболических превращений. Снижение активности глутатионпероксидазы-1 приводит к усилению ПОЛ, повреждению клеток, хроническому системному воспалению и прогрессированию гипоксии плода и беременной женщины. Кроме того, сниженная глутатионпероксидазная защита сопутствует развитию токсикоза беременных, провоцирует тошноту, рвоту у беременных, особенно у женщин с нарушениями рациона питания.
Как известно, дефицит фолатов ассоциирован с гипергомоцистеинемией, которая стимулирует развитие хронического системного воспаления, приводящего к атеросклеротическим поражениям сосудов плаценты, тромбообразованию, что провоцирует невынашивание, хроническую фетоплацентарную недостаточность, хроническую внутриутробную гипоксиию плода, нефропатию и преэклампсию. Кроме того, избыточный уровень гомоцистеина в крови подавляет синтез внутриклеточной глутатионпероксидазы-1, активность которой еще более падает на фоне недостаточного потребления железа и фолиевой кислоты [7]. В результате дефицит фолатов существенно усиливает окислительный стресс в печени, плаценте и в головном мозге беременной, а также в головном мозге плода [8].
С другой стороны, к функциональной категории «GO:0006749 Метаболизм глутатиона» также относятся белки, участвующие в гомеостазе железа: персульфид диоксигеназа; каналы-транспортеры; глутаредоксины.
Железосодержащая персульфид диоксигеназа ETHE1 участвует в синтезе глутатиона из сульфанилглутатиона и обезвреживает дисульфид серы H2S. Каналы-транспортеры глутатиона SLC25A39 и SLC25A40 участвуют в транспорте глутатиона в митохондрии, что необходимо для активности и стабильности митохондриальных белков, содержащих железо-серные кластеры. Глутатионсвязывающие глутаредоксины GLRX2 и GLRX5 способствуют поддержанию митохондриального окислительно-восстановительного гомеостаза и необходимы для переноса железо-серных кластеров внутрь митохондрий. Общеизвестно, что железо-серные кластеры – эссенциальные кофакторы белков, обеспечивающих окислительно-восстановительные реакции в клетке (ферменты цикла Кребса, дыхательной электрон-транспортной цепи и др.).
Таким образом, фолиевая кислота, устраняя гипергомоцистеинемию, восстанавливает активность глутатионпероксидазы-1. Глутатион для работы этого фермента синтезируется при участии железосодержащей персульфид диоксигеназы. Следовательно, фолиевая кислота и железо критически необходимы для биосинтеза глутатиона и использования синтезированных молекул глутатиона в антиоксидантных процессах (в частности, для обезвреживания токсичного соединения H2S, концентрации которого повышаются у беременных с метаболическими нарушениями печени).
Синергизм фолатов и железа на уровне физиологических процессов человека
Для оценки механизмов синергидного действия железа и фолатов в контексте физиологии человека мы провели системный анализ текстов 6219 научных публикаций, найденных по запросу «iron and (folates OR folic)» в базе данных PUBMED. При сравнении с данными для контрольной выборки текстов (научные публикации по микронутриентам у беременных) с использованием онтологии «SNAP» [9] были выделены тематические рубрики и молекулярно-биологические механизмы, ассоциированные с номенклатурой GO (Gene Ontology) [10]. В результате была получена карта молекулярно-физиологических эффектов железа и фолатов (рис. 1).
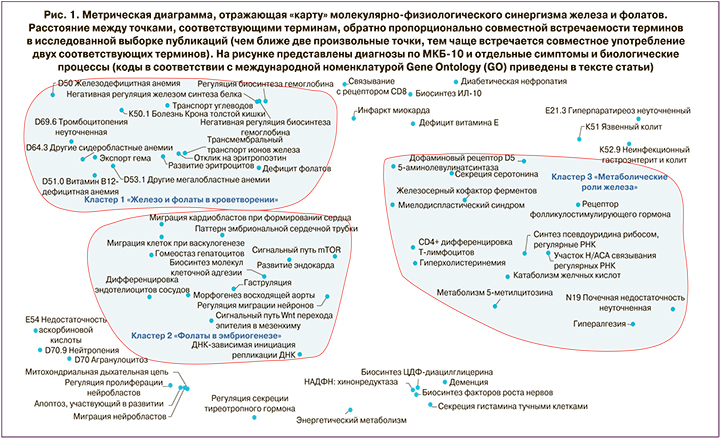
Анализ диаграммы на рисунке 1 алгоритмом метрических сгущений [6] выявил три кластера терминов:
- кластер 1 «Железо и фолаты в кроветворении»;
- кластер 2 «Фолаты в эмбриогенезе»;
- кластер 3 «Метаболические роли железа».
Детальный анализ публикаций, соответствующий терминам в установленных кластерах, подтвердил, что кластеры 2 и 3 описывают исключительно эффекты фолатов и железа по-отдельности. Внекластерные термины относятся в основном либо к патологиям, связанным с формированием микронутриентных дефицитов (диабетическая нефропатия, K51 Язвенный колит, N18.9 Хроническая болезнь почки и др.), либо к последствиям дефицитов фолатов и железа (GO:0015980 Энергетический метаболизм, GO:0097250 Митохондриальная дыхательная цепь, инфаркт миокарда, деменция, GO:0097402 Миграция нейробластов, GO:1902692 Регуляция пролиферации нейробластов и др.). Поэтому молекулярно-физиологический синергизм между фолатами и железом описывается исключительно терминами из 1-го кластера.
Термины в кластере 1 «Железо и фолаты в кроветворении» очевидным образом подразделяются на термины, относящиеся к эффектам железа (D50 Железодефицитная анемия, D64.3 Другие сидеробластные анемии, GO:0034755 Трансмембранный транспорт ионов железа, GO:0046984 Регуляция биосинтеза гемоглобина, GO:004698 Негативная регуляция биосинтеза гемоглобина, GO:0097037 Экспорт гема) и к терминам, описывающим эффекты фолатов (D51.0 Витамин-B12-дефицитная анемия, D53.1 Другие мегалобластные анемии, D69.6 Тромбоцитопения неуточненная, дефицит фолатов, GO:0036017 Отклик на эритропоэтин, GO:0048821 Развитие эритроцитов). Однако обе группы терминов соответствуют единому молекулярно-физиологическому процессу: эритропоэзу.
Анализ терминологической карты на рисунке 1 позволил выделить наиболее интересные для дальнейшего обсуждения направления этого синергизма: симптоматика и молекулярная патофизиология ЖДА, роли фолатного дефицита, дисфункция щитовидной железы и гипергликемия. В заключение рассмотрены перспективы применения фумарата железа в профилактике и терапии ЖДА.
Симптоматика и молекулярная патофизиология железодефицитной анемии
Клиническая картина ЖДА сложна и зачастую индивидуальна для каждой пациентки, поэтому для повышения надежности диагностики используются результаты биохимического анализа крови. Общеизвестные симптомы ЖДА включают повышенную утомляемость, сердцебиение, одышку даже при умеренной физической нагрузке, боли в груди, пониженное артериальное давление, шум в ушах, головные боли, головокружение и обмороки. Недостаточная обеспеченность железом приводит к гипоксии тканей и нарушает функции сердца, сосудов, кишечника и мозга. Характерные симптомы недостаточности железа включают сухость, истонченность и бледность кожи, голубоватые круги под глазами, синеву склер, тусклость и исчерченность ногтевой пластинки, ломкость ногтей, «заеды» в углах рта, воспаление и утрату вкусовой чувствительности сосочков языка, воспаление десен, нарушения иммунитета и повышенную склонность к бронхолегочным заболеваниям. Из вышесказанного очевидно, что центральный симптомокомплекс ЖДА обусловлен резким снижением насыщенности тканей кислородом.
Специфическими лабораторными признаками ЖДА являются низкий гемоглобин (<100 г/л), гипохромия эритроцитов (более 10%), гипоферритинемия (<10 мкг/л) и уменьшение коэффициента насыщения трансферрина (<15%). ЖДА может сопровождаться недостатком ретикулоцитов, тромбоцитов и лейкоцитов.
Ионы железа, входя в состав простетической группы гема, принципиально необходимы для биосинтеза белка-транспортера кислорода, гемоглобина. Кроме того, биохимические каскады синтеза гема не могут функционировать на фоне дефицитов пиридоксина, ниацина, пантотеновой кислоты, цинка и других микронутриентов. Биологические роли гемоглобина осуществляются только в составе эритроцитов, поэтому ЖДА может возникать вследствие дисбаланса эритропоэза и гемолиза.
Хорошо известно, что скорость и качество эритропоэза определяются интенсивностью деления клеток-предшественников эритроцитов и зависят от обеспеченности организма фолиевой кислотой. Поэтому для терапии и профилактики анемии нужны не только железо, но и такие стимуляторы эритропоэза, как фолаты.
Роли фолатного дефицита в формировании анемии
Клиническая картина недостаточной обеспеченности фолатами (витамин В9) проявляется бледностью кожи, отсутствием аппетита, глоссалгией, снижением массы тела, утомляемостью, перебоями в сердце и неустойчивостью настроения [4]. Симптоматика гиповитаминоза В9 развивается в течение 2–3 месяцев. Острый гиповитаминоз В9возможен при приеме препаратов-антагонистов фолатов (антивитаминов В9): метотрексат, алюмогидратные и фосфатные антациды, сульфаниламиды и другие антибиотики, эстрогены и алкоголь. Острый гиповитаминоз В9 проявляется тошнотой, атрофическим гастритом, изъязвлением слизистой рта, алопецией. С биохимической точки зрения дефицит фолатов сопровождается понижением уровня фолатов в сыворотке и в эритроцитах. При использовании иммуноферментного метода референсные значения совокупности всех форм фолатов в сыворотке крови составляют 7,2–15,4 нг/мл.
Биохимические циклы биосинтеза фолатов и метаболизма метионина сопряжены через В12-зависимый фермент метионинсинтетазу (рис. 2). Молекулы S-аденозилметионина являются метилсодержащим субстратом, необходимым для метилирования внутриклеточных молекул. Таким образом, биологические эффекты фолатов обусловлены, во-первых, обезвреживанием цитотоксического гомоцистеина и синтезом субстрата метилирования S-аденозилметионина.
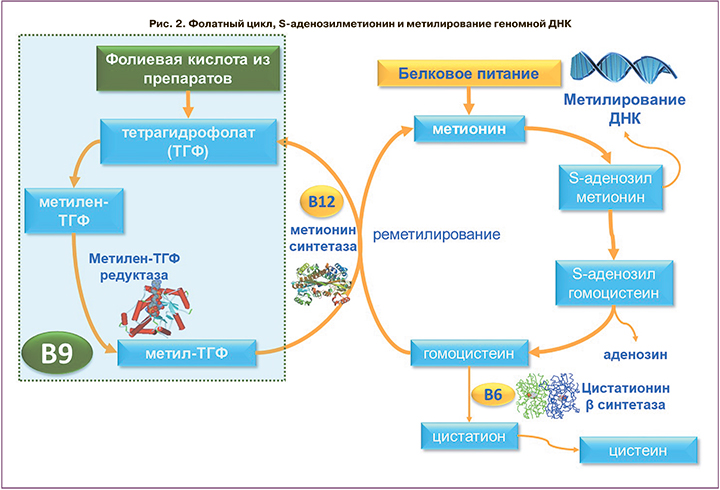
Аберрантное метилирование ДНК замедляет процессы деления и дифференцировки клеток, особенно быстроделящихся (эпителий кишечника, клетки тканей эмбриона, гепатоциты). Этиопатогенез фолат-дефицитной анемии включает аберрантное метилирование ДНК генома мегакариобластов, что с неизбежностью затормаживает процесс кроветворения в мегалобластической фазе, и эритропоэз ингибируется на стадии так называемых гигантских невызревших эритроцитов. Мегакариобластические эритроциты нестойки, что приводит к росту концентраций билирубина крови. Любая недостаточность фолатов будет провоцировать нарушения формирования эритроцитов, так что фолаты являются несомненным синергистом железа в поддержании эритропоэза.
Дисфункция щитовидной железы на фоне сочетанного дефицита фолатов и железа
Гормоны щитовидной железы стимулируют пролиферацию предшественников эритроцитов через усиление продукции эритропоэтина, а ЖДА отрицательно влияет на уровни тиреоидных гормонов. Поэтому во время беременности ЖДА часто сопровождается дисфункцией щитовидной железы. На фоне дисфункции щитовидной железы наиболее часто встречается нормоцитарная анемия, реже – фолатзависимая макроцитарная. Анемия при гипотиреозе может быть результатом угнетения красного ростка костного мозга, снижения продукции эритропоэтина, сопутствующих заболеваний, а также сопутствующих дефицитов железа, витамина B12 и/или фолатов [11]. У пациентов с антителами к тиреоглобулину или с микросомальными антителами к щитовидной железе часто отмечаются дефициты железа, витамина B12 и дефицит фолатов, ассоциированный с гипергомоцистеинемией [12].
Гипергликемия и сочетанные дефициты железа и фолатов
В дополнение к тиреоидной дисфункции гипергликемия является еще одним широко распространенным фактором, отрицательно влияющим на обмен фолатов и железа в организме беременной. Женщины с индексом массы тела более 30 кг/м2 характеризуются повышенным риском гипергликемии на фоне сниженного суточного потребления витамина D3, железа и фолатов [13].
Следует подчеркнуть существование взаимосвязи между диетой с более высокой гликемической нагрузкой и сниженным потреблением полезных микронутриентов (в т.ч. фолатов и железа) у женщин репродуктивного возраста [14].
Заметим, что использование сахарозаменителей (сахарин и т.п.) может приводить к токсическим эффектам, сопоставимым с дефицитами фолатов и железа у беременных. Негативные эффекты сахарина на течение беременности можно было предотвратить с помощью дополнительных дотаций железа и фолатов [15].
О важности применения фумарата железа для компенсации железодефицитной анемии
Железосодержащие комплексы для терапии ЖДА или для профилактики железодефицитных состояний во время беременности не должны содержать низкоактивные, «балластные» формы (окислы железа) и, тем более, токсичные формы (сульфат железа) [16].
В отличие от органических солей железа, неорганические соединения железа (оксиды, гидроксиды, сульфаты) не обладают высокой биодоступностью и существенно увеличивают нагрузку тканей нерастворимыми формами железа (гемосидероз). В частности, в работе [17] было проведено исследование препаратов неорганического железа (в частности, сульфата железа) у крыс. Пероральный прием сульфата железа в течение 2 месяцев вызывал хроническую перегрузку организма железом и гемосидероз, что отражалось как гистологически подтвержденные повреждения паренхимы печени, почек и головного мозга на фоне повышения концентрации АЛТ в крови и уровней белка в моче (рис. 3).
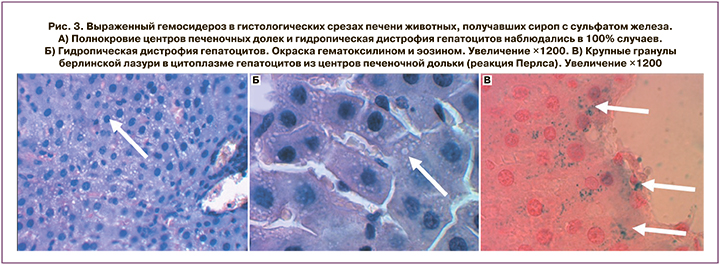
В целом биохимические и патоморфологические работы указывают на большую эффективность и безопасность органических солей железа для компенсации ЖДА [1, 4]. Среди солей железа с органическими аминокислотами одной из наиболее эффективных, безопасных и широко изученных является фумарат железа. В клинических наблюдениях за группой из 301 женщины с нормально развивающейся беременностью применение фумарата железа (20–80 мг/сут с 18-й недели по 8-ю неделю лактации) предупреждало развитие дефицита железа и ЖДА. Через 3,5 месяца прием фумарата железа предупредил формирование ЖДА у 97,3% участниц (дозы 20, 40 мг/сут) и у 100% участниц (дозы 60, 80 мг/сут). При приеме 20 мг/сут фумарата железа дефицит железа профилактировался у 95,3% родильниц, в дозе 40 мг/сут – у 97,1%, в дозе 60 или 80 мг/сут – у 100% [18].
Результаты рассмотренного выше исследования позволили сформулировать концепцию персонализированной профилактики дефицита железа посредством фумарата железа. При уровне ферритина <30 мкг/л беременным следует принимать 80–100 мг/сут фумарата железа, при уровне ферритина 31–70 мкг/л – 40 мг мг/сут, а при >70 мкг/л – 20 мг/сут [18]. Повышение дозы фумарата железа сглаживает «провал» уровней ферритина в динамике беременности [19] (рис. 4).
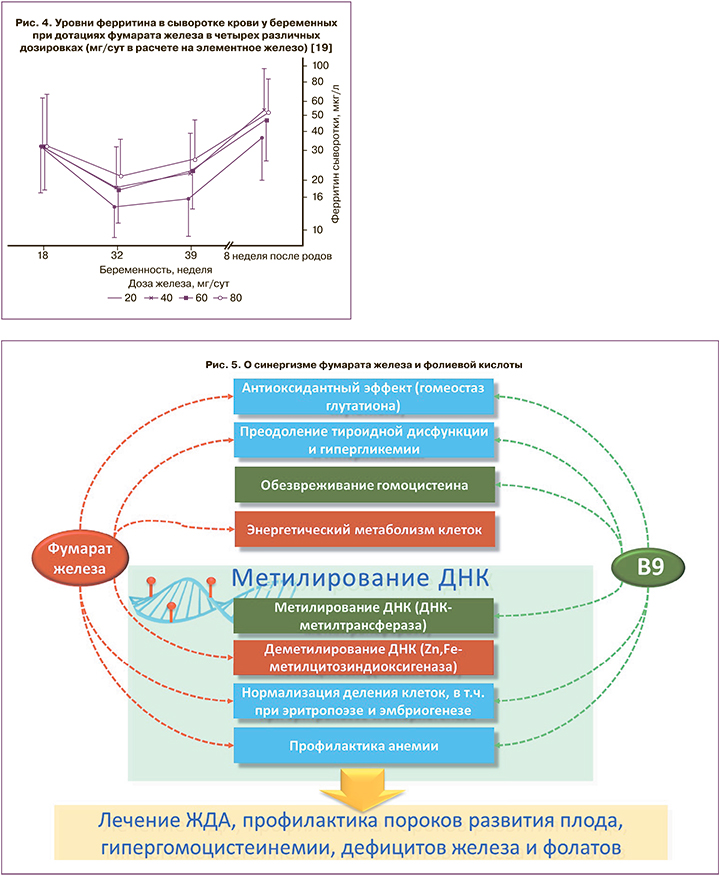
Обратим внимание, что использование фумарата железа во время беременности в дозах 20–80 мг/сут полностью безопасно и не вызывает тошноты или рвоты у беременных. К моменту родов жалобы на симптоматику со стороны желудочно-кишечного тракта (вспучивание живота, спастические боли в животе, потемнение фекалий, выраженные запоры, тошнота и др.) встречались с одинаковой частотой как у беременных, принимавших фумарат железа, так и в контрольной группе женщин [20].
В нашем метаанализе, включившем 11 независимых исследований фумарата железа у беременных (n=943, возраст 30±5 лет), подтверждены эффекты фумарата железа на снижение риска ЖДА (ОР 0,29; 95% ДИ 0,21–0,42; Р=6,9×10-11), микроцитоза (ОР 0,32; 95% ДИ 0,20–0,50; Р=1,2×10-5) и дефицита железа (ОР 0,29; 95% ДИ 0,19–0,45; Р=5,3×10-7) [21].
Препарат «Ферретаб» (ACINO, Швейцария) был использован в 8 из 11 клинических исследований, вошедших в метаанализ [21]. Одна капсула Ферретаба включает 3 микротаблетки, содержащие фумарат железа (суммарно 50 мг железа в расчете на химический элемент), и 1 микротаблетку фолатов (500 мкг фолиевой кислоты). Подобного рода технология приготовления капсулы необходима для того, чтобы поступление действующих веществ из микротаблеток осуществлялось постепенно, в течение 2–4 ч [22].
Таким образом, комбинация фумарата железа с фолиевой кислотой позволяет не только компенсировать дефицит железа, но и способствовать поддержке процессов эритропоэза, устранению гипергомоцистеинемии и профилактике фолатзависимых пороков развития плода (рис. 5).
Заключение
Приведенные в настоящей работе результаты системно-биологического анализа показывают, что молекулярный синергизм фолатов и железа обусловлен важностью обоих микронутриентов для эритропоэза, а также для биосинтеза и осуществления биологических эффектов антиоксидантного трипептида глутатиона.
К преимуществам фармацевтической субстанции фумарата железа относятся высокая безопасность (практически полное отсутствие нежелательных эффектов – в первую очередь тошноты и рвоты, характерных для приема препаратов на основе сульфата железа), высокая биодоступность железа (фумарат железа обеспечивает более быстрое всасывание железа внутрь клеток) и доказанная эффективность в лечении ЖДА.
Комбинация фумарата железа с фолиевой кислотой позволяет не только компенсировать дефицит железа, но и способствовать поддержке процессов эритропоэза, устранению гипергомоцистеинемии и профилактике фолатзависимых пороков развития плода.



