За последние десятилетия во всем мире отмечается неуклонный рост числа многоплодных беременностей [1–3], что может быть связано с бурным развитием вспомогательных репродуктивных технологий (ВРТ). Течение и исход многоплодной беременности были и остаются в целом менее благоприятными, чем одноплодной. Дополнительным фактором, ухудшающим прогноз при многоплодии, является монохориальный тип плацентации [1–6]. Помимо осложнений, характерных для многоплодия как такового, при монохориальном типе плацентации имеется риск возникновения такого специфического осложнения, как синдром фето-фетальной трансфузии (СФФТ). По данным разных авторов [2–4, 7–10], СФФТ различной степени тяжести осложняет от 5 до 25% беременностей с монохориальным типом плацентации, и, как правило, при развитии этого осложнения беременность заканчивается неблагоприятно, если не предпринимать никаких лечебных мероприятий.
 Механизм развития СФФТ достаточно хорошо изучен [2, 7–10]. СФФТ возникает при трансфузии крови через плацентарные сосудистые анастомозы между кровеносными системами двух плодов, вызывая анемию и гипоксию у «донора», а у плода – «реципиента» – полицитемию с перегрузкой кровообращения [6–12]. Реципиент компенсирует увеличенный объем крови полиурией [7, 8, 10, 13], но белок и клеточные компоненты остаются в кровотоке, в результате увеличенное коллоидное осмотическое давление способствует переходу воды к нему из материнского русла. Образуется порочный круг: гиперволемия, полиурия, гиперосмоляльность, которые приводят к развитию сердечной недостаточности и многоводию у реципиента [7, 8, 10, 12, 13]. При развитии СФФТ во II триместре беременности существует высокий риск перинатальной гибели или повреждения головного мозга вследствие комбинации таких факторов, как внутриутробная гипоксия плода и преждевременные роды. Более того, внутриутробная гибель одного из плодов (обычно донора) влечет за собой последующую гибель или гипоксически-ишемические осложнения у второго плода [10, 14, 15].
Механизм развития СФФТ достаточно хорошо изучен [2, 7–10]. СФФТ возникает при трансфузии крови через плацентарные сосудистые анастомозы между кровеносными системами двух плодов, вызывая анемию и гипоксию у «донора», а у плода – «реципиента» – полицитемию с перегрузкой кровообращения [6–12]. Реципиент компенсирует увеличенный объем крови полиурией [7, 8, 10, 13], но белок и клеточные компоненты остаются в кровотоке, в результате увеличенное коллоидное осмотическое давление способствует переходу воды к нему из материнского русла. Образуется порочный круг: гиперволемия, полиурия, гиперосмоляльность, которые приводят к развитию сердечной недостаточности и многоводию у реципиента [7, 8, 10, 12, 13]. При развитии СФФТ во II триместре беременности существует высокий риск перинатальной гибели или повреждения головного мозга вследствие комбинации таких факторов, как внутриутробная гипоксия плода и преждевременные роды. Более того, внутриутробная гибель одного из плодов (обычно донора) влечет за собой последующую гибель или гипоксически-ишемические осложнения у второго плода [10, 14, 15].
Появление в арсенале акушеров-гинекологов эндоскопов малого диаметра дало возможность проводить радикальное устранение этиологического фактора развития СФФТ – «разделение» кровеносных систем плодов путем фетоскопической лазерной коагуляции сосудистых анастомозов (ФЛКА).
Целью данного исследования была оценка эффективности фетоскопических вмешательств у пациенток с монохориальным типом плацентации при многоплодной беременности, осложнившейся развитием СФФТ.
Материал и методы исследования
На базе Центра планирования семьи и репродукции Департамента здравоохранения Москвы нами за период с 2005 года по настоящее время выполнена 61 ФЛКА по поводу СФФТ.
 Возраст пациенток колебался от 18 до 39 лет, первые роды предстояли 22 пациенткам, одни роды имели в анамнезе 26 пациенток, двое – 13. Из сопутствующей соматической патологии отмечались: хронический пиелонефрит (10), хронический цистит (5), анемия (2), нефроптоз (2), миопия средней степени (3), хронический тонзиллит (2). У 7 пациенток беременность наступила в результате ВРТ (ЭКО – 5, стимуляция овуляции – 2). Рубец на матке после кесарева сечения имели 6 пациенток, после миомэктомии – 2. Перенесли лапароскопическое вмешательство по поводу бесплодия 2 пациентки.
Возраст пациенток колебался от 18 до 39 лет, первые роды предстояли 22 пациенткам, одни роды имели в анамнезе 26 пациенток, двое – 13. Из сопутствующей соматической патологии отмечались: хронический пиелонефрит (10), хронический цистит (5), анемия (2), нефроптоз (2), миопия средней степени (3), хронический тонзиллит (2). У 7 пациенток беременность наступила в результате ВРТ (ЭКО – 5, стимуляция овуляции – 2). Рубец на матке после кесарева сечения имели 6 пациенток, после миомэктомии – 2. Перенесли лапароскопическое вмешательство по поводу бесплодия 2 пациентки.
Всем пациенткам проводилось ультразвуковое исследование (УЗИ) на аппарате экспертного класса «Siemens Antares» с обязательным включением, помимо фетометрии, допплерометрии кровотока в системе «мать-плацента-плод».
Для выполнения фетоскопии использовали комплект оборудования и инструментов фирмы «Kарл Шторц», АИГ-лазер «Дорнье». Следует особо отметить, что на первых этапах исследования мы не применяли для доступа в амниотическую полость троакары, а осуществляли проникновение через все слои непосредственно тубусом для фетоскопа со вставленным в него стилетом. Начиная с 2010 года доступ обеспечивали через отдельный троакар 3,9 и 4,7 мм. Диаметр троакара зависел от расположения плаценты: 4,7 мм использовался при локализации плаценты по передней стенке матки. Для коагуляции анастомозов использовали хирургический полупроводниковый АИГ-лазер «Dornier Medilas fibertom 5100» 1 mWt, устанавливали мощность 45–47 Ватт в режиме «лапароскопия+аблация». Перед началом непосредственно коагуляции в обязательном порядке определяли межплодовую перегородку и тщательно отслеживали все сосуды, пересекающие ее. Ход сосудов по возможности просматривали до зоны анастомозов, обращали внимание не только на количество анастомозов, но и на их направление (артерио-артериальные, вено-венозные, артерио-венозные) и диаметр сосудов.
Хирургическую коррекцию СФФТ осуществляли под регионарной (эпидуральной или спинальной) анестезией в условиях эндоскопической операционной при ультразвуковом мониторинге.
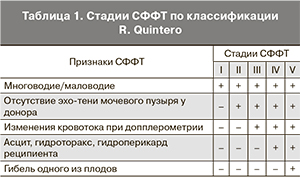
Стадию развития СФФТ устанавливали по данным УЗИ по классификации Quintero [16, 17] (табл. 1).
ФЛКА выполнялась при стадии заболевания не менее II и не более IV.
На догоспитальном этапе проводилось стандартное клинико-лабораторное обследование, включавшее в обязательном порядке исследование состояния гемостаза пациентки.
 Госпитализация пациенток осуществлялась за 1–2 суток до оперативного вмешательства с целью возможного дообследования и начала превентивной токолитической терапии.
Госпитализация пациенток осуществлялась за 1–2 суток до оперативного вмешательства с целью возможного дообследования и начала превентивной токолитической терапии.
Все обследованные пациентки (61) были разделены на 2 клинические группы в зависимости от техники вхождения в амниотическую полость. Первую группу составили 22 пациентки, у которых троакар не применялся. Во вторую группу вошли 39 пациенток, у которых для проведения фетоскопа в полость матки использовался отдельный троакар диаметром 3,9 или 4,7 мм.
В послеоперационном периоде продолжалась токолитическая терапия, а также назначался профилактический курс антибактериальной терапии и низкомолекулярный гепарин (фраксипарин), дозировка которого затем корректировалась в соответствии с данными гемостазиограммы. Контрольное УЗИ проводилось на 1-е и 7-е сутки после оперативного лечения, далее с интервалом в 2 недели.
Эффективность ФЛКА оценивалась по двум критериям: течение и исход непосредственно операции и раннего послеоперационного периода и исход беременности. Благоприятным исходом беременности считали рождение хотя бы одного живого ребенка [18–20].
Статистический анализ полученных данных проводился с использованием пакетов приложений Microsoft Office XP для статистической обработки материала – Microsoft Excel (версия 7.0) и программы статистической обработки материала Statistica (версия 6.0) с учетом вычислительных методов, рекомендованных для биологии и медицины. Использовались методы непараметрической статистики – точный критерий Фишера. Различия считались статистически значимыми при р<0,05.
Результаты исследования и их обсуждение
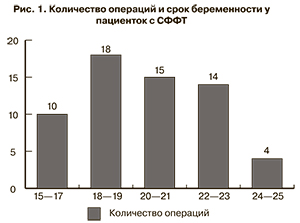
Признаки, указывающие на развитие СФФТ, по данным литературы, выявляются при УЗИ не ранее 15 недель гестации [2, 4, 7–9, 21, 22]. Сроки беременности, при которых выполнялась операция в нашем исследовании, представлены на рис. 1.
Как видно из данных, представленных на рис. 1, большинство операций было выполнено в сроки от 18-й до 21-й недели, что совпадает с данными литературы [16, 18, 23, 24].
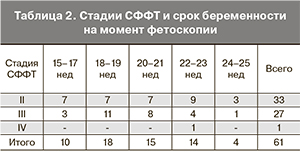
 В мировой литературе дискутируется вопрос о необходимости фетоскопического вмешательства у беременных с СФФТ I стадии [16, 21, 25, 26]. Однако при такой ситуации мы придерживались выжидательной тактики, с тщательным наблюдением за состоянием плодов. ФЛКА выполнялись нами только при II и более стадии СФФТ. С другой стороны, примерно половина (44%) пациенток была прооперирована уже при III стадии СФФТ, когда уже имелись выраженные гемодинамические нарушения – обычно нулевой или отрицательный диастолический кровоток в артерии пуповины плода-донора. В одном из наблюдений была отмечена IV стадия СФФТ, когда гемодинамические нарушения привели к формированию гидроперикарда у плода-реципиента. Данные о стадиях СФФТ и сроках беременности на момент вмешательства представлены в табл. 2.
В мировой литературе дискутируется вопрос о необходимости фетоскопического вмешательства у беременных с СФФТ I стадии [16, 21, 25, 26]. Однако при такой ситуации мы придерживались выжидательной тактики, с тщательным наблюдением за состоянием плодов. ФЛКА выполнялись нами только при II и более стадии СФФТ. С другой стороны, примерно половина (44%) пациенток была прооперирована уже при III стадии СФФТ, когда уже имелись выраженные гемодинамические нарушения – обычно нулевой или отрицательный диастолический кровоток в артерии пуповины плода-донора. В одном из наблюдений была отмечена IV стадия СФФТ, когда гемодинамические нарушения привели к формированию гидроперикарда у плода-реципиента. Данные о стадиях СФФТ и сроках беременности на момент вмешательства представлены в табл. 2.
Как видно из представленных в таблице данных, у половины пациенток, прооперированных при III стадии СФФТ, срок беременности не превышал 19 недель, что может свидетельствовать, с одной стороны, о тяжести течения синдрома, а с другой стороны, о запоздалой диагностике данного патологического состояния на догоспитальном этапе.
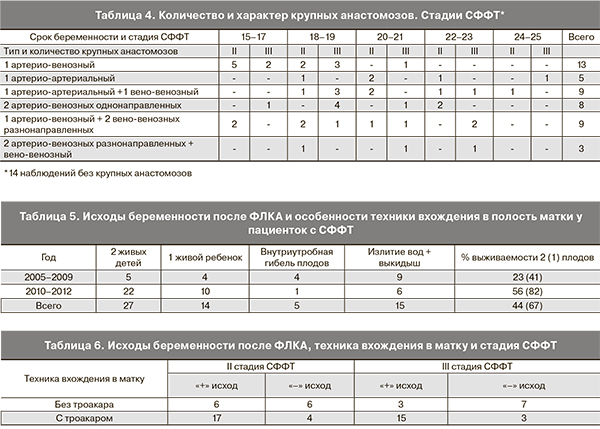
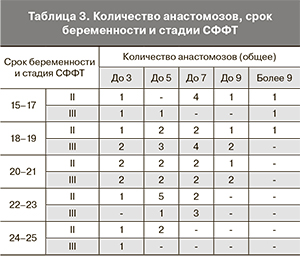
При детальном анализе протоколов операций была выявлена корреляция тяжести течения заболевания (срок манифестации и стадия СФФТ) с количеством, и самое главное, характером анастомозов, что в свою очередь определялось расстоянием между пуповинами плодов. Полученные данные совпадают сприведенными в 2004 г. Т.В. Марковой [10]. При расположении пуповин на расстоянии менее 3 см мы наблюдали наличие не менее 7 анастомозов, причем как минимум один из них был большого диаметра (сопоставимого с ½ диаметра пуповинных сосудов). Данные о количестве и характере анастомозов представлены в табл. 3 и 4.
Как видно из представленных в табл. 3 и 4 данных, просматривается корреляция тяжести течения СФФТ с количеством и характером анастомозов. Наиболее значимыми были асимметричные (однонаправленные) артерио-венозные и артерио-артериальные анастомозы большого диаметра, что совпадает с данными литературы [4, 7, 10, 13, 27]. Обращает внимание нечетное количество анастомозов во всех наблюдениях, что заставляет предположить важную роль этого параметра как «пускового механизма» в развитии СФФТ. Именно нечетное число, возможно, обусловливает «асимметричность» обмена кровью между плодами, тогда как «парные» анастомозы взаимно компенсируют друг друга.
Первым признаком эффективности вмешательства мы считали «появление» эхо-тени мочевого пузыря у донора на следующие сутки при УЗИ. Этот критерий был положительным у всех пациенток, родивших 2 живых детей. В дальнейшем, с увеличением прошедшего после операции времени, отмечалось исчезновение маловодия у донора, нормализация пуповинного кровотока и уменьшение диссоциации плодов по массе.
Исходы беременности после ФЛКА (61): в 27 случаях родилось 2 живых ребенка, в 14 – 1 живой ребенок; самопроизвольные выкидыши в сроки 18–22 недели имели место в 6 случаях, преждевременные роды до 28 недель – в 14 (живых детей нет).
На втором этапе работы мы провели оценку течения беременности и перинатальных исходов после ФЛКА с использованием и без использования троакара. Данные представлены в табл. 5.
Как видно из представленных в табл. 5 данных, изменение технологии вхождения в полость матки при ФЛКА привело к улучшению перинатальных исходов (p=0,04; точный критерий Фишера).
Важный результат получен при анализе исходов ФЛКА по двум критериям: в зависимости от техники вхождения в матку и стадии СФФТ на момент вмешательства (табл. 6).
Как видно из данных, представленных в табл. 6, при использовании для вхождения в амниотическую полость тубуса фетоскопа со стилетом большее количество благоприятных исходов приходилось на II стадию СФФТ. Неблагоприятные исходы практически одинаково распределены между II и III стадиями. При использовании троакара положительный результат наблюдался в два раза чаще и практически не зависел от стадии СФФТ. Неблагоприятные исходы, так же, как и в первой группе, равномерно распределены между II и III стадиями. Следовательно, при использовании троакара не только улучшается прогноз, но и нивелируется разница между эффективностью ФЛКА при различных стадиях СФФТ.
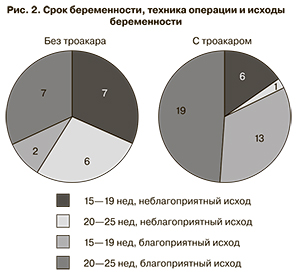
Также нами были изучены исходы беременности в зависимости от техники вхождения в полость матки и сроков гестации, в которые проводилась ФЛКА (рис. 2).
Как видно из рис. 2, частота благоприятных исходов беременности при выполнении ФЛКА с использованием троакара статистически значимо возросла (p<0,05).
Оценивая результаты проведенных исследований в целом, следует отметить более низкий по сравнению с данными литературы [18–20, 23] общий процент (67%) благоприятных исходов, что, по-видимому, можно объяснить, помимо отсутствия достаточного опыта на первых этапах исследования, большой долей III стадии СФФТ вследствие запоздалого выявления данной патологии на догоспитальном этапе. Возможно, также это связано и с недочетами в дальнейшем ведении беременности, приведшими к выкидышу вследствие истмико-цервикальной недостаточности (4) и антенатальной гибели одного из плодов в сроке 29–30 недель гестации (2).
 Следует особо подчеркнуть, что если пациентка благополучно миновала двухнедельный интервал после операции, то беременность удавалось пролонгировать как минимум на 8 недель. Вторым «критическим» периодом в плане преждевременного излития околоплодных вод, развития синдрома острой анемии-полицитемии и внутриутробной гибели одного из плодов являлись сроки гестации с 28-й по 32-ю неделю. Это можно интерпретировать как следствие прогрессивного увеличения внутриматочного объема на этой стадии беременности и увеличения по мере прогрессирования беременности диаметра мельчайших (иногда упускаемых в момент вмешательства) анастомозов до значимого диаметра, что приводит к возникновению рецидива СФФТ. Если же пациентка преодолевала и этот период, то роды заканчивались или плановым кесаревым сечением в 35–37 недель (12), или самопроизвольными родами (7). Эти результаты в целом коррелируют с данными литературы [18, 19, 23, 28, 29].
Следует особо подчеркнуть, что если пациентка благополучно миновала двухнедельный интервал после операции, то беременность удавалось пролонгировать как минимум на 8 недель. Вторым «критическим» периодом в плане преждевременного излития околоплодных вод, развития синдрома острой анемии-полицитемии и внутриутробной гибели одного из плодов являлись сроки гестации с 28-й по 32-ю неделю. Это можно интерпретировать как следствие прогрессивного увеличения внутриматочного объема на этой стадии беременности и увеличения по мере прогрессирования беременности диаметра мельчайших (иногда упускаемых в момент вмешательства) анастомозов до значимого диаметра, что приводит к возникновению рецидива СФФТ. Если же пациентка преодолевала и этот период, то роды заканчивались или плановым кесаревым сечением в 35–37 недель (12), или самопроизвольными родами (7). Эти результаты в целом коррелируют с данными литературы [18, 19, 23, 28, 29].
О значимости приобретения опыта при ФЛКА говорит тот факт, что средняя продолжительность вмешательства составляла в 2005–2009 годах 73 мин, а в 2010–2012 годах сократилась до 41 мин. Помимо опыта хирурга, на продолжительность операции влияет расположение плаценты. При локализации плаценты по передней стенке матки длительность вмешательства была достоверно выше (р<0,01).
Из тяжелых осложнений ФЛКА необходимо отметить: частичную отслойку нормально расположенной плаценты – 3, причем, только одна из них в течение первых 2 часов после операции, у двух других пациенток отслойка произошла после излития околоплодных вод через 10 и 4 недели после операции. Во всех этих наблюдениях в связи с начавшимся кровотечением беременность завершилась операцией кесарева сечения в экстренном порядке в сроки беременности 19, 22 и 31 неделя (оба плода, родившиеся в 31-ю неделю гестации, выжили). Наблюдались также: межоболочечная гематома – 1, излитие вод в брюшную полость – 2 (обе беременности завершились благополучно).
Заключение
Являясь тяжелым осложнением многоплодной монохориальной беременности, СФФТ должен быть не только диагностирован на ранних этапах развития, но и своевременно и адекватно корригирован для предотвращения неблагоприятного исхода для обоих или хотя бы одного плода. При ранней (до 20 недель) манифестации и/или тяжелом течении (прогрессирование на одну стадию за одну неделю) методом лечения СФФТ должна являться ФЛКА. Своевременное и успешное ее применение дает значительные шансы на благоприятный исход беременности. Расположение плаценты по передней стенке матки создает технические трудности в ходе оперативного вмешательства и увеличивает его продолжительность, однако не влияет на исход беременности в целом.