Преимплантационные эмбрионы человека ранних стадий развития окружены оболочкой, которая носит название блестящей оболочки (от англ. – zona pellucida – ZP) [1]. В процессе имплантации эмбрион человека внутри полости матки должен освободиться от ZP, чтобы клетки трофэктодермы (ТФЭ) вступили в непосредственный контакт с люминальным эпителием эндометрия. Выход эмбриона из ZP обозначается термином хетчинг (от англ. hatching – «вылупление») [2]. По имеющимся данным, 50–75% всех морфологически нормальных бластоцист человека не способны к самостоятельному выходу из ZP [3]. Отсутствие спонтанного хетчинга является одной из причин неудачи имплантации [4]. При затруднении спонтанного хетчинга, а также по ряду других показаний (поздний репродуктивный возраст пациентки, множественные неудачные попытки ЭКО в анамнезе, аномалии ZP, бластоцисты низкого качества, и др.) выполняется процедура вспомогательного хетчинга бластоцист [5].
Наибольшее распространение в практике программ вспомогательных репродуктивных технологий (ВРТ) получили методы частичного удаления ZP: механический, химический [6] и лазерный хетчинг [4, 7]. При данных методах оболочка частично надсекается в случайном месте, и бластоциста выходит из ZP самостоятельно, затрачивая на это время. Кроме того, данные методы вспомогательного хетчинга несут риск разрыва клеток эмбриобласта, что может способствовать формированию многоплодных беременностей [8].
Принципиально новым подходом к вспомогательному хетчингу является технология проназного (ферментативного) хетчинга. Преимуществами данного метода является полное удаление ZP, что экономит время бластоцисты на вылупление и не приводит к механическому разделению клеток, формирующих эмбрион. Это позволяет проводить профилактику монозиготных беременностей в программах ВРТ при переносе одной морфологически нормальной бластоцисты [9].
Согласно имеющимся на сегодняшний день данным, новая эмбриологическая технология полного удаления ZP может способствовать увеличению частоты наступления беременности в программах ВРТ. Бластоциста без ZP сразу после ее переноса в полость матки контактирует с клетками эндометрия в период имплантации, что способствует успешному наступлению беременности.
Материал и методы исследования
В проспективное когортное исследование были включены пациентки без противопоказаний и развития осложнений в ходе проведения программ ВРТ. На основании вида и наличия вспомогательного хетчинга бластоцист пациентки были разделены на 3 группы. Группу 1 составили 106 пациенток с проведением лазерного хетчинга с частичным удалением ZP; группу 2 – 103 пациентки с проведением проназного хетчинга с полным удалением ZP, группу 3 – 100 пациенток без проведения вспомогательного хетчинга бластоцист.
Стимуляция функции яичников у всех пациенток проводилась, как было описано ранее [10], с применением рекомбинантного фолликулостимулирующего гормона (рФСГ) или комбинированного препарата рФСГ и лютеинизирующего гормона (ЛГ), и назначением антагонистов гонадотропин рилизинг-гормона (ГнРГ). Триггер овуляции вводился при наличии лидирующих фолликулов диаметром 17 мм и более. В качестве триггера использовался человеческий хорионический гонадотропин, при риске развития синдрома гиперстимуляции яичников – агонист ГнРГ. Трансвагинальная пункция яичников осуществлялась через 36 часов после введения триггера овуляции.
Полученные ооциты отмывали от фолликулярной жидкости и крови и инкубировали в культуральной среде в течение 2–3 часов, после чего производили денудирование ооцитов. Оценку степени зрелости, качества ооцитов и эмбрионов, толщины ZP и мониторинг хетчинга проводили при помощи световой микроскопии (Nikon TE 300, общее увеличение х400). Лазерный хетчинг бластоцист проводили с помощью системы лазерной диссекции (инфракрасный лазер) Zilos-tk (Hamilton Thorne, Англия), формировали отверстие диаметром 10–14 мкм через всю ZP непосредственно перед переносом эмбриона в полость матки. Ферментативный хетчинг проводили при помощи фермента проназа Е (40 МЕ/мл, ЗАО «Протеинсинтез», Россия), растворение оболочки наблюдали под микроскопом, после чего отмывали эмбрион в культуральной среде с последующим переносом в полость матки.
Перенос эмбрионов в полость матки осуществлялся на 5-е сутки культивирования. В полость матки переносили один эмбрион наилучшего качества. Морфологическую оценку эмбрионов проводили через 120–122 часа (на 5-е сутки) культивирования (после оплодотворения). Учитывались морфологические характеристики эмбрионов по классификации Гарднера (степень зрелости бластоцист, качество внутриклеточной массы (ВКМ) и качество ТФЭ).
Поддержка лютеиновой фазы индуцированного цикла у всех пациенток проводилась по стандартному протоколу с назначением натурального микронизированного прогестерона интравагинально в дозе 600 мг в сутки после трансвагинальной пункци яичников. Если в качестве триггера овуляции был использован агонист ГнРГ, или сочетание агониста ГнРГ с хорионическим гонадотропином в дозе 1500 МЕ, для поддержки лютеиновой фазы назначался эстрадиола валерат в дозе 6 мг в сутки. При наличии подъема уровня бета – субъединицы сывороточного хорионического гонадотропина через 14 дней после переноса эмбрионов в полость матки регистрировалась биохимическая беременность, а при визуализации плодного яйца в полости матки через 21 день после переноса эмбриона – клиническая беременность.
Перед включением в протокол ЭКО пациентки были обследованы согласно приказу Минздрава России от 30.08.2012 №107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» [11].
Для статистического анализа использовался пакет статистических программ Statistica 10 (США). Статистический анализ проводился с применением χ2-теста для сравнения частотных показателей и теста Крускала–Уаллиса для сравнения непрерывных величин, а также многофакторного регрессионного анализа (логистической регрессии) для расчета отношения шансов (ОШ) с 95% доверительным интервалом (95% ДИ) исходов программ ВРТ. Корреляционный анализ проводился с использованием непараметрического корреляционного критерия Спирмена. Различия между статистическими величинами считали статистически значимыми при уровне достоверности p<0,05.
Исследование было одобрено комиссией по этике ФГБУ НЦАГиП им. Кулакова Минздрава России.

Результаты исследования
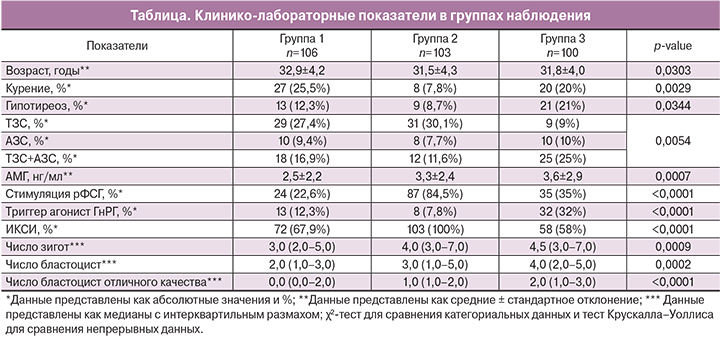
При анализе клинико-анамнестических данных, как возможных конфаундеров, было отмечено, что в группу 1 были включены пациентки более старшего возраста (р=0,0303) с более низким уровнем антимюллерова гормона (АМГ) (р=0,0007), в группу 2 было включено меньше курящих пациенток (р=0,0029). Пациентки группы 3 чаще страдали гипотиреозом (р=0,0344). Также отмечалось, что у партнеров пациенток групп 1 и 2 чаще отмечалась тератозооспермия (ТЗС), а у партнеров пациенток группы 3 – сочетание ТЗС и астенозооспермии (АЗС) (р=0,0054). При стимуляции суперовуляции у пациенток группы 2 чаще использовались препараты рФСГ (р<0,0001), а у пациенток группы 3 в качестве триггера овуляции чаще применялись препараты агониста ГнРГ (р<0,0001). Интрацитоплазматическую инъекцию сперматозоида в ооцит (ИКСИ) проводили в 100% наблюдений у пациенток в группе 2 и в 68 и 58% в группах 1 и 3, соответственно (р<0,0001). Показатели эмбриогенеза (число полученных бластоцист и бластоцист отличного качества) были лучше в группе 3 (р<0,001) (таблица).
Доля биохимической беременности не различалась в группах сравнения, тогда как доля клинической беременности была выше в группе 2 пациенток (р=0,0292). Также во группе 2 отмечалась значимо более низкая доля многоплодных беременностей (р=0,0348). Число самопроизвольных выкидышей и живорождений также было выше в группе проназного хетчинга, но не было статистически значимо (рисунок).
При оценке факторов, отличающихся в группах сравнения, как возможных конфаундеров, было выявлено, что ни один из них не влиял, ни на наступление беременности, ни на многоплодие. Поэтому ОШ клинической беременности в группе проназного хетчинга по сравнению с отсутствием хетчинга составило 1,9 (95% ДИ=1,01;3,6). ОШ клинической беременности в группе проназного хетчинга по сравнению с проведением лазерного хетчинга также составило 1,9 (95% ДИ=1,02;3,5).
Многоплодие при проведении лазерного хетчинга по сравнению с отсутствием хетчинга наблюдалось в 2,7 раза чаще, а по сравнению с проведением проназного хетчинга – в 5,6 раза чаще (р=0,0348).
Обсуждение
Вспомогательный хетчинг – дополнительная эмбриологическая методика, которая представляет собой искусственное разрушение ZP. Данная методика была разработана с целью повышения частоты имплантации эмбриона. До сих пор в литературе недостаточно данных для выбора лучшего метода вспомогательного хетчинга в клинической практике.
По данных Кохрановского обзора, применение вспомогательного хетчинга значимо увеличивает частоту наступления клинической беременности (ОШ=1,13, 95% ДИ 1,01; 1,27) [12]. Однако отсутствуют убедительные данные о влиянии вспомогательного хетчинга на частоту живорождения (прежде всего вследствие того, что в качестве конечной точки оценивается наступление беременности, а не родов), а также о влиянии различных методик хетчинга на исходы ВРТ. По данным различных исследователей, вспомогательный хетчинг с использованием различных методов дает аналогичную частоту имплантации и наступления беременности [9, 13]. Однако в нашем исследовании частота наступления клинической беременности была выше в группе пациенток с проведением проназного хетчинга (р=0,0292). Эти данные не только согласуются с данными литературы о положительном влиянии проведения процедуры вспомогательного хетчинга на уровень наступления беременности [5], но и свидетельствуют о преимуществе полного ферментативного удаления ZP.
Особое внимание заслуживают полученные данные о влиянии вспомогательного хетчинга на развитие монохориальной многоплодной беременности. Монохориальная многоплодная беременность является опасным осложнением гестационного периода, ассоциированным с повышенным риском перинатальной заболеваемости и смертности [12]. Некоторые исследователи отмечают повышенный риск развития монохориальной многоплодной беременности при применении ВРТ в целом, а также при оплодотворении методом ИКСИ, или при проведении вспомогательного хетчинга с частичной диссекцией ZP [8, 14].
Однако роль вспомогательного хетчинга в развитии монозиготной беременности в программах ВРТ является недоказанной. В нашем исследовании в группе проведения проназного хетчинга отмечалась значимо более низкая доля многоплодных беременностей, в то время как при проведении лазерного хетчинга частота развития многоплодной беременности была максимальной, что согласуются с имеющимися литературными данными [15, 16]. Это подтверждает предположение о роли нарушения целостности ZP в формировании монозиготных двоен в программах ВРТ [8] и позволяет рекомендовать проназный хетчинг, как приоритетный метод вспомогательного хетчинга.
Заключение
Технология полного удаления блестящей оболочки является новым подходом к вспомогательному хетчингу, при котором, во-первых, не происходит механического разделения клеток, формирующих эмбрион, а, во-вторых, формируется быстрый контакт с клетками эндометрия в период имплантации. Это будет способствовать не только повышению эффективности программ ВРТ, но и снижению частоты осложнений беременности, связанных с многоплодием. Необходимы дальнейшие исследования для определения показаний к проведению вспомогательного хетчинга и уточнения его влияния на уровень живорождения.



