Несмотря на все усилия, не наблюдается снижение частоты преждевременных родов (ПР) в мире. Принято выделять факторы риска ПР. Эксцизия шейки матки (конизация), особенно с большим объемом потерянной ткани, является одним из них. Раньше считалось, что причиной повышения риска является уменьшение механической поддержки плодного яйца. Сегодня роль основного механизма отдается снижению барьерной функции цервикальной слизи [1]. При этом решающее значение может иметь состояние микробиоты (микробиоценоза) влагалища во время беременности. Более двух десятилетий накапливались данные о связи между нарушениями вагинальной микробиоты и ПР [2–4]. По сути, нарушением микробиоты следует считать состояние микроценоза влагалища, где есть любой другой, кроме лактобацилл, доминирующий микроорганизм. При этом возникает снижение защитных механизмов влагалища и угроза развития патологического процесса. Нарушение микробиоты можно найти в патогенезе многих акушерских и гинекологических заболеваний (воспалительные заболевания органов малого таза, невынашивание беременности, бесплодие), а ее коррекция снижает риск их возникновения [5]. Установлена связь ПР с аэробным (неспецифическим) вагинитом. В исследовании с участием более 2500 женщин Carey с соавт. показали, что сдвиг в вагинальной флоре в сторону увеличения аэробных грамотрицательных патогенов, таких как кишечная палочка и клебсиелла, приводит к увеличению относительного риска (RR) ПР в 1,5 раза (95%ДИ 1,05–2,1) [6]. Другие исследования это подтвердили [4, 7]. Много данных накоплено о связи бактериального вагиноза (БВ) с неблагоприятными исходами беременности c акцентом на ПР [4, 8]. Однако, несмотря на то, что с 2002 года по сегодняшний день проведено десять мета-анализов посвященных диагностике и лечению БВ у беременных, однозначного ответа на вопрос о необходимости тотального скрининга и лечения БВ у беременных нет. На основании последнего мета-анализа P. Brocklehurst с соавт. (2013), включившим 21 исследование с участием 7847 беременных с БВ, установлено, что его лечение не снижает ни риска ПР <37 недель: RR0,88 (95%ДИ 0,71–1,09), ни преждевременного излития вод: RR0,74 (95% ДИ 0,30–1,84) [9]. Объективности ради нужно сказать что в него вошли два исследования, показавшие, что лечение БВ до 20 недель приводит к снижению спонтанных ПР <37 недель, но на общий итог мета-анализа они не повлияли. Поэтому на сегодня ни Кохрановское общество, ни ВОЗ не поддерживает идею о рутинном скрининге на БВ и его лечении у беременных без факторов риска ПР [10, 11]. Дискуссии о целесообразности скрининга на БВ бессимптомных беременных продолжаются. Поэтому необходимы дополнительные исследования, чтобы выявить группы беременных у которых диагностика и лечение нарушений микробиоты влагалища будет полезным мероприятием, а также понять ее связь с другими факторами риска ПР, в данном случае с эксцизией шейки матки в анамнезе.
Цель исследования: установить роль нарушения микробиоты влагалища как фактора риска ПР у беременных после эксцизии шейки матки.
Материал и методы исследования
С 2007 по 2015 год были включены 340 беременных с эксцизией шейки матки (LEEP, CONE) в анамнезе. Объем удаленной при эксцизии ткани у всех беременных был измерен методом волюметрии и задокументирован [12, 13]. Самопроизвольные ранние (n=22) и поздние выкидыши (n=1) и искусственные аборты (n=1) исключены из оценки. Кроме того, исключены женщины с другими факторами риска ПР: c ожирением (индекс массы тела 30) одна беременная, и с ПР в анамнезе одна. Контрольной группой были случайно отобранные 290 беременных без хирургических вмешательств на шейке матки и факторов риска. Для оценки остались 314 включенных, у которых беременность закончилась живорождением. Основной «конечной точкой» для оценки были самопроизвольные ПР <37 недель (индуцированные ПР по показаниям со стороны матери или плода были исключены). Всем беременным из группы эксцизии в сроке 16+1 неделя выполнена трансвагинальная ультразвуковая цервикометрия (Siemens Sonoline G60 датчик 6,5 МГц). Порог длины шейки матки в исследовании был ≤25 мм, при равном или меньшем значении шейка считалась «короткой». NB! Наиболее общепринятым сроком для цервикометрии в популяции считается 18–22 недели. Считается, что чем раньше обнаружено укорочение шейки, тем больше риск ПР. Цервикометрия до 14 недель у беременных мало информативна, так как до 14 недель длина шейки не меняется, и только у беременных с эксцизией в анамнезе она может быть короткой уже в этом сроке [14]. Но хорошая воспроизводимость результатов отмечается только после 14 недель, когда шейку матки становится легко отличить от нижнего сегмента.
Учитывая отсутствие убедительной доказательной базы об эффективности цервикального серкляжа и пессария у беременных с эксцизией шейки без истории ПР в анамнезе, эти профилактические мероприятия беременным с «короткой» шейкой не выполнялось. Учитывая, в свою очередь, наличие доказательной базы об использовании прогестерона для профилактики ПР, все беременные с «короткой» шейкой получали микронизированный прогестерон (вагинально 200 мг/сутки) до 34 недель гестации [15].
Все беременные после 20 недель самостоятельно проводили рН метрию влагалища раз в месяц. При нарушении pH влагалища (≥4,5), появлении жалоб на бели и в обязательном порядке в 28–30 недель выполнялась микроскопия нативного вагинального мазка [16]. Основным критерием оценки микробиоты являлся показатель лактобациллярной степени – ЛБС (LBG – lactobacillary grading, англ.). Использована классификация Шредера в модифицикации G. Donders (2000), в которой выделяют следующие категории ЛБС (по соотношению лактобацилл и других представителей микробного сообщества): I степень – преимущественно лактобациллы, с очень незначительным количеством другой флоры, IIa степень – количество лактобацилл превышает количество других морфотипов (кокков), IIb степень – количество лактобацилл меньше чем других морфотипов (кокков), и III степень – практически полное отсутствие лактобацилл и присутствие кокковой флоры. I и IIа степени считаются нормальными, IIb – так называемая промежуточная флора, III степень – признак выраженного нарушения микробиоты влагалища (может быть детализирована на три формы: БВ, аэробный или неспецифический вагинит и смешанная аэробно-анаэробная форма) [17, 18]. Нарушенной микробиотой влагалища у беременных считался показатель ЛБС IIb и хуже. Дополнительная оценка мазка включала: присутствие псевдомицелия дрожжеподобных грибов, «ключевых клеток», редко трихомонад. О наличии воспаления судили по соотношению лейкоцитов к клеткам эпителия – >10 лейкоцитов на одну эпителиальную клетку свидетельствовало о выраженном воспалении (норма ≤1:1). Инфекции влагалища, связанные с облигатными патогенными микроорганизмами (N. Gonorrhoeae, Chl. trachomatis, T. vaginalis, Mycoplasma genitalium) были исключены или пролечены до беременности. Этиотропное лечение при нарушении микробиоты проводилось только при наличии жалоб. Препаратом выбора являлся нео-пенотран форте, содержащий в одном суппозитории 750 мг метронидазола и 200 мг миконазола. Препарат эффективен в отношении анаэробной флоры, кандидозной инфекции и смешанных форм нарушения микробиоты влагалища, что наиболее часто встречается в последнее время.
Результаты исследования
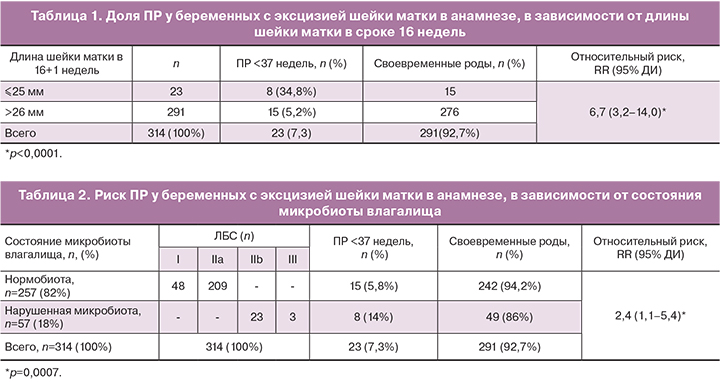
Объем удаленных при эксцизии образцов в среднем составил 2,2+0,8 см3 (M+s). Доля ПР родов в группе эксцизии составила 23/314 (7,3%), а в контрольной группе 21/290 (7,2%) и статистически значимо не отличалась (p=1,0).
У 23 беременных длина шейки матки была ≤25 мм, у 291 отмечалась «нормальная» длина шейки матки со средним значением 38+6,3мм (M+s).
Из 23 беременных с короткой шейкой матки восемь (34,8%) родили до 37 недель (табл. 1), из них 2 – до 34 недель. Из 291 беременных с шейкой матки >26 мм в сроке 16 недель, преждевременно родили 15 (5,2%) женщин, из них одна – до 28 недель (новорожденный с внутриутробной инфекцией умер). Таким образом, при наличии «короткой» шейки матки в сроке 16 недель гестации у беременных с эксцизией в анамнезе риск ПР значительно выше, чем у беременных с эксцизией, но с нормальной длиной шейки: RR 6,7 (95% ДИ 3,2–14,0).
Данные о состоянии микробиоты влагалища у беременных из группы эксцизии и исходах беременностей представлены в табл. 2.
Нарушение микробиоты влагалища (ЛБС IIb и III) у беременных с эксцизией в анамнезе ассоциируется с повышением риска ПР (14%) по сравнению с беременными без эпизодов нарушения микробиоты в процессе гестации (5,8%). Таким образом, по нашим данным риск составляет RR 2,4 (95%ДИ 1,1–5,4).
Внимания заслуживает анализ сочетания этих двух факторов. Из 23 беременных с короткой шейкой у 14 (61%) отмечался хотя бы один эпизод нарушения микробиоты влагалища в течение беременности БВ, аэробный вагинит), из них 6 (42,8%) родили преждевременно. Анализ показал, что при сочетании короткой шейки матки и нарушения микробиоты влагалища во время беременности риск ПР (<37 недель) возрастает более чем в 7 раз: RR7,6 (95% ДИ 3,5–16,2).
Обсуждение
Наиболее вероятным механизмом ПР при нарушении микробиоты влагалища является повышение содержания метаболитов бактерий, обладающих муколитической и фосфолипазной активностью. Фосфолипаза приводит к высвобождению из мембран децидуальных и амниотических клеток арахидоновой кислоты – предшественника простагландинов, индуцирующих роды, что создает условия для преодоления цервикального барьера, инфицирования полости матки и активации плодовых и материнских воспалительных реакций, повышения уровня цитокинов (интерлейкин 1α и 1β, фактора некроза опухоли) и активности циклооксигеназы-2 – фермента, катализирующего синтез простагландинов из арахидоновой кислоты. Воспаление приводит к гипертонусу миометрия или «ослаблению» нижнего полюса плодного пузыря и излитию вод [19]. Логично полагать, что этот механизм может облегчаться при анатомически «скомпрометированной» шейке матки: после ампутации, высокой конизации, грубых ее разрывах. Почему же при явно доказанной связи БВ c ПР не хватает доказательств эффективности его лечения для их профилактики? Дело в том, что одним из важных условий проведения мета-анализа является однородность включенных в него исследований (конечные точки, метод воздействия, группы пациентов и др.) [20]. Во всех анализах по данной проблеме имеется значительная гетерогенность включенных исследований. А именно: не исключены сопутствующие факторы риска (только при исключении других факторов можно уверенно говорить о роли БВ), разные критерии диагностики БВ при включении пациентов (диагностика по критериям Амселя и критериям Ньюджента часто не совпадает даже у одной пациентки), разные схемы и сроки лечения. Это могло привести к неточным результатам мета-анализов. Поэтому на сегодня нет убедительных доказательств клинической эффективности скрининга и лечения БВ у бессимптомных беременных без факторов риска. Стоит напомнить, что БВ может самостоятельно разрешаться у 50% беременных [21]. Шейка матки играет важную роль в качестве барьера для восходящей инфекции во время беременности. Цервикальная слизь содержит антимикробные вещества, такие как дефензины, лизоцим, лактоферрин и секреторный ингибитор протеазы лейкоцитов. После эксцизии шейка матки заживает путем регенерации стромы и многослойного плоского эпителия, однако регенерация эндоцервикального эпителия, который отвечает за продукцию слизи, ограничена. Снижение продукции цервикальной слизи может привести к снижению иммунной функции и предрасполагает к восходящей инфекции половых путей. При сочетании этих факторов риска происходит повышение вероятности реализации механизма инициирования ПР.
Таким образом, несмотря на отсутствие убедительных доказательств связи между петлевой эксцизией шейки матки в анамнезе и повышением риска ПР в популяции в целом [13, 22, 23], данное исследование демонстрирует эту связь как у беременных с «короткой» шейкой (обычно связано с большим объемом эксцизии): RR 6,7 (95% ДИ 3,2–14,0), так и с нарушенной микробиотой при беременности: RR2,4 (95% ДИ 1,1–5,4). Особенно риск повышается при сочетании этих факторов: RR7,6 (95% ДИ 3,5–16,2). Несмотря на то что микробиота влагалища имеет широкое микробное разнообразие, наиболее важной ее характеристикой является доминирование лактобацилл. Для ее оценки выбран показатель ЛБС, потому что он хорошо коррелирует с наличием бактериальных инфекций влагалища, с местным воспалительным ответом организма (в том числе с количеством лейкоцитов), уровнем цитокинов и рН влагалища. Метод количественной полимеразной цепной реакции (ПЦР) не дает возможность оценить степень воспалительной реакции в половых путях (количество лейкоцитов), рН среды и является значительно более дорогостоящим. Не умаляя достоинств методов окрашивания по Граму и ПЦР в режиме реального времени, микроскопия влажного мазка с оценкой ЛБС четко отвечает на вопрос, имеет ли место нарушение микробиоты влагалища или нет, особенно для адекватной и быстрой оценки беременных с жалобами и симптомами.
Микробиота влагалища – динамично изменяющаяся система, постоянно отклоняющаяся от принятой нами «нормы». Именно интервалы колебания и увеличение их частоты и продолжительности могут давать периодические эпизоды повышенного риска. Присутствует стереотип, что увеличение во влагалище числа микроорганизмов, связанных например с БВ, это уже патология, требующая лечения. Тем не менее, у большинства женщин осложнений не наблюдается во время беременности, родов, акушерских и гинекологических операциях, так как наличие этих микроорганизмов необходимо, но недостаточно, чтобы вызвать симптомы и изменения в иммунном ответе, то есть патологическую реакцию организма. Осложнения связаны не только с наличием и последствиями микробной деятельности, но и с характером иммунного ответа организма и присутствия дополнительных факторов [18]. В данном случае – снижение барьерной функции шейки при наличии возможно врожденной слабости иммунного механизма защиты. Убедительным подтверждением тому, что не механическая цервикальная недостаточность играет решающую роль в генезе ПР у этого контингента женщин, являются данные о сроках, в которых беременность прерывается. На основании многочисленных исследований ПР происходят обычно не ранее 32 недель [22, 23]. Тогда как при недостаточности запирательной функции шейки матки (истмико-цервикальная недостаточность) этот срок обычно <24 недель [24, 25]. Кроме того, имеются противоречивые результаты цервикального серкляжа у беременных после эксцизии шейки [26, 27]. Отсутствует убедительная доказательная база в отношении эффективности цервикального пессария у данного контингента беременных. Нет исследований, доказывающих преимущество одной модели пессария над другой. Стоит взглянуть на ту огромную разницу форм, какой обладают разные модели пессариев, чтобы озадачиться вопросом о равной эффективности их действия. Из наших наблюдений у всех беременных с наличием пессария во влагалище отмечались жалобы на умеренные или обильные бели, а при микроскопии нативного мазка ЛБС оценивалась IIb или III. Учитывая данные о влиянии микробиоты влагалища на риск ПР у беременных после эксцизии шейки, этот факт не может быть игнорирован и ставит под сомнение вопрос об обоснованности применения пессария у данного контингента женщин.
Заключение
Исследование показало, что нарушение микробиоты влагалища (ЛБС IIb и III степени) во второй половине беременности является существенным фактором риска ПР у беременных с эксцизией шейки в анамнезе. Относительный риск ПР значительно выше чем у беременных с эксцизией, но с нормальной микробиотой: RR 2,4 (95% ДИ 1,1–5,4). Сочетание с «короткой» шейкой повышает риск ПР до 7,6 (95% ДИ 3,5–16,2). Всем беременным с эксцизией шейки матки в анамнезе следует выполнять самотестирование pH влагалища (рН≥4,5), и состояния микробиоты методом микроскопии нативного мазка с оценкой ЛБС, а при нарушении микробиоты влагалища (ЛБС IIb и III) проводить ее коррекцию в любом сроке. Нормальная микробиота влагалища – важнейший фактор благополучного завершения беременности у таких женщин.



