Миома матки является наиболее распространенной доброкачественной опухолью среди женщин большинства стран мира. Истинную ее распространенность определить сложно в связи с бессимптомным течением в 70% наблюдений. Имеются сведения, что миомой матки страдают около 30–35% женщин репродуктивного возраста [1]. Однако результаты аутопсий среди женщин репродуктивного периода свидетельствуют о значительно большей частоте (до 85%) распространенности этого заболевания [2]. В последние годы наблюдается тенденция диагностики миомы матки в раннем репродуктивном периоде (17–25 лет) [3, 4].
Являясь доброкачественной опухолью, миома матки при ее бессимптомном течении не опасна для жизни больных. В то же время выраженный болевой синдром, маточные кровотечения, нарушения функции смежных органов не только значительно ухудшают качество жизни женщин, но в некоторых ситуациях, например, при некрозе узла и развитии септического осложнения могут представлять опасность для пациентки и привести к летальному исходу.
У женщин репродуктивного возраста миома матки нередко ассоциируется с невозможностью зачатия, вынашивания беременности и патологическими родами. Поэтому первоочередной задачей у молодых пациенток является сохранение фертильности. С позиций доказательной медицины на сегодняшний день отсутствуют убедительные данные о влиянии миомы матки на репродуктивную функцию женщины. Так, О. Чеппат (2000) [5] и Е.М. Вихляева (2004) [2] считают, что генеративная функция может быть не нарушена или нарушена незначительно.
Напротив, по данным А.А. Селиверстова (1997) [6], Э.Х. Фахрутдиновой (2004) [7], бесплодием страдают от 55 до 82% пациенток с миомой матки, при этом доля первичного бесплодия составляет 23,3%, вторичного – 32%. Имеются сведения, что каждая 5-я женщина с миомой матки страдает бесплодием, а бездетных женщин в этой группе в два раза больше, чем бесплодных [8].
Около 15–22% женщин с миомой матки страдают привычным невынашиванием беременности, в 2–3 раза чаще, чем женщины без миомы [9]. Было показано, что частота имплантации после экстракорпорального оплодотворения (ЭКО) у больных с миомой матки равна 22,1%, а частота невынашивания – 36%. При беременности и в родах миома матки нередко приводит к ряду акушерских осложнений, таких как прерывание беременности на различных сроках, несвоевременное излитие околоплодных вод, патология расположения и прикрепления плаценты, неправильное предлежание и положение плода, плацентарная недостаточность, а также повышает риск хирургического вмешательства в связи с нарушением питания миоматозных узлов [3].
 Основным методом лечения миомы матки до настоящего времени остается хирургический. Значительные успехи были достигнуты в результате использования малотравматичных методов, прежде всего лапароскопии и гистерорезектоскопии. Однако появившиеся в научной литературе описания разрывов матки при беременности и в родах после лапароскопических миомэктомий побудили к дискуссии о возможности и целесообразности выполнения таких операций с целью сохранения фертильности по сравнению с традиционными лапаротомиями.
Основным методом лечения миомы матки до настоящего времени остается хирургический. Значительные успехи были достигнуты в результате использования малотравматичных методов, прежде всего лапароскопии и гистерорезектоскопии. Однако появившиеся в научной литературе описания разрывов матки при беременности и в родах после лапароскопических миомэктомий побудили к дискуссии о возможности и целесообразности выполнения таких операций с целью сохранения фертильности по сравнению с традиционными лапаротомиями.
В связи с этим в настоящее время наиболее остро встают вопросы, касающиеся техники операции и выбора доступа.
Исходя из сказанного, целью настоящего исследования стал первичный анализ результатов выполнения лапароскопических робот-ассистированных миомэктомий.
Материал и методы исследования
За период с ноября 2009 года по июль 2015 года в клинике женских болезней и репродуктивного здоровья ФГБУ НМХЦ им. Н.И. Пирогова Минздрава России с использованием роботизированного комплекса da Vinci Si 44-м пациенткам с миомой матки в возрасте от 25 до 45 лет (в среднем 35±3,1 года) в плановом порядке были выполнены миомэктомии. Показанием для операции служили крупные или множественные узлы с субсерозным, субсерозно-интрамуральным и интрамуральным расположением, симптомная миома матки, миома матки в сочетании с бесплодием. Средняя масса тела пациенток составила 65,66±6,75 кг, индекс массы тела соответственно 23,88±3. Из 44 женщин 35 планировали беременность в ближайший год, 9 – в более отдаленный период.
Предоперационная подготовка, положение больных на операционном столе были такими же, как и при традиционной лапароскопии, однако точки расположения троакаров отличались. Все операции выполнялись в условиях общей анестезии с управляемым дыханием.
В настоящем исследовании использовалась аппаратура для выполнения лапароскопических робот-ассистированных операций da Vinci Si и уникальные инструменты EndoWrist, обеспечивающие 7 степеней подвижности, полностью копируя движения человеческой руки, что устраняет эффект шарнира, присутствующий в традиционной лапароскопии.
Техника робот-ассистированной лапароскопической миомэктомии в точности соблюдает все принципы ранее разработанных открытых (лапаротомных) миомэктомий и повторяет основные приемы органосберегающего хирургического лечения миомы матки. Для успешного роботизированного лапароскопического подхода к миомэктомии необходимо осуществить точное моделирование открытого хирургического метода. Очень важно еще до операции определить размеры, количество и локализацию узлов. После ревизии органов брюшной полости и малого таза, матка при помощи маточного манипулятора выводится в удобное положение. Перед началом иссечения узлов для уменьшения интраоперационной кровопотери выполняется либо временная окклюзия маточных артерий наложением турникета вокруг шейки матки через «окна» в широких связках матки (рационализаторское предложение № 12194/5 от 27.10.2010), либо вазоконстрикция путем введения в миометрий в зоне предполагаемого рассечения физиологического раствора с адреналином [10, 11]. Такой подход позволяет минимизировать использование дополнительных высокоэнергетических воздействий электричеством, аргоном или лазером для обеспечения гемостаза в области ложа узла, что способствует в дальнейшем формированию полноценного рубца.
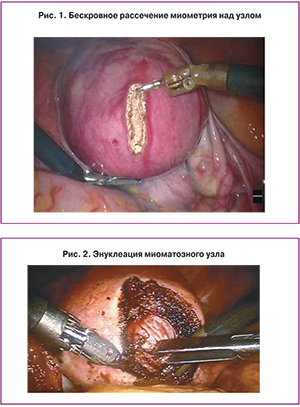
Направление рассечения матки с роботом может быть продольным (рис. 1, обычно выполняют при открытой миомэктомии) или поперечным (часто используют при лапароскопии, так как облегчается наложение швов), поскольку у хирурга есть больше свободы действий при зашивании ложа. Когда обнаружена капсула узла и найдена нужная плоскость, узел вылущивается при помощи монополярного инструмента (ножницы, крючок) в одной руке и биполярного зажима в другой (рис. 2). Используемая энергия должна быть оптимальной для обеспечения гемостаза и минимальной для повреждения тканей: выходная мощность высокочастотного генератора 45–50 Ватт.
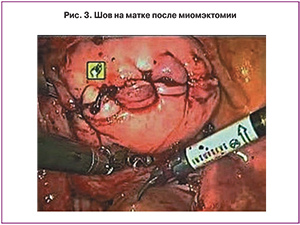
После отделения узлов и контроля гемостаза выполняют зашивание образовавшегося дефекта матки. Для этой цели коагуляционные инструменты заменяются на два иглодержателя. Этот этап является одним из самых важных, так как от качества шва зависит формирование полноценного рубца. Сначала, если была вскрыта полость матки, викрилом 5/0–7/0 ушивают эндометрий, который прекрасно визуализируется через 3-D оптическую систему и позволяет прецизионно сопоставить ткани. Глубокие слои разреза после миомэктомии затем зашиваются в несколько слоев: отдельные мышечно-мышечные и непрерывный серозно-мышечный швы рассасывающими нитями типа викрила 2/0–3/0. Отдельные узловыми швами удается лучше сопоставить края раны и добиться максимального качества метропластики. Лучшему сопоставлению краев миометрия при сшивании матки способствует использование нитей V-loc 180, которые представляют собой рассасывающуюся монофиламентную нить с мелкими зубцами (типа елочная ветка), направленными от иглы, и петелькой на конце. Такая конструкция позволяет нити самостоятельно без завязывания узлов фиксироваться в тканях и удерживать их без большого натяжения (рис. 3).
Узлы крупных размеров извлекались из брюшной полости морцелляцией. После проведения санации брюшной полости 11 (25%) пациенткам в малый таз вводили противоспаечные препараты (мезогель, интерсид, интеркоат).
Из 44 больных с миомой матки у 34 (77,3%) были дополнительно диагностированы другие гинекологические заболевания: эндометриоидная болезнь различной локализации – у 28; спаечная болезнь – у 17; болезни яичников и маточных труб – у 15; патология эндометрия – у 2, что также потребовало выполнения дополнительных хирургических действий.
 Эффективность операций оценивали по возникновению интраоперационных или послеоперационных осложнений, величине кровопотери, количеству дней госпитализации, температурной реакции, болевому синдрому. Дополнительно оценивали время операции от «кожи до кожи» и время «консоли», то есть собственно время самой операции. Отдельно анализировали восстановление репродуктивной функции у оперированных больных.
Эффективность операций оценивали по возникновению интраоперационных или послеоперационных осложнений, величине кровопотери, количеству дней госпитализации, температурной реакции, болевому синдрому. Дополнительно оценивали время операции от «кожи до кожи» и время «консоли», то есть собственно время самой операции. Отдельно анализировали восстановление репродуктивной функции у оперированных больных.
Статистическая обработка данных проводилась непараметрическими методами с расчетом средних и относительных величин. В зависимости от поставленных задач группы могли быть не связанными и связанными между собой. Для определения различий между несвязанными группами рассчитывались критерии Манна–Уитни, критическое значение р=0,005; критерий χ2 и точный двусторонний критерий Фишера, критическое значение р=0,05. Для статистической обработки данных использовалась программа Statistica 10 (англоязычная версия) компании Statsoft.
Результаты исследований
В результате проведенного анализа робот-ассистированных лапароскопических миомэктомий у 44 женщин были получены следующие результаты. Средняя продолжительность операции от разреза до последнего шва составила 192,5±91 мин. Следует отметить, что непосредственная продолжительность самого вмешательства в брюшной полости (время работы хирурга за консолью) намного меньше, так как значительную часть времени занимает подготовка робота, смена инструментов во время операции, морцелляция, некоторые технические паузы. На продолжительность лапароскопической робот-ассистированной миомэктомии влияют опыт хирурга (на начальном этапе освоения данной технологии на операцию тратилось больше времени, но по мере приобретения опыта этот показатель уменьшался). Также на продолжительность оперативного вмешательства влияли количество и размеры удаляемых узлов. Так, на одну из первых миомэктомий с удалением 13 больших узлов было потрачено около 290 мин, а 1 небольшой узел был удален в течение 54 мин. Дополнительная гинекологическая и соматическая патология аналогичным образом способствовали более продолжительному времени хирургического вмешательства.
Средняя интраоперационная кровопотеря составила 195,5±164 мл (50–1000 мл) и также зависела от размеров и количества миоматозных узлов, применения способов уменьшения кровопотери (временная окклюзия маточных артерий, медикаментозная вазопрессия). Интраоперационных осложнений и конверсии не было. Средний послеоперационный койко-день не превышал 4 дней.
Одной из важных задач, которые мы ставили перед собой, являлась оценка восстановления репродуктивного здоровья у больных миомой матки. В июле 2015 г. был проведен телефонный опрос женщин. Из 44 пациенток удалось связаться с 31. Две пациентки, прооперированные в 2015 г., не подлежали опоросу ввиду короткого периода после операции для оценки репродуктивных результатов. Из 44 оперированных больных 35 планировали беременность в ближайший год после миомэктомии. Однако при телефонном опросе из 31 женщины 14 не пытались забеременеть ранее, но планируют беременность в течение ближайшего года, 6 из них готовятся к ЭКО.
Из оставшихся 17 опрошенных пациенток у 11 (64,7%) наступила беременность: у 9 женщин – спонтанное наступление беременности в естественном цикле; две беременности наступили в результате ЭКО, причем в одном случае показанием для ЭКО был мужской фактор бесплодия.
В 5 наблюдениях (29,4%) беременность завершилась рождением здоровых доношенных детей. Физиологическим течение беременности было у 4 женщин, у одной пациентки беременность, наступившая в результате 2-й попытки ЭКО, протекала на фоне угрозы ее прерывания на разных сроках, а во второй половине развилась фето-плацентарная недостаточность с ранним старением плаценты и преэклампсией легкой степени. У одной пациентки произошли нормальные своевременные самопроизвольные роды, послеродовой период протекал без осложнений. В 4 наблюдениях при доношенных сроках в плановом порядке было родоразрешение кесаревым сечением. При этом у всех женщин интраоперационно отмечено, что миометрий в области рубца на матке после миомэктомии не истончен. Операции и послеоперационный период протекали без осложнений.
В настоящее время две пациентки беременны (22 и 24 недели). Их состояние и параметры плода удовлетворительные. В обоих случаях беременность протекает благоприятно.
В то же время в 3 случаях беременность сохранить не удалось. У одной пациентки были две замершие беременности в сроке 8–9 недель, обусловленные генетическими причинами. У второй больной состоялись два самопроизвольных выкидыша в сроки 6–7 и 8–9 недель беременности на фоне развившегося антифосфолипидного синдрома и активации внутрисосудистого свертывания крови в период гестации. У третьей женщины 42 лет также произошли два самопроизвольных выкидыша на 7–8-й и 8–9-й неделях беременности, причина не установлена.
В одном наблюдении наступила внематочная беременность. Выполнена тубэктомия. Больная планирует ЭКО.
Обсуждение
Данные о влиянии миомы матки на фертильность противоречивы. Многие авторы придерживаются мнения, что это заболевание является причиной бесплодия за счет деформации узлами опухоли стенок цервикального канала и/или полости матки, окклюзии проксимальных отделов маточных труб, нарушения нормальной тубоовариальной анатомии, повышенной или патологической сократимости миометрия, изменениях в эндо- и миометрии [12–14]. Миома матки может препятствовать имплантации оплодотворенной яйцеклетки, вынашиванию беременности и создавать определенные трудности в родах. На сегодняшний день есть работы, в которых указано, что ведущими факторами возникновения бесплодия при миоме матки являются размеры миоматозного узла более 5 см при его интрамуральной локализации, а также деформация полости матки вне зависимости от размеров узла, их перешеечная и интерстициальная локализация. Выполнение миомэктомии по указанным показаниям позволяет эффективно преодолеть бесплодие в 20,4–34% случаев [15].
В нашем исследовании была оценена репродуктивная функция у женщин после миомэктомий с помощью роботизированного комплекса da Vinci Si, эффективность которого была продемонстрирована в наших более ранних публикациях [10, 16]. В основном женщины были оперированы на подготовительном этапе перед применением ЭКО. Однако, как мы видим, многие из них смогли забеременеть в естественном цикле самостоятельно: нормальная беременность состоялась у 7 (41,2%) из 17 женщин, которые планировали ее. А если принять во внимание еще и тех пациенток, у которых в перспективе после оперативного лечения может быть выполнено ЭКО, процент наступления беременности может быть еще выше. Эти данные свидетельствуют об эффективности робот-ассистированной миомэктомии и перспективности таких операций для сохранения репродуктивного потенциала у пациенток c миомой матки. В данном исследовании мы не ставили целью сравнить роботизированные лапароскопии со стандартными. Однако по данным современной литературы лапароскопические миомэктомии позволяют сохранить фертильность у 62,2% пациенток [17].
В то же время следует отметить, что в современной литературе пока еще нет масштабных исследований о влиянии миомэктомий на преодоление бесплодия. Так, например, по данным Кохрановского обзора нет достоверных данных о том, что миомэктомия оказывает влияние на фертильность женщины [18, 19]. Следовательно, такие исследования актуальны на сегодняшний день и имеют большое научно-практическое значение.
Заключение
Результаты проведенного исследования свидетельствуют о малотравматичности лапароскопических робот-ассистированных миомэктомий, которые сопровождаются малой кровопотерей во время операции, коротким периодом реабилитации, быстрым восстановлением трудоспособности, формированием полноценного рубца на матке, отсутствием осложнений и восстановлением фертильности у женщин репродуктивного возраста с миомой матки.



