Лейомиомы являются наиболее распространенной доброкачественной опухолью матки, однако они относительно редко встречаются у детей. Хотя лейомиомы чаще всего присутствуют в виде одиночных маточных масс, были описаны необычные модели роста, включая диффузный лейомиоматоз [1]. Диффузный лейомиоматоз матки (ДЛМ) – это редкое и доброкачественное заболевание, при котором развивается бесчисленное множество плохо очерченных, сливающихся гладкомышечных узелков, которые замещают большую часть паренхимы матки, что приводит к симметричному увеличению матки [2]. Микроскопически ДЛМ характеризуется типичными веретенообразными гладкомышечными клетками, образующими переплетения фасцикулярного расположения с плохо определенными клеточными границами, эозинофильной нитевидной цитоплазмой, сигарообразными ядрами, маленькими ядрышками и равномерно низкой митотической активностью [3]. Этиология этих доброкачественных опухолей до конца не изучена [2].
В доступной зарубежной литературе нам встретилась 1 публикация 2012 г. Pai D. et al., которые впервые описали клинический случай ДЛМ у девочки 16 лет. Девочка обратилась к гинекологу с жалобами на острую постоянную боль и чувство давления в брюшной полости и малом тазу. Ей были назначены комбинированные оральные контрацептивы без эффекта. Семейный анамнез был отягощен лейомиомой матки у тети девочки. В остальном у девочки не было дополнительных значимых гинекологических, медицинских, хирургических или семейных заболеваний. Физикальное обследование отличалось значительно увеличенной маткой, возвышающейся над пупком и заполняющей весь малый таз с обеих сторон. По данным магнитно-резонансной томографии (МРТ) малого таза выявлено симметричное увеличение матки множеством образований с плохо определенными границами. На ультразвуковом исследовании (УЗИ) было подтверждено диффузное симметричное увеличение матки с замещением миометрия сливающимися, гетерогенно гипоэхогенными образованиями матки. В отличие от типичного сонографического внешнего вида лейомиом эти массы были неразделимы и не демонстрировали никаких признаков акустического затенения. Впоследствии девочке произвели хирургическое вмешательство в объеме лапаротомической гистерэктомии, вес матки составил 750 г. Микроскопическая оценка показала, что узелки матки полностью состоят из однородных веретенообразных гладкомышечных клеток и фиброзной стромы с повышенной клеточностью. Узелки сливались с плохо очерченными границами друг с другом, плавно переходя в невовлеченный миометрий. Не было выявлено некроза, кровоизлияний, клеточной или ядерной атипии, миксоидных изменений в образцах ткани. Митотическая частота в исследуемых срезах миометрия была очень низкой, были выявлены только редкие митозы. Не было зарегистрировано внутрисосудистого расширения или инвазии в серозный покров матки [1].
Кроме того, в 2020 г. Dai Y.X. et al. ретроспективно проанализировали 33 850 случаев миом матки у женщин, которые прошли хирургическое лечение в отделении акушерства и гинекологии больницы Пекинского медицинского колледжа в период с августа 2009 г. по сентябрь 2019 г. Среди них было диагностировано в общей сложности 6 случаев ДЛМ, что составляет 0,018%, а возраст на момент лечения составлял от 30 до 39 (33±3) лет [4]. Других описаний ДЛМ у детей в доступной литературе и системах баз данных нам не встретилось.
Клиническое наблюдение
В кабинет гинеколога детей и подростков научно-поликлинического отделения ФГБУ «НМИЦ АГП им. В.И. Кулакова» МЗ РФ (далее Центр) в сентябре 2022 г. обратилась пациентка в возрасте 14 лет с жалобами на выраженные боли внизу живота с усилением на 7-е сутки менструального цикла и длящиеся в течение недели, интенсивность болей – до 10 баллов по визуально-аналоговой шкале, по поводу которых пациентке требовался повторный неоднократный прием спазмолитических и анальгетических препаратов (препараты метамизола натрия и дротаверина гидрохлорида снижали боль до 2–3 баллов по ВАШ на 1–2 ч, далее требовался повторный прием). Пациентка отметила появление указанных жалоб в течение последнего года (с сентября 2021 г.), с усилением интенсивности через 2 года после менархе.
Из анамнеза жизни: пациентка родилась от 4-й беременности, 2-х родов, протекавших с угрозой выкидыша, роды путем кесарева сечения. Из перенесенных заболеваний отмечает ветряную оспу, острые респираторные вирусные инфекции, бронхит, гастрит. Перенесенные операции и аллергические реакции отрицает. Гемотрансфузионный анамнез не отягощен. Вредные привычки отрицает. По данным семейного анамнеза: у мамы, ее сестры и бабушки регистрировалась миома матки.
По данным гинекологического анамнеза: возраст менархе в 11 лет, менструации установились сразу, регулярные по 7 дней через 28 дней, обильные, безболезненные.
По данным инструментального обследования по месту жительства выявлены признаки множественных диссеминированных образований в матке, что требовало дифференциальной диагностики между лейомиомой матки и узловой формой диффузного аденомиоза. Пациентке была рекомендована госпитализация во 2-е гинекологическое отделение Центра для дообследования и проведения оперативного лечения.
При поступлении в стационар состояние пациентки удовлетворительное. Сознание ясное, контактна. Девочку беспокоят выраженные боли внизу живота. Кожные покровы и видимые слизистые чистые, бледно-розовой окраски, физиологической влажности, тургор сохранен. Температура тела 36,6°С. Рост 153 см. Вес 47 кг. Индекс массы тела
20,08 кг/м2. Язык чистый, влажный. Физическое и половое развитие соответствует возрасту. Подчелюстные и шейные лимфоузлы при пальпации не увеличены, безболезненные. Молочные железы мягкие, соски не втянуты, чистые, отделяемого из сосков нет. Дыхание ровное, везикулярное, хрипов нет. Частота дыхательных движений 16 в минуту. Сердечные тоны ясные, ритмичные. Частота сердечных сокращений 84 в минуту, пульс удовлетворительной наполненности. Артериальное давление 115/70 мм рт. ст. Живот мягкий, чувствительный при пальпации над лоном, симптомов раздражения брюшины нет. Мочеиспускание свободное, безболезненное. Симптом поколачивания отрицательный с обеих сторон. Стул регулярный, оформленный.
При гинекологическом осмотре: наружные половые органы сформированы соответственно возрасту и полу. Оволосение по женскому типу. Клитор не увеличен. Уретра расположена типично. Гимен бахромчатый, цел. Выделения слизистые, скудные. Ректально – тело матки округлой формы, увеличено в размерах до 70×70 мм, чувствительное при пальпации, подвижное. Придатки не пальпируются. Область выхода тазовых нервов безболезненная.
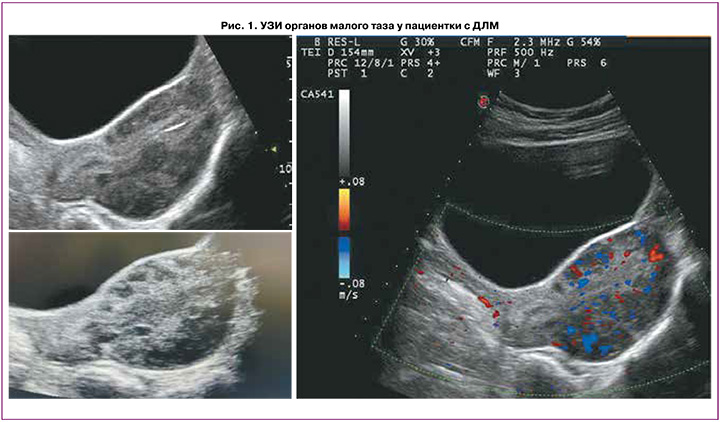
Пациентке выполнено УЗИ органов малого таза на 10-й день менструального цикла (рис. 1). Обнаружено: матка расположена срединно, положение anteflexio, контуры ровные, четкие. Размеры матки: тело 65×51×79 мм, шейка 32×29 мм. Шеечно-маточный угол выражен. Эхо-структура миометрия диффузно неоднородна за счет ячеистой структуры с нечеткими границами. Кровоток при цветном доплеровском картировании усилен. Эндометрий 5,9 мм, однородный. Яичники расположены в углах матки. Правый яичник: 34×15×24 мм. Объем яичника 6,2 см3. Эхоструктура не изменена, содержит фолликулы максимального диаметра 5–6 мм, 6–8 шт. в срезе. Левый яичник: 43×16×22 мм. Объем яичника 8,2 см3. Эхо-структура не изменена, содержит фолликулы максимального диаметра 5–7 мм, 6–8 шт. в срезе. Патологические образования не выявлены. Эхографический диагноз: диффузные изменения миометрия (миоматоз матки?).
По данным УЗИ щитовидной железы: размеры правой доли 16×48×12 мм, объем 4,6 см3, размеры левой доли 14×40×13 мм, объем 3,7 см3, толщина перешейка 2,9 мм, общий объем 8,3 см3, контуры железы четкие ровные, паренхима средней эхогенности, структура неоднородная за счет множественных мелких коллоидных включений – макрофолликулов. Объемные образования не определяются. Васкуляризация ткани железы не изменена. Лимфатические узлы шеи без структурных изменений. Эхографический диагноз: диффузные изменения паренхимы железы (макрофолликулы).
По данным УЗИ молочных желез, области брюшной полости и почек патологии не выявлено.
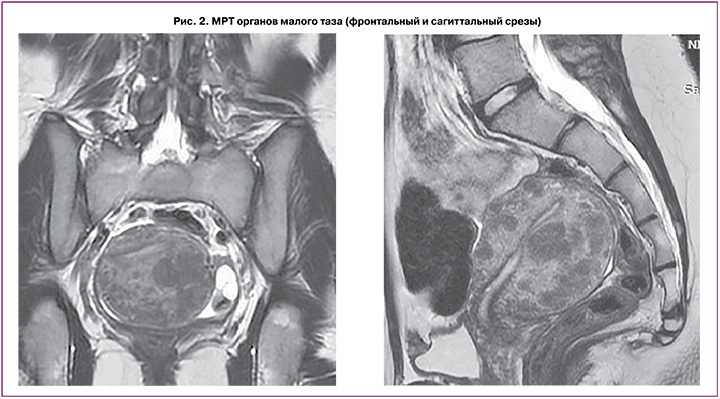
По данным описания снимков МРТ (рис. 2) выявлено, что тело матки умеренно деформировано, увеличено в размерах за счет множественных миоматозных узлов, отклонено кзади, в положении retroflexio, шеечно-маточный угол выражен. Размеры тела матки (без учета миоматозных узлов): продольный – 7,7 см, поперечный – 5,2 см, переднезадний – 6,8 см. Зональная дифференциация маточной стенки снижена. Полость матки минимально деформирована миоматозным узлом. Функциональный эндометрий толщиной до 0,2 см, не утолщен, неоднородной структуры, пристеночных компонентов не определяется. Переходно-соединительная зона с четкими неровными контурами, толщиной до 0,3 см, без распространения в миометрий, в толще миометрия определяются гипоинтенсивные сосуды, на фоне многочисленных миоматозных узлов нельзя исключить мелкие очаги эндометриоза. МР-сигнал от миометрия диффузно неоднородный. В миометрии определяются множественные, диффузно расположенные миоматозные узлы, деформирующие стенку матки, частично сливающиеся между собой (количеством более 15 шт.), размерами от 0,5 см – FIGO 4. В толще задней стенки узел до 2,2×1,6 см, с интерстициальной локализацией, близко к полости матки, с минимально выраженным объемным воздействием на полость матки – FIGO 3. По задней стенке – многочисленные узлы, без контуров, частично сливающиеся между собой, суммарно размеры зоны до 4,3×3,2 см. Все миомы без ограничения DWI. Шейка матки типично сформирована, длиной 3,0 см, цервикальный канал прослеживается на всем протяжении с небольшим количеством серозного отделяемого, слизистая равномерной толщины, области наружного и внутреннего зева – не изменены. Влагалище прослеживается на всем протяжении, стенки равномерной толщины, сомкнуты. Правый яичник расположен у боковой стенки матки, фиксирован, суммарными размерами до 4,0×2,5×2,4 см, капсула утолщена, гипоинтенсивная, строма неоднородна, фолликулы единичные, до 1,3 см. В структуре дополнительных образований не определяется. Левый яичник типично расположен, размерами до 4,0×2,9×21,7 см, фолликулы многочисленные, от 0,5 до 1,3 см, строма яичника неоднородна. В структуре – кисты до 0,9 см и до 1,2 см с геморрагическим содержимым (одна из кист с признаками ограничения DWI). Параовариально определяется утолщенная маточная труба. В полости малого таза незначительное количество свободной жидкости. Патологически измененных лимфоузлов на исследуемом уровне не выявлено. Вены параметральных сплетений полнокровны, расширены. Мочевой пузырь на момент исследования заполнен незначительно, слизистая не изменена, не утолщена. Мочеточники не расширены. Уретра не изменена. В полости таза определяются признаки минимального спаечного процесса. Брюшина полости таза, клетчатка, а также крестцово-маточные связки минимально неоднородны. Заключение МРТ-исследования: МР-признаки множественной диссеминированной миомы матки (FIGO 4, FIGO 3). МР-картина хронического сальпингоофорита, кистозные образования в левом яичнике с геморрагическим содержимым – дифференцировать между эндометриоидными кистами и кистой желтого тела с последствиями кровоизлияния. МР-картина не позволяет исключить единичные мелкие очаги наружного эндометриоза по поверхности матки и яичников, в клетчатке таза. Минимальное количество свободной жидкости в полости таза.
Исследованы основные лабораторные показатели. Данные клинического и биохимического анализов крови, коагулограммы, общего анализа мочи в пределах нормативных значений. Лейкоциты – 5,87×109/л (3,8–9,8×109); эритроциты – 4,62×1012/л (3,9–5,1×109); гемоглобин – 134 (115–145) г/л; гематокрит – 39,1 (34–44)%; тромбоциты – 326×109/л (150–400×109). По данным биохимического анализа крови: общий белок – 73,1 (65–83) г/л; глюкоза – 5,9 (3,9–6,4) ммоль/л; мочевина – 2,3 (1,7–8,3) ммоль/л; креатинин – 71,9 (53–97) мкмоль/л; билирубин общий – 8,1 (3,4–21) мкмоль/л; билирубин прямой – 3,8 (0–5,5) мкмоль/л; лактатдегидрогеназа – 323,6 (207–414) Ед/л; С-реактивный белок – 0,13 (0–5) мг/л; железо – 12,8 (8,8–27) мкмоль/л, ферритин – 13,7 (20–250) мкг/л, все показатели в пределах референсных интервалов.
В коагулограмме не выявлено отклонений от нормативных значений: фибриноген по Клаусу – 2,43 (1,7–3,7) г/л; протромбиновое время – 12,3 (9,5–13) с; протромбин по Квику – 89 (77–125)%, МНО – 1,07 (0,8–1,2); АЧТВ – 33,1 (20–38) с; тромбиновое время – 31,1 (15–25) с.
При гормональном исследовании крови отмечалось снижение уровня пролактина – 191 (388–603) мМе/л; эстрадиола – 162,7 (261–394) пмоль/л; общего тестостерона – 1,07 (1,4–1,8) нмоль/л, а также незначительное повышение уровня кортизола – 486 (212–342) нмоль/л и 17-ОН-прогестерона – 6,5 (0,18–4,17) нмоль/л. Остальные гормоны крови находились в пределах нормативных значений: тиреотропный гормон – 0,96 (0,8–4,2) мМЕ/л; свободный тироксин – 12,1 (10–25) пмоль/л; лютеинизирующий гормон – 5,7 (5,5–9,4) МЕ/л; фолликулостимулирующий гормон – 3,9 (5,1–9,8) МЕ/л; дигидроэпиандростерон-сульфат – 2,8 (0,9–11,7) мкмоль/л; андростендион – 7,98 (1–12,2) нмоль/л. При исследовании онкомаркеров все показатели в пределах нормы: СА 19-9 – 10,44 (0–37) Ед/мл; СА 125 – 20,24 (0–35) Ед/мл; антиген НЕ4 – 44,89 (0–60) пмоль/л, хорионический гонадотропин общий <0,5 (0–10) МЕ/л; альфа-фетопротеин – 0,8 (0–10) МЕ/мл.
На основании жалоб, анамнеза, гинекологического осмотра, результатов лабораторных и инструментальных исследований установлен диагноз: Диффузный лейомиоматоз матки. Наружный генитальный эндометриоз. Латентный дефицит железа.
С целью дифференциальной диагностики опухолевого процесса в матке, диагностики распространенности генитального эндометриоза, исключения лейомиоматоза других отделов брюшной полости и малого таза, получения результатов гистологического исследования пациентке рекомендовано хирургическое лечение. Девочке и ее родителям разъяснены диагноз и выбранная тактика. От законного представителя получено информированное письменное согласие. Проведены лапароскопия, адгезиолизис, удаление субсерозного лейомиоматозного узла и биопсия миометрия матки, коагуляция очагов наружного генитального эндометриоза Дугласова пространства и крестцово-маточных связок, гистероскопия диагностическая.
Хирургическое вмешательство проводилось под комбинированной эндотрахеальной анестезией. Через разрез в области пупка в брюшную полость введен центральный троакар с лапароскопом. Под контролем лапароскопа введены боковые троакары. При ревизии брюшной полости печень, желчный пузырь, желудок, большой сальник, петли тонкого и толстого кишечника, аппендикс без патологии. Визуализировано тело матки в положении anteflexio, однородной окраски, увеличенных размеров до 7×6×8 см. Форма матки бугристая за счет множественных лейомиоматозных узлов разной плотности и размеров до 2 см (рис. 3А, Б). Правый яичник без видимой патологии, нормальных размеров, с капсулой белесоватой окраски. Правая маточная труба просматривается на всем протяжении нормальной окраски, фимбриальный отдел свободен, фимбрии выражены. Левый яичник без видимой патологии, нормальных размеров, с капсулой белесоватой окраски. Левая маточная труба просматривается на всем протяжении нормальной окраски, фимбриальный отдел свободен, фимбрии выражены. В Дугласовом пространстве отмечается перитонеальная жидкость до 10 мл. На брюшине Дугласова пространства, ретроцервикальной области и крестцово-маточных связок визуализируются множественные мелкие поверхностные очаги наружного генитального эндометриоза, прозрачные и красные, суммарными размерами до 3–4 см (рис. 3В).

Далее была проведена диагностическая гистероскопия. При введении во влагалище гистероскопа обнаружено: слизистая влагалища бледно-розовая, складчатая. В куполе влагалища визуализируется шейка матки цилиндрической формы с участком эктопии. Слизистая цервикального канала складчатая. При введении тубуса гистероскопа в полость матки – полость матки округленной формы, не увеличена, без деформаций. Эндометрий бледно-розового цвета, равномерной толщины и окраски. Устья маточных труб с обеих сторон доступны осмотру.
Продолжение лапароскопического этапа: произведен адгезиолизис, сигмовидная кишка отделена от стенки малого таза. Один из лейомиоматозных узлов, имеющий субсерозное расположение в дне матки, фиксирован пулевыми щипцами; после рассечения серозного покрова вылущен с захватом участка миометрия матки для биопсии, удален из брюшной полости и направлен на гистологическое исследование. Стенка матки ушита двухрядным викриловым швом (рис. 3Г). С помощью биполярного коагулятора очаги наружного генитального эндометриоза Дугласова пространства и крестцово-маточных связок коагулированы. Брюшная полость промыта физиологическим раствором и осушена. Произведен контрольный гемостаз. Троакарные раны зашиты наглухо. Асептические наклейки на переднюю брюшную стенку. Общая кровопотеря составила 50 мл. Операция продолжалась 50 минут.
В послеоперационном периоде пациентка получала комплексную антибактериальную, инфузионную и противовоспалительную терапию. Послеоперационный период протекал без осложнений, швы сняты на седьмые сутки, заживление первичным натяжением. В удовлетворительном состоянии пациентка была выписана домой под наблюдение гинекологом по месту жительства. В настоящее время пациентка получает лечение препаратом гестагенов (норэтистерон) с целью облегчения симптомов дисменореи на фоне нестероидных противовоспалительных средств и спазмолитиков (метамизол натрия) в дни менструальных выделений под динамическим контролем. На фоне лечения за 3 месяца наблюдения после выписки не отмечено существенной динамики ультразвуковых размеров матки, в связи с чем гормональная терапия продолжена.
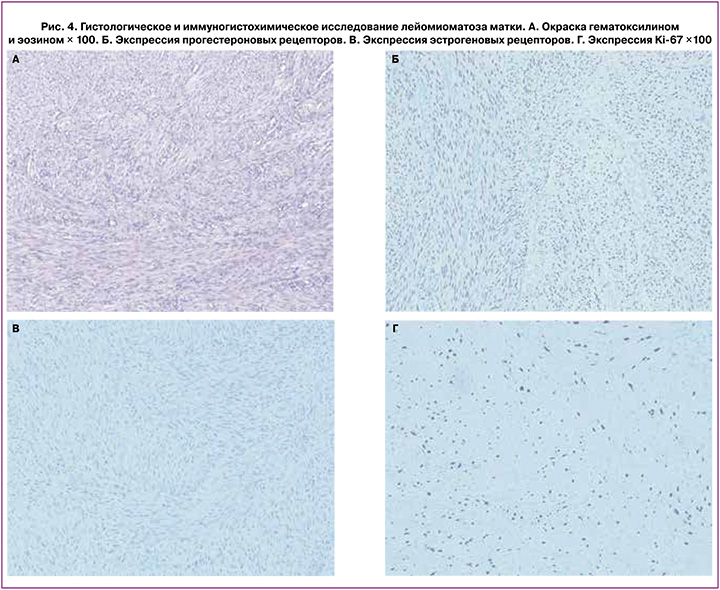
По результатам патолого-анатомического исследования: присланный узел представляет собой участки гладкомышечной ткани из разнонаправленных волокон с гиалинозом. Заключительный патоморфологический диагноз: лейомиоматоз тела матки. Выполнено иммуногистохимическое исследование на экспрессию в миометрии прогестероновых и эстрогеновых рецепторов, а также маркера пролиферации Ki67, результаты представлены на рис. 4. Выявлена экспрессия эстрогеновых рецепторов в 3 балла, прогестероновых рецепторов – 4 балла (по шкале Allred), экспрессия маркера пролиферации Ki-67 – 20%.
Обсуждение
Лейомиомы являются наиболее распространенными доброкачественными новообразованиями матки, которые довольно часто встречаются у взрослого населения [1]. Однако существует необычная модель роста, такая как ДЛМ, о которой известно крайне мало. ДЛМ – это редкое заболевание, при котором бесчисленные, плохо очерченные и сливающиеся узлы приводят к симметричному увеличению матки [5]. В подростковом возрасте лейомиомы матки не являются редкостью, однако ДЛМ зарегистрирован в единичных случаях [1]. Лейомиоматоз можно отличить от лейомиомы благодаря равномерному симметричному поражению всего миометрия между узлами, в то время как случаи множественной лейомиомы имеют тенденцию к асимметричному вовлечению и деформации матки, а также резкому ограничению отдельных узлов [6].
Начальные симптомы ДЛМ у взрослых включают боль в животе, аномальное маточное кровотечение, меноррагию, дисменорею, повышение внутритазового давления и появление симптомов сдавления смежных органов, бесплодие [7]. Поскольку о ДЛМ сообщается редко, знания о нем ограничены. Уровень ранней диагностики низок, и ДЛМ часто ошибочно диагностируется как распространенные множественные лейомиомы матки до операции [3].
В литературе нет конкретных факторов риска, связанных с этим заболеванием, однако можно отметить репродуктивный возраст женщины, афроамериканские корни и семейную предрасположенность к лейомиоме матки [1, 6].
Среди методов инструментальной диагностики УЗИ хоть и должно быть методом визуализации первой линии для оценки заболеваний полости малого таза, матки или яичников, в большинстве случаев МРТ является оптимальным методом визуализации, часто используемым из-за его возможностей контрастирования мягких тканей [7]. Кроме того, МРТ также играет важную роль в дополнительном картировании перед лечением, включая оценку количества лейомиом, размера и их расположения в слоях матки [8].
Сохранение фертильности является трудной задачей в лечении ДЛМ, и риск рецидива после удаления множественных образований матки высок, поэтому полная гистерэктомия в настоящее время считается единственным способом вылечить ДЛМ, когда речь идет о пациентках с реализованной репродуктивной функцией [4].
В августе 2022 г. Ren H.-M. et al. описали клинический случай 27-летней женщины без сексуальной активности, у которой был диагностирован ДЛМ. Пациентке был поставлен диагноз лейомиомы до операции, после чего проведена миомэктомия лапароскопическим и гистероскопическим доступом, длительно назначен аналог гонадотропин-рилизинг-гормона. Авторы подчеркивают, что для женщин, которые хотят сохранить фертильность, консервативная операция должна быть одним из приоритетных вариантов [3].
Среди консервативных методов лечения стоит отметить абляцию высокоинтенсивным сфокусированным ультразвуком (HIFU). В 2015 г. Chen L. et al. провели исследование и описали случай лечения ДЛМ у 38-летней женщины с помощью абляции HIFU. Лечение HIFU привело к прогрессивному уменьшению размеров матки, облегчению клинических симптомов и анемии. Существенных побочных эффектов, связанных с абляцией HIFU, у пациентки не наблюдалось после трех повторных процедур, что продемонстрировало безопасность абляции HIFU при этом заболевании [9].
Кроме того, среди консервативных методов лечения ДЛМ используют эмболизацию маточных артерий (ЭМА), которая является высокоэффективным альтернативным гистерэктомии методом. В 2012 г. Koh J. et al. провели ретроспективное исследование 7 пациенток с ДЛМ, диагностированным на основании МРТ. Через 3 месяца после проведения ЭМА повторная МРТ с контрастным усилением показала полный некроз лейомиоматозных узлов у 5 пациенток (71%). У двух пациенток (28%) лейомиоматозные узлы имели тенденцию к некротизации, некоторые из них были еще жизнеспособны. У всех 7 пациенток наблюдалось улучшение симптомов. В данном исследовании 1 пациентка, страдавшая бесплодием в течение 2 лет, забеременела через 5 месяцев после ЭМА и сохранила беременность без осложнений на 8-м месяце наблюдения [5].
Заключение
Несмотря на редкую частоту ДЛМ в детском возрасте, подобные клинические наблюдения встречаются в практике врача акушера-гинеколога. Учитывая, что в большинстве случаев ДЛМ диагностируется неправильно и диагноз подтверждается только после хирургического вмешательства, часто к моменту установления диагноза матка существенно увеличивается в размерах и деформируется. В указанных ситуациях особое значение приобретает возможность выполнения органосохраняющего лечения. В целях ранней диагностики патологии органов малого таза и выполнения своевременного органосохраняющего лечения всем девочкам-подросткам показано проведение плановых профилактических осмотров, в том числе с УЗИ.



