Проблема плацентарной недостаточности (ПН), несмотря на интенсивное использование новейших методов диагностики и лечения, остается одной из основных причин перинатальной заболеваемости и смертности, и является актуальной не только с медицинской, но и с социальной точки зрения; каждый родившийся ребенок представляет ценность не только для семьи, но и для государства в целом [1].
В настоящее время общепризнанно, что большая часть перинатальной патологии возникает в антенатальный период, а в ее происхождении ведущую роль играют структурно-функциональные нарушения, возникающие в системе мать – плацента – плод, являющиеся основной причиной внутриматочной гипоксии, задержки роста и развития плода, его травм в процессе родов [2, 3].
ПН является одним из наиболее распространенных осложнений беременности, частота встречаемости колеблется от 25 до 45% случаев, значительно возрастая до 77% при сопутствующей экстрагенитальной патологии и других осложнениях гестации [4], и приводит к формированию синдрома задержки роста плода (СЗРП), который занимает третье место в структуре причин перинатальной заболеваемости и смертности [5, 6]. Перинатальная смертность при ПН достигает 60% [7].
В настоящее время доказана роль наследственной и приобретенной тромбофилии матери в развитии ПН и СЗРП. В литературе появляются данные о роли плодовой тромбофилии в формирование ПН, однако данный феномен остается малоизученным и требует дальнейшего изучения. Аномалии коагуляции могут передаваться по наследству плоду как от матери, так и отца, что и обусловливает тромбообразование в плодовой части плаценты. Для уточнения роли фетальной тромбофилии необходимы дальнейшие исследования, включающие не только определение генотипа матери и ребенка, но и отца. Возможно, наличие отцовской тромбофилии, может повышать риск развития акушерских осложнений и определять показания к их профилактике уже на этапе прегравидарной подготовки [8].
Цель исследования: изучить особенности формирования генетически детерминированной патологии гемостаза плода и ее роль в генезе тяжелых форм ПН.
Материал и методы исследования
Обследованы 70 cупружеских пар и их новорожденных, прошедших через клиники ФГБУ Уральский научно-исследовательский институт охраны материнства и младенчества Минздрава России.
В зависимости от характера течения беременности и ее исходов, сформированы следующие группы: основную группу составили 50 семейных пар, беременность которых осложнилась суб- или декомпенсированными формами ПН, и их новорожденные; в контрольную группу вошли 20 супружеских пар без отягощенного акушерского анамнеза, с физиологическим течением настоящей беременности, и их новорожденные.
Критериями исключения являлись: тяжелая экстрагенитальная патология, сахарный диабет, многоплодная беременность, врожденные пороки развития женских половых органов, пороки развития плода.
Всем женщинам, мужчинам и детям основной и контрольной групп проводилось исследование генетических полиморфизмов, ассоциированных с риском развития тромбофилии. У мужчин и женщин определялись антифосфолипидные антитела. У детей и женщин обеих групп проводилась оценка состояния системы гемостаза.
Исследование полиморфизма генов агрегантного состояния крови (F5 1691G> A, F2 20210G> A, FGB 455 G> A, PAI-1 675 5G>4G, ITGA2 807C> T, ITGB3 1565T> C, F7 10976 G> A; F13 103G> T) и ключевого фермента обмена гомоцистеина (MTHFR 677С>Т) проводилось методом полимеразной цепной реакции (ПЦР) в режиме реального времени с использованием детектирующего амплификатора ДТ-96 с автоматическим программным обеспечением (ООО «НПО ДНК-Технология»).
Антифосфолипидные антитела (антитела к протромбину, β2-гликопротеину-1, аннексину V) определялись методом непрямого твердофазного иммуноферментного анализа (ELLISA).
Состояние системы свертывания крови изучалось при помощи клоттинговых тестов и тромбоэластографии (ТЭГ), учитывающей не только плазменный, но и клеточный компонент гемостаза.
Для оценки состояния плазменного звена определялось активированное частичное тромбопластиновое время (АЧТВ), тромбиновое время (ТВ), уровень фибриногена (ФГ), международное нормализованное отношение (МНО), растворимые комплексы фибрин-мономеров (РФМК).
По кривой ТЭГ изучались основные параметры: время реакции (R), отражающее I и II фазы свертывания крови (образование тромбопластина и тромбина); время образования сгустка (К) характеризующее III фазу свертывания (образование фибрина); максимальная амплитуда (МА), определяющая плотность сгустка в основном за счет тромбоцитарного звена; угол α, отображающий скорость роста фибриновой сети и ее структурообразование; коагуляционный индекс CI, являющийся интегральным показателем коагуляции; LY30, характеризующий процесс растворения (лизиса) сгустка.
Состояние внутриутробного плода оценивалось при помощи ультразвукового исследования (УЗИ) с допплерометрией.
Оценка степени тяжести ПН проводилась согласно классификации А.Н. Стрижакова (2003) [8].

УЗИ проводилось в режиме реального времени на аппарате экспертного класса Voluson 730 Expert (General Elektric Medical Systems) с цветным допплеровским картированием. Фетометрия и плацентография проводились по общепринятым методикам. Степень ЗРП и нарушения кровотоков оценивали согласно классификации М.В. Медведева [9].
Для статистической обработки материала использовался пакет прикладных программ Microsoft Excel и программа Statistica 7.0. Сравнение средних значений двух выборочных совокупностей проводили с определением критерия Стъюдента (t) и уровня значимости (p). Статистически достоверным считали различия, уровень значимости (p) которых был менее 0,05.
Различия между непараметрическими переменными проводилось при помощи критерия χ2 Пирсона (Pearson). Относительный риск оценивали по показателю отношения шансов (OR) с 95% доверительным интервалом (95% CL). Нулевая гипотеза отвергалась при р≤0,05.
Тест на соответствие распределения генотипов закону Харди–Вайнберга в обеих выборках проводили с помощью критерия χ2 с использованием программы Hardy-Weinberge quilibrium.
Результаты исследования
Средний возраст супружеских пар по группам исследования достоверно не отличался и составлял в основной группе у женщин 29,06±0,98 года, у мужчин 31,18±1,47 года, против 29,20±1,47 года и 32,56±1,11 года соответственно в группе контроля (p>0,05). Социальный статус, национальная принадлежность и регион проживания были идентичными.
При анализе клинико-анамнестических данных достоверных различий по соматической патологии в основной и контрольной группе не отмечалось (р>0,05).
У пациенток обеих групп основным отягощающим фактором являлся медицинский аборт, удельный вес которого достоверно не отличался и составил 34% (n=17) и 15% (n=3) соответственно.
Кроме того, у пациенток основной группы регистрировалось привычное невынашивание беременности в 16% случаев (n=8), регрессирующая беременность в 22% (n=11), самопроизвольные выкидыши в 24% (n=12), преждевременные роды в 16% (n=8), ПН с исходом в СЗРП в 18% (n=9); преждевременная отслойка нормально расположенной плаценты (ПОНРП) в 12% (n=6); антенатальная гибель плода в 10% (n=5).
У 26% (n=13) пациенток основной группы течение беременности осложнилось преэклампсией средней и тяжелой степени, в контрольной группе имело место физиологическое течение беременности.
При анализе степени тяжести ПН у пациенток основной группы, согласно классификации А.Н. Стрижакова (2003), получено, что субкомпенсированная ПН составила 64% (n=32) случаев. Декомпенсированная ПН составила 34% (n=18) случаев, из них в 22% (n=11) случаев имелось острое течение в виде ПОНРП и в 14% (n=7) антенатальная гибель плода.
При анализе распределения частот генотипов генов тромбофилии у обследованных женщин выявлены достоверно значимые отличия в частоте встречаемости полиморфных вариантов следующих генов: PAI-1-675 5G>4G, ITGB3 1565 T> C, F7 10976 G>A F13 103 G>T, MTHFR 677 C>T (рисунок).
Анализ распределения частот генотипов, а также использование доминантной модели исследования показало, что полиморфный вариант 4G4G гена PAI-1-675 и генотипы, содержащие аллель 4G в гомо и гетерозиготном состоянии (5G4G+4G4G), достоверно чаще встречались у пациенток с ПН, чем в группе контроля (χ2=6,35; p<0,02; OR=2,25; 95% CI=1,19–4,26 и χ2=9,5; p<0,01; OR=2,98; 95% CI=0,96–9,28 соответственно).
PAI-1 обеспечивает до 60% общей ингибиторной активности в отношении активатора плазминогена в плазме крови и тем самым играет важную роль в регуляции фибринолиза. Специфический аллель 4G гена PAI-1 связывают с повышением концентрации PAI-1 в плазме. Плазменная активность PAI-1 значительно выше при гомозиготном носительстве 4G аллеля, чем у гомозигот и гетерозигот по аллелю 5G [10].
Носительство гомозиготной формы 4G/4G-мутации у женщин сопряжено с высоким риском развития осложнений во время беременности, в частности, ПН, тяжелой преэклампсии, ПОНРП и антенатальной гибели плода [11–13].

У обследованных пациенток по группам получены достоверно значимые отличия в частоте встречаемости гомозиготного 1565СС (χ2=7,87; p<0,02; OR=0,41; 95% CI=0,22–0,77) и гетерозиготного 1565TC (χ2=19,09; p<0,00001; OR=5,06; 95% CI=2,34–10,94) варианта полиморфизма гена ITGB3 1565 T>C.
Агрегация тромбоцитов между собой опосредуется фибриногеном; рецептором служит GPIIb/IIIa. Полиморфизм гена, кодирующего β3-субъединицу рецептора GPIIb/IIIa, регулирующего экспрессию или активность тромбоцитарных рецепторов, увеличивает риск невынашивания и антенатальной гибели плода на поздних сроках беременности [14–16].
Гетерозиготный вариант 10976GA гена F7 и гетерозиготный вариант 103GT гена F13 достоверно чаще встречались у женщин без осложненного течения беременности (χ2=9,5; p<0,01; OR=0,35; 95% CI=0,18–0,7 и χ2=10,17; p<0,01; OR=0,39; 95% CI=0,22–0,7 соответственно), что подтверждает литературные данные о протективной роли аллеля 103Т гена F13 и аллеля 10976А гена F7 по отношению к артериальному и венозному тромбозу [17–19].
Сравнительный анализ частоты встречаемости генотипов по полиморфному маркеру 677 C> T гена MTHFR выявил, что у женщин с ПН достоверно чаще встречался аллель 667Т, наличие данного аллеля повышает вероятность развития ПН в 2,4 раза (χ2=8,37; p<0,02; OR=2,46; 95% CI=1,33–4,57). Использование доминантной модели наследования показало, что генотипы, содержащие аллель 677 Т в гомо- и гетерозиготном состоянии (СТ+ТТ) достоверно чаще встречалась у женщин основной группы, в сравнение с контрольной группой. (χ2=12,79; p≤0,003; OR=2,85; 95% CI=1,59–5,1). Патологическая гомозигота 677ТТ гена MTHFR выявлена у 12% женщин основной группы, у женщин контрольной группы данный вариант полиморфизма не встречался.
Мутация в полиморфном гене MTHFR в локусе C677Т изменяет биохимические свойства фермента, вследствие этого нарушается метаболический путь превращения гомоцистеина и его содержание в плазме крови увеличивается, что может приводить к таким осложнениям, как ПОНРП, прерывание беременности, хроническая внутриутробная гипоксия плода и преэклампсия [20].
При исследовании плазменного звена системы гемостаза при помощи скрининговых клоттинговых тестов (табл. 1) у пациенток основной группы отмечено достоверно значимое увеличение концентрация фибриногена в плазме крови в сравнении с пациентками контрольной группой (р<0,05).
В основной группе, в сравнении с контрольной, отмечено достоверное (р<0,05) повышение концентрации в сыворотке крови РФМК, что является признаком активации внутрисосудистого свертывания крови.
По результатам остальных скрининговых тестов достоверно значимых отличий получено не было.
По результатам ТЭГ (табл. 1) у пациенток основной группы отмечено достоверное укорочение интервала R, свидетельствующего об активации I и II фазы свертывания крови и параметра К, характеризующее III фазу свертывания (p<0,05).
Величина угла α (Angle) была наибольшей у беременных с ПН и достоверно отличалась от таковой у пациенток контрольной группы (p<0,05).
Получено достоверно значимое (р<0,05) повышение CI – коагуляционного индекса, характеризующего общий коагуляционный потенциал крови пациента, у пациенток основной группы в сравнении с контролем.
Процесс литического растворения сгустка (показатель LY30) имел достоверные различия у пациенток основной и контрольной группы (p<0,05).
Для оценки вклада отцовской тромбофилии в развитие ПН у женщин был проведен анализ распределения аллей и генотипов по полиморфным вариантов генов агрегатного состояния крови в группах мужчин, при котором выявлены достоверно значимые отличия частоты встречаемости полиморфных вариантов гена PAI-1-675 5G>4G и гена ITGA2 807 C>T (p<0,05) (рисунок).
Гомозиготный полиморфный вариант 4G4G гена PAI-1 675 у мужчин основной группы встречался достоверно чаще, чем в группе контроля (χ2=7,87; p<0,01; OR=2,45; 95% CI=1,3–4,63).
Анализ распределения аллелей и генотипов гена ITGA2 807 C>T в группах мужчин выявил: в основной группе генотип 807 CT встречался чаще, чем в группе контроля (χ2=3,93; р<0,04; OR=2,45; 95% CI=1,3–4,63). Использование доминантной модели наследования позволило установить ассоциацию генотипов, содержащих аллель 807 Т в гомо- и/или гетерозиготном состоянии (СТ+ТТ) с формированием ПН у женщин (χ2=4,15; p<0,04; OR=0,52; 95% CI=0,28–0,98).
Анализ распределения вариантных полиморфных аллелей и генотипов остальных исследуемых нами генов не показал статистически значимых отличий в группах (р>0,05), однако следует отметить, что патологический гомозиготный генотип 677ТТ встречался у 8% мужчин основной группы, у мужчин контрольной группы данного полиморфного варианта выявлено не было.
С целью диагностики иммунной формы тромбофилии, у мужчин и женщины обследуемых групп определялись антифосфолипидные антитела (антитела к протромбину, β2-гликопротеину-1, аннексину V). В связи с отсутствием диагностического титра антифосфолипидных антител, антифосфолипидный синдром у женщин и мужчин обследуемых групп диагностирован не был.
Срок родоразрешения беременных основной группы составил в среднем 34,06±0,48 недель и был достоверно меньше контрольной группы, где средний срок родоразрешения составил 39,45±0,17 недель (р<0,05).
У 68% (n=34) пациенток основной группы роды были преждевременными в связи с осложненным течением беременности.
Учитывая признаки внутриутробного страдания плода пациенткам основной группы в 92% (n=46) случаев произведено абдоминальное родоразрешение. В контрольной группе в 75% (n=15) случаев роды прошли per vias naturales; 25% (n=5) родоразрешены операцией кесарева сечения, показаниями стали: аномалия родовой деятельности и рубец на матке от операции кесарева сечения при отсутствии биологической готовности организма к родам.
Оценка состояния детей на момент рождения проводилась по шкале Апгар на первой и пятой минутах и составила в основной группе 4,98±0,34 и 6,07±0,37 балла соответственно против 7,4±0,11 и 8,16±0,09 балла в группе контроля, что свидетельствует о перенесенной внутриутробной гипоксии плода основной группы (р<0,05). При оценке степени тяжести асфиксии получено, что асфиксия средней и тяжелой степени тяжести встречалась только в основной группе и составила 20,5 и 4,5% соответственно.
При исследовании массо-ростовых показателей в обследуемых группах были выявлены достоверные различия. В основной группе вес и рост новорожденных был достоверно ниже, чем в контрольной 1765,8±63,87 г, 40,94±0,85 см и 3391,7±71,7 г, 51,70±0,36 см соответственно.
Учитывая тяжесть состояния при рождении в 76% (n=38) случаев, новорожденные были переведены в отделение реанимации и интенсивной терапии.
Проведен анализ распределения аллелей и генотипов по полиморфным вариантам тех же генов, что у родителей. Получены достоверно значимые отличия в группах по частоте встречаемости генотипов генов: PAI-1 675 5 G>4G; MTHFR 677 C>T (рисунок).
Полиморфный вариант 4G4G гена PAI -1 675 и генотипы, содержащие аллель 4G в гомо- и/или гетерозиготном состоянии (доминантная модель 5G4G+4G4G), достоверно чаще встречались у новорожденных основной группы, чем в группе контроля (χ2=11,31; p<0,004; OR=2,9; 95% CI=1,54–5,44 и χ2=60,25; p<0,0001; OR=17,25; 95% CI=7,55–39,4 соответственно).
Частота встречаемости патологической гомозиготы гена PAI-1 675 у новорожденных основной группы составила 42%, и была выше, чем у их родителей (36% у женщин и 38% у мужчин).
Патологическая гомозигота гена ITGA2 807 выявлена у 18% основной группы новорожденных и не встречалась в контроле.
Получены достоверно значимые отличия по частоте встречаемости полиморфных вариантов гена MTHFR 677 C>T, генотип CT в 2,7 раза чаще определялся у новорожденных основной группы, в сравнении с контрольной группой (χ2=24,8; p<0,000002; OR=4,7; 95% CI=2,51–8,8). При использовании доминантной модели, генотипы, содержащие аллель 677Т в гомо- и/или гетерозиготном состоянии (СТ+ТТ) достоверно чаще встречались у новорожденных основной группы, чем у новорожденных контрольной группы (χ2=16,82; p<0,0001; OR=3,33; 95% CI=1,85–5,89).
С целью оценки реализации генетически детерминированных форм патологии гемокоагуляции новорожденных проведено ее лабораторное исследование.
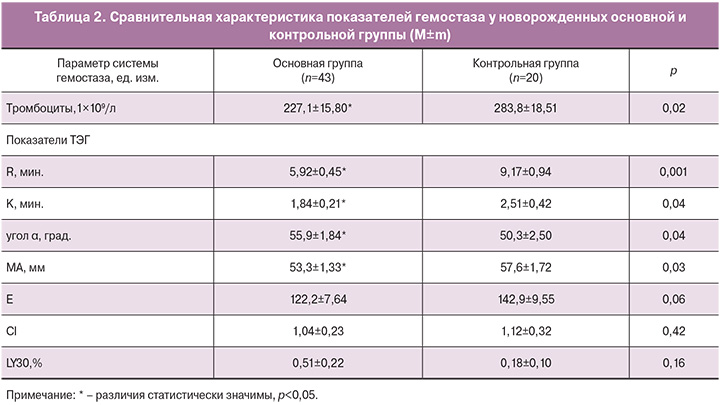
При исследовании гемокоагуляции (табл. 2) у новорожденных основной группы получено достоверно значимое снижение уровня тромбоцитов, в сравнение с контролем. По данным ТЭГ получено достоверно значимое укорочение интервала R (р<0,05), отражающего скорость образования сгустка и характеризующего первую и вторую фазу свертывания крови, и укорочение параметра К, характеризующего кинетику увеличения прочности сгустка. Величина угла α (Angle), характеризующая динамику образования фибрина, была наибольшей у детей основной группы и достоверно отличалась от таковой у новорожденных контрольной группы (p<0,05).
Показатель МА – максимальная амплитуда, который отображает максимальную плотность сгустка и на 80% обусловлен количеством и свойствами тромбоцитов (способность к агрегации) у детей, рожденных от женщин с осложненным течением беременности был достоверно ниже (р<0,05).
Полученные результаты свидетельствуют об активации внутреннего звена гемостаза на фоне достоверно значимого компенсаторного снижения функциональной активности тромбоцитов.
Осложненное течение раннего неонатального периода у детей основной группы послужило основанием для более длительной госпитализации, в 65% (n=28) случаев дети проходили реабилитацию в отделении ранней реабилитации новорожденных, продолжительность госпитализации у этих детей составил от 7 до 81 суток.
Проведена оценка неврологического статуса новорожденных на 3–5-е сутки. Форма и тяжесть гипоксически-ишемического поражения центральной нервной системы диагностировалась с учетом заключения невролога. Церебральная ишемия диагностирована у 83% (n=36) детей, из них у 75% (n=27) имела место церебральная ишемия II–III степени тяжести с проявлением неврологической симптоматики.
Заключение
Тяжелые формы ПН обусловлены не только генетически детерминированной патологией гемостаза матери, но и клинически значимой тромбофилией плода, являющейся следствием тромбофилии обоих родителей. Выявление объективных лабораторных критериев клинических форм тромбофилии родителей может служить важным диагностическим и прогностическим критерием в комплексной оценке состояния фетоплацентарного комплекса и способствовать своевременному выбору мероприятий, направленных на профилактику тяжелых форм ПН.



