Преэклампсия определяется как развитие гипертензии (≥140/90 мм рт. ст.) и значительной протеинурии (300 мг/сут) у ранее здоровых женщин после 20-й недели беременности. Встречается в 8–17% (в среднем в 8%) в России, в США в 7–10%. Это осложнение является одной из главных причин материнской и перинатальной заболеваемости и смертности, уносящей в мире ежегодно 50 000 женщин [1].
В настоящее время установлено, что одним из основных патофизиологических факторов преэклампсии является нарушение перестройки спиральных артерий матки. Спиральные артерии претерпевают основные изменения во время нормальной беременности с целью приспособления к усилению кровотока в матке с 45 мл/мин в небеременном состоянии до 750 мл/мин в родах [2]. Этот процесс преобразования происходит между 6–18-й неделями гестации. За этот период спиральные артерии матки, снабжающие кровью плаценту, претерпевают физиологические изменения, при которых они теряют мышечные и эластические компоненты и трансформируются в широкие воронкообразно растянутые сосуды. Эта «нормальная программа» инвазивного ремоделирования превращает нормальные сосуды с низкой емкостью и высоким сопротивлением в сосуды с высокой емкостью и низким сопротивлением, что обеспечивает адекватный приток крови к плаценте, а следовательно, и к плоду [3, 4].
У пациенток с преэклампсией эта скоординированная программа значительно нарушена. Нормальное ремоделирование спиральных артерий не происходит, в результате чего остаются нерасширенные сосуды с малой емкостью и большой резистентностью. В результате возникает недостаточность кровообращения маточно-плацентарного комплекса. Развивается выраженная гипоксия плаценты, органа, который даже при нормальной беременности находится в относительной гипоксии, в результате этого значительно увеличивается экспрессия генов, индуцируемых гипоксией [5–7].
Хотя признаки преэклампсии проявляются только после 20 недель гестации, неполное ремоделирование сосудов и слабая инвазия трофобласта в плаценте отмечается уже в первом триместре [8].
Нарушение кровотока, обусловленное неполным формированием сосудистой системы, приводит к снижению поступления кислорода от матери к плоду и становится причиной возникновения оксидативного стресса (гипоксии) с ранних сроков беременности. При этом гипоксия не только является результатом нарушения инвазии трофобласта, но и сама может инициировать эти нарушения. Исследования, проведенные как с тканями трофобласта in vitro, так и in vivo на крысах, показали, что повышение экспрессии индуцируемого гипоксией белка HIF-1α сопровождается торможением роста спиральных артерий [8].
Дисфункция эндотелиальных клеток матери является ключевым патологическим моментом, который приводит к большинству клинических проявлений преэклампсии, включая симптомы гипертензии и протеинурии. Эндотелиальная дисфункция является системным патологическим состоянием эндотелия, которое в основном определяется как дисбаланс между вазодилатирующими и вазоконстрикторными субстанциями, выделяемыми эндотелием или влияющими на него [8]. Нарушение функции эндотелия (эндотелиальная дисфункция) – слоя специализированных клеток, выстилающих изнутри сосуды всех органов и тканей, массой 1,5–1,8 кг, суммарной площадью, приблизительно равной площади футбольного поля, лежит в основе многих и многих заболеваний – в том числе гипертонической болезни, атеросклероза, коронарной недостаточности, инфаркта миокарда, инсульта, почечной недостаточности, диабета и инсулиновой резистентности, эндокринных возрастных нарушений, бронхиальной астмы, онкологических заболеваний, заболеваний костей и суставов и др.
 Данные последних лет говорят о том, что дисфункция эндотелия при преэклампсии является следствием антиангиогенного состояния, которое регулируется высоким уровнем растворимой тирозинкиназы (sFlt 1) и растворимыми эндоглинами во взаимодействии с проангиогенными факторами, такими как плацентарный фактор роста (PiGF) и сосудистоэндотелиальный фактор роста (VEGF). Плацента производит sFlt в большом количестве, кроме того, циркулирующие мононуклеарные клетки также являются дополнительным его источником при преэклампсии [9, 10]. Высокий циркуляторный уровень sFlt был обнаружен у беременных с преэклампсией, а степень ее тяжести может коррелировать с уровнем sFlt [11]. Таким образом sFlt работает как мощный ингибитор (PiGF и VEGF) путем связывания этих молекул в кровотоке и других тканях, как например почки. Это подтверждается в эксперименте. Беременным крысам вводили sFlt, что приводило к симптомам преэклампсии: гипертонии и протеинурии [12]. Таким образом, повышенное количество sFlt играет важную роль в индуцировании фенотипа преэклампсии, так как sFlt снижает связывание сосудистоэндотелиального фактора с его рецептором, что в свою очередь снижает фосфориляцию эндотелиальной синтазы окиси азота (e-NOS) с VEGF-эффектом, результирующим действием которого является снижение e-NOS [13].
Данные последних лет говорят о том, что дисфункция эндотелия при преэклампсии является следствием антиангиогенного состояния, которое регулируется высоким уровнем растворимой тирозинкиназы (sFlt 1) и растворимыми эндоглинами во взаимодействии с проангиогенными факторами, такими как плацентарный фактор роста (PiGF) и сосудистоэндотелиальный фактор роста (VEGF). Плацента производит sFlt в большом количестве, кроме того, циркулирующие мононуклеарные клетки также являются дополнительным его источником при преэклампсии [9, 10]. Высокий циркуляторный уровень sFlt был обнаружен у беременных с преэклампсией, а степень ее тяжести может коррелировать с уровнем sFlt [11]. Таким образом sFlt работает как мощный ингибитор (PiGF и VEGF) путем связывания этих молекул в кровотоке и других тканях, как например почки. Это подтверждается в эксперименте. Беременным крысам вводили sFlt, что приводило к симптомам преэклампсии: гипертонии и протеинурии [12]. Таким образом, повышенное количество sFlt играет важную роль в индуцировании фенотипа преэклампсии, так как sFlt снижает связывание сосудистоэндотелиального фактора с его рецептором, что в свою очередь снижает фосфориляцию эндотелиальной синтазы окиси азота (e-NOS) с VEGF-эффектом, результирующим действием которого является снижение e-NOS [13].
Fiore и соавт. (2005) [14] обнаружили, что эндотелин-1 (ЭТ-1) является фактором, который повышается при преэклампсии в сравнении с нормально протекающей беременностью. В плазме здоровых беременных концентрация ЭТ-1 колеблется от 5 до 10 пг/мл, тогда как при преэклампсии – от 20 до 50 пг/мл.
Эндотелины представляют собой семейство вазоактивных пептидов, которые выполняют ключевые физиологические функции здоровой ткани, моделируя тонус сосудов, дифференцировку тканей, пролиферацию клеток и образование гормонов [15].
Семейство эндотелинов включает 3 изоформы, каждая из которых состоит из 21 аминокислоты (ЭТ-1, ЭТ-2, ЭТ-3). ЭТ-1 является самым распространенным членом этого семейства [16], синтезируется и секретируется синцитиотрофобластом и эндотелиальными клетками. ЭТ-1 проявляет свой эффект, связываясь с рецепторами ЭТ-А и ЭТ-В, двумя высокогомогенными белками, расположенными на поверхности клеток, которые принадлежат к большому семейству рецепторов, сопряженных с «G» белками. В момент связывания с этими рецепторами ЭТ-1 инициирует ключевые события в широком спектре тканей-мишеней. ЭТ-1 является потенциальным вазоактивным пептидом, и, учитывая его высокие концентрации при преэклампсии, было проведено исследование, посвященное роли ЭТ-1 в развитии гипертензии при преэклампсии. Обнаружено, что ЭТ-1 действительно вызывает вазоконстрикцию путем воздействия на рецептор ЭТ-А, который способствует развитию гипертензии при преэклампсии. В эксперименте было показано, что антиангиогенная белок-растворимая sFlt-подобная тирозинкиназа-1, провоспалительные цитокины и аутоантитела к агонистам рецепторов к ангиотензину ІІ типа 1 могут индуцировать развитие гипертензии путем продукции ЭТ-1 [9, 17]. Предполагают, что эти факторы вызывают повреждение эндотелиальных клеток, что снижает синтез вазорелаксирующих веществ и повышает образование вазоконстрикторов. Это обеспечивает потенциальный механизм, при котором повышается концентрация ЭТ-1, которая затем посредством воздействия на ЭТ-А-рецепторы индуцирует вазоконстрикцию, что и приводит к гипертензии.
Считается, что симптомы преэклампсии разрешаются после родов, однако некоторые исследователи показали, что дисфункция эндотелия у матери может продолжаться годы после одного эпизода преэклампсии [18, 19]. Увеличение уровня ЭТ-1 у женщин с преэклампсией может быть связано с повышением активности эндотелин-превращающего фермента в кровотоке, которое сохраняется и в послеродовом периоде, что, возможно, объясняет возникновение эклампсии в послеродовом периоде. Многие авторы подтверждают тот факт, что преэклампсия связана с удвоенным риском сердечно-сосудистых, церебро-васкулярных заболеваний и заболеваний переферических сосудов в дальнейшем [20–23]. Более того, такие женщины демонстрируют более высокий риск развития диабета, сердечно-сосудистых заболеваний и гипертонии [24]. Дисфункция эндотелия и другие сосудистые нарушения, наблюдающиеся при преэклампсии, начинаются на ранних сроках беременности, хотя серьезные сосудистые осложнения становятся очевидны после 20-й недели беременности, что очень важно для принятия терапевтических и превентивных мер.
Фенотипические эффекты поврежденного эндотелия матери понятнее всего демонстрируются на почках, где можно увидеть гломерулярный эндотелиоз, генерализованный отек и вакуолизацию эндотелиальных клеток [21, 25]. VEGF играет главную роль в поддержании нормальной гломерулярной эндотелиальной целостности. Более того, исследования ангиогенеза in vitro показали, что экзогенные VEGF/PiGF или антитела к sFLT-1 могут обратить вспять антиангиогенные эффекты преэклампсической плазмы [26].
Повреждение подоцита и снижение специфической экспрессии белков подоцитов способствуют развитию протеинурии и преэклампсии. Экскреция подоцит-специфических протеинов в моче, таких как подокалицин, нефрин и Big-h3 была значительно повышена у беременных с преэклампсией.
Важная роль в патогенезе преэклампсии принадлежит иммунной системе матери, обеспечивающей защиту антигенно чужеродного плода от отторжения. Развитие заболевания обычно сопровождается повышением в крови матери концентрации воспалительных цитокинов (интерлейкина (IL)-6, IL-12, фактора некроза опухоли α (TNFα), γ-интерферона) и, наоборот, снижением противовоспалительного цитокина IL-10 [27].
При нормальной беременности наблюдаются изменения иммунного ответа Th-2-типа, что защищает плод от Th-1 (цитотоксического) воздействия, предотвращает повреждение плода IL-2, IL-12, γ-интерфероном и TNFα, то есть собственными продуктами. Таким образом, воспаление является связующим звеном между адаптивным иммунным ответом и появлением преэклампсии. Системное воспаление при преэклампсии работает в пользу реакции типа Th-1 [28].
Redman и соавт. первоначально предположили, что преэклампсия возникает в результате чрезмерного сосудистого воспалительного ответа матери [29].
Некоторые авторы также сообщают об избытке растворимых маркеров активации нейтрофилов при преэклампсии [30], в то время как другие авторы продемонстрировали амплификацию воспаления при преэклампсии [31]. TNFα, цитокины и IL-6 повышены у беременных с преэклампсией. Тем не менее, роль воспаления как причины преэклампсии снижается при попытке найти непосредственную и постоянную связь между усилением воспалительного статуса и клиническими проявлениями преэклампсии [32]. У беременных женщин с выраженным воспалительным процессом и высоким уровнем цитокина, как при инфекциях, не всегда развивается преэклампсия [1].
TNFα – один из наиболее изученных воспалительных цитокинов, уровень которого повышен у беременных с преэклампсией. La Marka и соавт. на основании своих экспериментальных данных пришли к выводу, что экспрессия ЭТ-1 хотя бы частично регулируется повышением TNFα [33]. В ответ на введение TNFα у беременных крыс среднее артериальное давление повышалось на 20 мм рт. ст. Также в аорте, плаценте, тканях почек грызунов после введения TNFα имело место сопутствующее повышение экспрессии препроэндотелина. Более того, совместное назначение антагонистов ЭТ-А рецепторов полностью предотвратило развитие гипертензии в ответ на введение TNFα. Интересно, что введение TNFα девственным крысам не привело к значительному повышению ни артериального давления, ни экспрессии препроэндотелина, что, возможно, означает, что беременность приводит к повышенной сенсибилизации к TNFα [34]. Эти данные соответствуют результатам, полученным in vitro, демонстрирующим, что экспрессия ЭТ-1 эндотелиальными клетками частично регулируется действием TNFα.
Важную роль в развитии симптомов, а возможно, и в этиологии преэклампсии играют аутоиммунные процессы [35, 36]. Известны два одинаково важных материнских ответа: опосредованный воспалительными цитокинами и продукцией аутоантител к рецепторам типа 1 ангиотензина II (АТ1 – АА). Открытие данных патогенетических путей вновь указывает на центральную роль ЭТ-1 в прогрессировании заболевания.
Идентификация циркулирующего AT1 – AA – один из самых интересных аспектов преэклампсии, возникший в последние годы. Оказалось, что эти антитела, изначально обнаруженные в крови беременных с преэклампсией, in vitro индуцируют реактивную выработку кислорода [37]. Продукция AT1 – AA, вероятно, напрямую связана с ишемией плаценты посредством индукции TNFα. В последующих исследованиях было продемонстрировано, что инфузия очищенных AT1 – AA беременным крысам привела к повышению среднего артериального давления на 20%. Анализ уровня экспрессии препроэндотелина тканями показала значительное увеличение экспрессии, демонстрируя тем самым, что активация AT1 рецепторов AT1 – AA может играть решающую роль в продукции ЭТ-1 во время преэклампсии. Блокада ЭТ-А рецепторов полностью предотвратила повышение артериального давления в ответ на введение AT1 – AA, демонстрируя, что ЭТ-1 является центральным фактором в патологии преэклампсии [38]. Итак, ЭТ-1, особенно действующий через ЭТ-А рецепторы, играет важную роль в этиологии преэклампсии.
Важную роль в развитии преэклампсии играет окислительный стресс, возникающий в результате избыточного накопления свободных радикалов в результате развития воспалительных процессов [39]. Окислительный стресс приводит к высвобождению в кровоток матери комплекса факторов, включая провоспалительные цитокины, регуляторы ангиогенеза, остатки подвергшихся апоптозу клеток. Более того, при окислительном стрессе происходит увеличение в кровотоке концентрации ЭТ-1 в результате его высвобождения из синцитиотрофобласта плаценты [2].
Патология спиральных артерий матки, кровоснабжающих плаценту, приводит к чрезмерному сужению артерий, тем самым подвергая плаценту постоянному ишемическому-реперфузионному повреждению, которое приводит к окислительному стрессу [39], что, по-видимому, и является причиной повышения концентрации ЭТ-1 при преэклампсии. Однако ЭТ-1 – сам по себе источник окислительного стресса при преэклампсии [14], то есть повышенная продукция ЭТ-1 при окислительном стрессе может работать по принципу положительной обратной связи, чтобы усилить окислительный стресс и таким образом увеличить продукцию ЭТ-1.
Наряду с окислительным стрессом значительную роль в патофизиологии преэклампсии играет стресс эндоплазматического ретикулума клеток плаценты [40, 41]. Эндоплазматический ретикулум – это мультифункциональная клеточная органелла, которая участвует в синтезе и формировании третичной структуры мембранных и секреторных белков. Кроме этого, она функционирует как резервуар ионов Са2+ [41].
Нарушение гомеостаза Са2+ приводит к ингибированию синтеза и посттрансляционной модификации белков, что является триггером для активации белков стресса эндоплазматического ретикулума. Было показано, что повышение в крови беременной уровня ЭТ-1 является потенциальной причиной и этого стресса при преэклампсии [2]. ЭТ-1 связывается с ЭТ-β-рецепторами и вызывает высвобождение Са2+ из эндоплазматического ретикулума, и таким образом, стимулирует стресс эндоплазматического ретикулума.
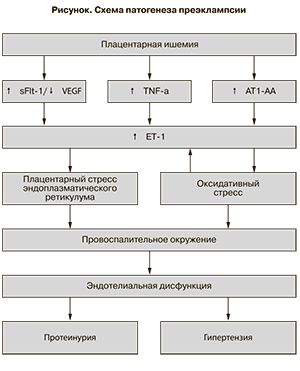
На рисунке приведена схематическая картина патогенеза преэклампсии с участием ЭТ-1, представляющая собой модификацию схем, взятых из работ E.M. George, J.P. Granger [17] и A. Jain и соавт. [42]. Нарушение плацентарного кровотока, обусловленное неполным формированием сосудистой системы, приводит к ишемии плаценты, которая в свою очередь индуцирует повышенную экспрессию ЭТ-1 несколькими путями: усилением продукции в плаценте растворимой тирозинкиназы (sFlt 1), являющейся прямым антагонистом сосудисто-эндотелиального фактора роста (VEGF), а также усилением выброса в кровь фактора некроза опухоли (TNFα) и аутоантител к рецепторам типа 1 ангиотензина II (АТ1 – АА). Повышенный уровень ЭТ-1, в свою очередь, индуцирует оксидативный стресс и стресс плацентарного эндоплазматического ретикулума, в результате чего развивается локальный воспалительный процесс, возникает эндотелиальная дисфункция, сопровождающаяся повышением артериального давления и протеинурии.
Использование антагонистов эндотелиновых рецепторов может блокировать как окислительный стресс, так и стресс эндоплазматического ретикулума. Дальнейшее изучение роли эндотелина-1 в развитии преэклампсии, может привести к разработке возможных стратегий обхода этих стрессовых путей и ассоциированных с ними патологических состояний при преэклампсии.



