В настоящее время в мире проживают 2716 млн женщин в возрасте от 15 лет и старше, которые имеют риск развития рака шейки матки (РШМ). Цервикальная неоплазия занимает 4-е место в общей структуре смертности женщин в мире от рака и 2-е место – в возрастной группе от 15 до 44 лет. Согласно отчету Всемирного информационного центра по ВПЧ-инфекции в декабре 2016 г. (HPV Information Centre), за последний год было выявлено 265 672 новых случаев рака шейки матки, из них 265 672 закончились летально. Показатели заболеваемости и смертности от РШМ в мире на текущий период составляют 14,0 и 6,8 на 100 000 женского населения (соответственно) и варьируют от 15,7 и 8,3 на 100 000 в низкоресурсных странах до 9,9 и 3,3 – в странах с высоким уровнем экономического развития [1]. По прогнозам экспертов ВОЗ, при отсутствии должного внимания и задержке с принятием необходимых мер в течение ближайших 10 лет смертность от рака шейки матки возрастет на 25% [2].
За последние три десятилетия в большинстве развитых стран мира заболеваемость раком шейки матки снизилась, в значительной степени благодаря планомерной работе государственных скрининговых программ [3, 4]. Современные стратегии повышения результативности профилактики рака шейки матки направлены на организованное (активное привлечение), а не оппортунистическое («стихийное, при возможности») проведение цитологического скрининга. Вовлечение в обследование большего числа женщин также является перспективной мерой повышения результативности профилактики рака шейки матки [3–5].
Внедрение новых технологий и методов исследований – еще одно направление совершенствования скрининговых программ. После установления роли вируса папилломы человека (ВПЧ) в цервикальном канцерогенезе во многих странах стали активно включать выявление ВПЧ высокого онкогенного риска в программы скрининга РШМ [5–9].
Немаловажной проблемой в реализации скрининговых программ по профилактике РШМ является нежелание пациенток посещать врача гинеколога из-за неприятных ощущений, возникающих во время забора материала для цитологического исследования и ВПЧ-теста. В связи с этим в последние годы в мире разработаны различные устройства для самозабора вагинальных выделений для диагностики ВПЧ и дана оценка их диагностической ценности, экономической эффективности и удобству применения [10–18].
Цель настоящего исследования – дать оценку эффективности и приемлемости обследования на вирус папилломы человека высокого канцерогенного риска (ВПЧ-ВР) при самостоятельном и врачебном заборе вагинального отделяемого.
Материал и методы исследования
Выполнено кросс-секционное исследование, в которое вошли 200 сексуально активных женщин репродуктивного возраста (18–45 лет, средний возраст 32,7±6,9 года), обратившихся в поликлинику № 4 города Читы для прохождения медицинского осмотра с целью получения допуска к работе. Исследование утверждено Этическим комитетом Читинской государственной медицинской академии и согласовано с Минздравом Забайкальского края. Все женщины были проинформированы о целях и дизайне исследования, ознакомлены с инструкцией по применению устройства Qvintip и противопоказаниями. Критериями включения в исследование были возраст 18–45 лет, отсутствие беременности и кровянистых выделений из половых путей, письменное информированное добровольное согласие пациентки.
Взятие материала для исследования на ВПЧ-ВР было проведено с помощью двух методов: самостоятельно женщиной из влагалища при помощи устройства Qvintip (согласно инструкции) и врачом из цервикального канала при помощи универсального урогенитального зонда (тип А). Материал, полученный врачом, помещался в пробирку типа «Эппендорф» с транспортной средой; материал, взятый женщиной самостоятельно, помещался в сухую пробирку без транспортной среды (согласно инструкции Qvintip). Образцы биологических проб маркировались по порядковым номерам забора и были полностью обезличены, то есть не содержали персональных данных и сведений анамнеза пациенток. Оба образца исследовались в одинаковых условиях и одним методом – в лаборатории ЗАО «Сиблабсервис» г. Новосибирска (лицензия № 54-01-002699 от 30.05.2015 г.). Выявление и дифференциацию 12 наиболее распространенных генотипов ВПЧ-ВР (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) проводили методом ПЦР в режиме реального времени.
На основании результатов обследования на ВПЧ-ВР обследуемые пациентки были разделены на 2 клинические группы: 1-я – 84 женщины, инфицированные ВПЧ-ВР; 2-я – 116 ВПЧ-ВР-негативных женщин. Всем исследуемым проведено письменное анонимное интервьюирование по специально составленной анкете, включающей вопросы о медико-социальном статусе (возрасте, времени начала менархе и коитархе, паритете, методах контрацепции и др.). Анкеты были пронумерованы в соответствии с номером на пробирках с взятыми образцами биологических проб и полностью обезличены.
Удобство и приемлемость самостоятельного и врачебного взятия вагинального отделяемого для ВПЧ-теста оценены на основании письменного опроса пациенток по 5-уровневой шкале Likert [19]. Каждый показатель оценивался по 5 признакам: комфорт (0 баллов – очень комфортно, 1 – комфортно, 2 – слегка некомфортно, 3 – умеренно некомфортно, 4 – очень некомфортно); боль (0 баллов – нет, 1 – дискомфорт, 2 – слегка болезненно, 3 – умеренно болезненно, 4 – очень болезненно); конфиденциальность (0 – отсутствие, 1 – не хватало, 2 – нейтрально, ни да ни нет, 3 – достаточная, 4 – полная); смущение (0 баллов – очень сильное, 1 – сильное, 2 – умеренное, 3 – легкое, 4 – отсутствие). Обобщенные показатели удобства и приемлемости были рассчитаны как сумма индивидуальных оценок по шкале Likert (минимальное количество баллов – 4, максимальное – 16).
Статистическая обработка результатов произведена с помощью пакета программ Statistica 10. Достоверность разницы между двумя средними показателями оценивали по критерию Стьюдента (t); между долями – по критерию χ2. Значения считали статистически достоверными при величине χ2>3,84, при р≤0,05. Эффективность сравниваемых методов выявления ВПЧ инфекции оценивали по отношению шансов при 95% доверительном интервале.
Результаты исследования
Медикосоциальная характеристика пациенток сравниваемых групп не отличалась и представлена в табл. 1. Частота выявления ВПЧ-ВР в когорте обследованных женщин составила 42% (84/200). Наибольшее число ВПЧ-ВР-позитивных пациенток было в возрастной группе 25–35 лет (41,7%, 35/84). Обращает внимание, что удельный вес ВПЧ-ВР инфицированных в возрасте 18–25 лет был в 2,2 раза больше, чем у женщин с отрицательным результатом ВПЧ-ВР-теста (27,4% vs 12,9%, p=0,01). Эти женщины чаще имели трех и более половых партнеров (61,9% vs 44,0%, p=0,01).
Результаты ВПЧ-тестирования показали, что в целом эффективность обследования с помощью устройства Qvintip была выше, чем при заборе материала врачом: 38% vs 27,5% (ОШ=1,6; 95% ДИ 0,48–2,45). ВПЧ-ВР выявлен обоими методами у 84 (42%) человек, только при самостоятельном взятии вагинальных выделений (Qvintip) – у 29 (36,3 %) женщин, только при заборе исследователем – у 8 (9,5%) пациенток (ОШ=5,0; 95% ДИ 1,61–6,71). Таким образом, использование только устройства Qvintip повышает шанс выявления ВПЧ-ВР в 5 раз по сравнению с забором материалом врачом.
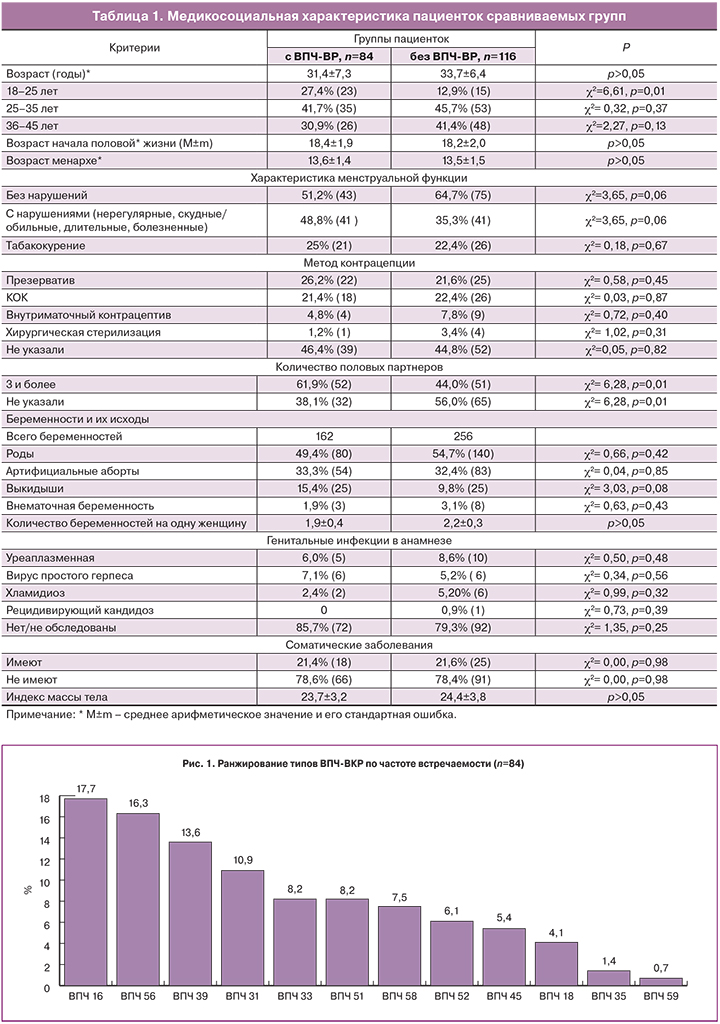
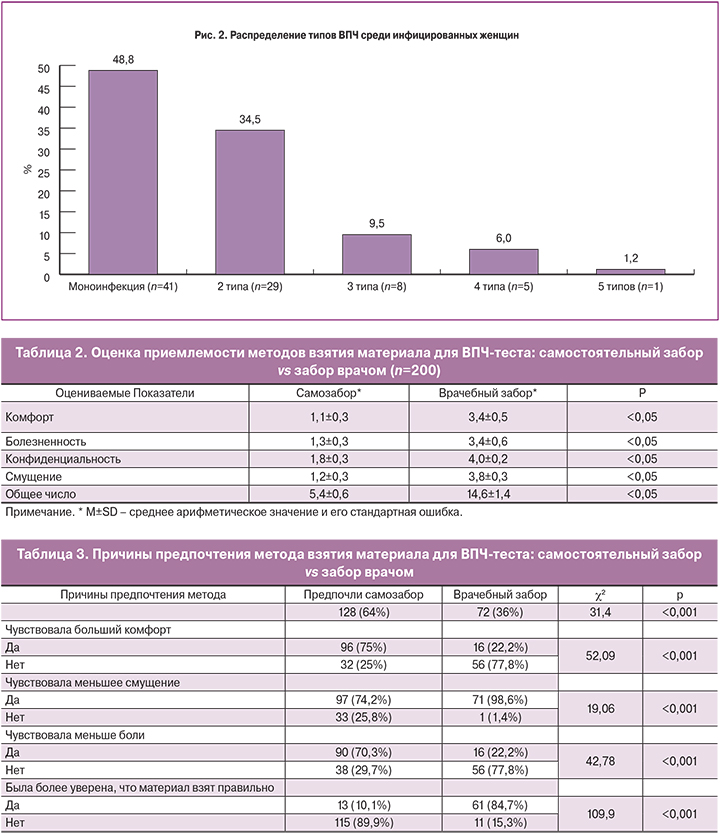
Частота выявления ВПЧ 16-го типа была наибольшей (17,7%), реже идентифицированы ВПЧ-56 (16,3%), ВПЧ-39 (13,6%); ВПЧ-31 (10,9%); ВПЧ-33 и ВПЧ-51 (по 8,2%); ВПЧ-58 (7,5%); ВПЧ-52 (6,1%); ВПЧ-45 (5,4%); ВПЧ-18 (4,1%); ВПЧ-35 (1,4%); ВПЧ-59 (0,7%) (рис. 1). Вирус папилломы человека в виде моноинфекции выявлен у 48,8% (41/84) пациенток. У 51,2% (43/84) ВПЧ-позитивных женщин обнаружены несколько типов ВПЧ-ВР: два – в 34,5% (29/84) случаев, три – в 9,5% (8/84), четыре – в 6% (5/84), пять – в 1,2% (1/84) (рис. 2). ВПЧ 16-го типа сочетался с 18-м типом в 3,6% (3/84) наблюдений и чаще, чем ВПЧ 18, идентифицировался в комбинации с другими генотипами (31, 33, 45, 52, 58): 15,5% (13/84) vs 3,6% (3/84, c2 =6,91; p=0,009).
При оценке удобства и приемлемости двух сравниваемых методов взятия материала для ВПЧ-теста по 5-уровневой шкале Likert все женщины отметили, что метод самостоятельного забора с помощью устройства Qvintip более комфортный, безболезненный, конфиденциальный, не вызывал смущения (чувства стыда или неловкости) (все p<0,05) (табл. 2).
При общей оценке 64% (128/200) пациенток отдали предпочтение методу самостоятельного забора материала для ВПЧ-теста, доля обследуемых, предпочитающих врачебное взятие образцов, была существенно меньшей – 36% (72/200) (p<0,001) (табл. 3). Сравнение аргументов у женщин, которые предпочитают самостоятельное взятие образцов с теми, кто предпочитал врачебный забор, показало, что причины их предпочтения существенно отличались. Основными причинами, по которым пациентки выбрали метод самозабора, были ощущение большего комфорта (75% vs 22,2%, р<0,001), меньшей болезненности (70,3% vs 22,2%, р<0,001) и меньшего смущения (25,8% vs 1,4%, р<0,001). Единственной причиной предпочтения взятия образца ДНК ВПЧ врачом является большая уверенность, что материал взят правильно (10,1% vs 84,7%, р<0,001). В будущем предпочли бы самостоятельно производить забор материала для ВПЧ-теста подавляющее большинство участниц исследования (96% vs 4%, p<0,001), поскольку это просто и не требует визита к врачу.
Обсуждение
Согласно полученным нами данным, частота выявления ВПЧ-ВР в когорте обследованных женщин в возрасте 18–45 лет составила 42%. По сведениям ВОЗ и Информационного центра по ВПЧ-инфекции, распространенность этой инфекции зависит от многих немедицинских факторов: социально-экономического уровня развития страны, возраста и социального статуса пациенток и др. [1–3, 20]. Ранее мы показали, что значимыми факторами риска инфицирования ВПЧ женщин раннего фертильного возраста являются использование КОК в течение 5 лет и более (ОР=15,4), хронический тонзиллит (ОР=4,6), частые острые респираторные инфекции (ОР=3,7), курение (ОР=3,4), хроническая анемия и хронический пиелонефрит (ОР=3,1), колонизация генитального тракта условно-патогенными (ОР=4,6) и патогенными (ОР=2,4) микроорганизмами, возраст 20–26 лет (ОР=1,6), отказ от использования презерватива (ОР=1,5) [21].
Исследование Н.В. Артымук, К.В. Марочко (2016), проведенное, как и наше, в Сибирском Федеральном округе, выявило несколько меньшую распространенность ВПЧ-ВР-инфекции – 36,7% [22].
Данный факт, на наш взгляд, связан с более поздним возрастом обследованных пациенток, включенных в это исследование – 25–59 лет. По данным мировой статистики, удельный вес ВПЧ-позитивных пациенток в возрастной группе менее 25 лет существенно выше (около 30%), чем у женщин старшего возраста (25–34 года – около 12%, 35–44 года – около 6%, 45–65 лет – менее 5%) [1]. Сходные эпидемиологические данные получены в других регионах Сибири М.К. Мерзляковой и соавт. (2012): общая ВПЧ-инфицированность женщин, проживающих в Томской области, составляет 49,4% (возраст 36,8±0,5 года), в республике Тыва – 38,2% (возраст 44,1±1,0 года) [23].
Сочетание ВПЧ-16/18 типов, повышающее риск интраэпителиальных поражений шейки матки, обнаружено нами у 3,6% обследованных, а комбинация типов ВПЧ-16 и ВПЧ-31, 33, 45, 58 отмечена у каждой десятой пациентки (9,5%). Выявленная широкая распространенность ВПЧ-ВР у женщин репродуктивного возраста в сочетании с высокими показателями заболеваемости раком шейки матки в Забайкальском крае (2015 год – 485,1; РФ – 222,7 на 100 000 женского населения [24]) служат основанием для активизации работы по профилактике рака шейки матки в регионе и оптимизации программ цервикального скрининга населения.
Наиболее распространенные причины, по которым женщины в разных странах мира не посещают скрининг на РШМ: отсутствие времени, боязнь боли при проведении гинекологического исследования [25]. В большом мультиэтническом исследовании, проведенном в Малайзии (2016), показано, что пациентки, которые никогда не проходили цитологический скрининг на РШМ, значительно чаще (88,5%) предпочитали самостоятельное взятие образцов для ВПЧ-исследования [18]. В Канаде женщины в 1,8 раза чаще выбирали самотестирование [25], в Швеции – чаще в 3 раза [26]. В Испании 68% женщин выразили готовность проводить самозабор материала дома, если врач даст им тест; 71% – если тест им направят по почте [27].
При оценке удобства и приемлемости метода самостоятельного забора материала для ВПЧ-теста с помощью устройства Qvintip в сравнении с взятием образца врачом 64% обследованных нами женщин отдали предпочтение методу самозабора (p<0,001). Основными причинами такого выбора были безболезненность, больший комфорт и конфиденциальность, меньшее чувство стыда и неловкости. Среди отдавших предпочтение взятию образца ДНК ВПЧ врачом основным мотивом была большая уверенность, что материал взят правильно.
М. Jentschke и соавт. (2016) сравнили отзывы пациенток, проводивших самозабор влагалищного секрета с использованием прибора Qvintip (Aprovix) и щеточки Evalyn (Evalyn Brush, Rovers Medical Devices), и сделали вывод: женщинам было легче понять технику взятия образца (р<0,001) и использовать устройство Qvintip (р=0,002) [15].
В дальнейшем предпочли бы самостоятельно производить забор материала для ВПЧ-теста 96% участниц нашего исследования (p<0,001). По данным H.H. Chou и соавт. (2015), большинство женщин, прошедших самотестирование, отмечают простоту и удобство метода (90,8%) и порекомендуют пройти этот вид обследования своим знакомым (88,3%) [28].
В исследовании F. Sultana и соавт. (2015) 88% пациенток предпочтут самостоятельный забор материала для ВПЧ-теста дома в будущем, потому что этот метод прост, не требует визита к врачу и не связан с эмоциональными переживаниями [18].
Согласно сведениям литературы, чувствительность метода Qvintip составляет 78,3% по сравнению с забором материала врачом [22], что позволяет считать обоснованным применение данного устройства в программах скрининга РШМ. Все исследователи единодушны во мнении, что самостоятельное взятие образцов ДНК ВПЧ может быть альтернативным методом цервикального скрининга и способствовать существенному увеличению охвата населения, участвующего в скрининговых программах [11, 12, 14]. Особенно это касается женщин, испытывающих практические или эмоциональные препятствия для визита к врачу, не регулярно проходящих профилактический осмотр или полностью отказывающихся от цитологического скрининга [29, 30]. Безусловно, предстоит отработать техническую и экономическую стороны метода, а также провести большую информационную работу по пропаганде и популяризации самостоятельного взятия материала для ВПЧ-теста [13, 14].
Заключение
Полученные данные свидетельствуют о высокой распространенности инфицирования ВПЧ высокого онкогенного риска среди организованных женщин репродуктивного возраста (42%). Более половины этих женщин являлись носителями двух и более типов ВПЧ (51,2%). Частота выявления ВПЧ при обследовании с помощью устройства Qvintip была в 1,6 раза выше, чем при заборе материала врачом (38% vs 27,5%). Выявлена высокая комплаентность пациенток к методу самостоятельного взятия образца для ВПЧ-теста, что обусловлено простотой использования, большей комфортностью, безболезненностью и приватностью метода. Таким образом, устройство Qvintip для самостоятельного взятия образца ДНК ВПЧ является простым и удобным в использовании, обладает высокой диагностической эффективностью и может быть рекомендовано для выявления ВПЧ высокого канцерогенного риска с целью увеличения численности населения, участвующего в программах скрининга на рак шейки матки.
Благодарности
Авторы выражают благодарность Министру здравоохранения Забайкальского края доктору медицинских наук Давыдову Сергею Олеговичу, заместителю главного врача Городской поликлиники № 4 г. Читы Веселкову Александру Викторовичу за содействие в организации исследования, врачам акушерам-гинекологам Пальцевой Татьяне Викторовне и Низелькаевой Людмиле Юрьевне за проведение гинекологического обследования пациенток и забор образцов для ВПЧ-теста.



