Одной из наиболее значимых проблем акушерства и перинатологии является преэклампсия, которая наряду с другими гипертоническими расстройствами беременности осложняет 2–8% беременностей и входит в число ведущих причин материнской и перинатальной смертности и заболеваемости во всем мире (ВОЗ, 2011) [1]. В настоящее время для снижения распространенности преэклампсии и последующих осложнений в группе высокого риска проводится фармакологическая профилактика [1–3]. Эффективный результат может быть получен только при своевременном начале приема препарата (ацетилсалициловой кислоты) – с первого триместра беременности (до 16 недель), чтобы повлиять на вторую волну инвазии трофобласта в спиральные артерии матки. Это вынуждает вести поиск предсказательных маркеров с целью раннего выявления (уже в первом триместре) женщин с высокой вероятностью развития данного состояния.
Цель исследования: оценить возможность использования анамнестических данных, биофизических показателей и биохимических маркеров комбинированного пренатального скрининга для прогнозирования преэклампсии в первом триместре беременности.
Материал и методы исследования
Группу исследования составили 511 женщин, которые имели одноплодную беременность, наступившую спонтанно и завершившуюся фенотипически нормальным живорожденным или мертворожденным в 22 или более недель гестации с массой новорожденного 500 г и более. Данные о течении и исходах беременности были получены из материалов первичной медицинской документации акушерских стационаров г. Минска. В группу исследования не включались случаи врожденных пороков развития (ВПР) плода, выявленные в перинатальном периоде, прерывания беременности по медико-генетическим показаниям, случаи самопроизвольного аборта и внутриутробной смерти плода (неразвивающаяся беременность) до 22 недель беременности при условии, что масса абортуса не превышала 500 г.
Все пациенты прошли комбинированный пренатальный скрининг для диагностики ВПР и хромосомных болезней плода в РНПЦ «Мать и дитя» в сроке гестации 10 недель 5 дней – 13 недель 2 дня. Скрининг включал: сбор анамнеза, объективное исследование, ультразвуковое исследование (УЗИ) плода, биохимическое исследование крови с оценкой концентрации трофобластических белков: α-фетопротеина (AFP), свободной β-субъединицы хорионического гонадотропина человека (free β-hCG), ассоциированного с беременностью плазменного белка А (PAPP-A). С целью прогнозирования развития преэклампсии комбинированный пренатальный скрининг был расширен дополнительными исследованиями: допплерометрией (ДПМ) маточных артерий для оценки величины периферического сопротивления, измерением артериального давления, оценкой концентрации сывороточного белка – плацентарного фактора роста (PLGF), который является маркером плацентарной недостаточности. Все исследования были выполнены при однократном обращении пациента.
УЗИ плода выполнено на аппарате Medison Acсuvix V10 с использованием трансабдоминального и трансвагинального конвексных датчиков (4,0–7,0 МГц) согласно «Инструкции о пренатальной диагностике врожденной патологии плода», утвержденной приказом Министерства здравоохранения Республики Беларусь от 23.12.2004 № 288, и приказом Министерства здравоохранения Республики Беларусь № 83 от 30.01.2012 «О совершенствовании организации проведения пренатальных ультразвуковых исследований по выявлению пороков развития и хромосомной патологии у плода в Республике Беларусь». ДПМ маточных артерий в первом триместре беременности с оценкой пульсационного индекса (ПИ) проведена согласно протоколу, рекомендованному The Fetal Medicine Foundation [4].
Измерение артериального давления выполнено после проведения УЗИ плода согласно «Руководству по диагностике и лечению артериальной гипертензии у взрослых» [5] осциллометрическим методом при помощи электронных откалиброванных автоматических тонометров (Omron M2 Basic – Omron Healthcare, Япония). Выполнен расчет среднего артериального давления (САД) согласно проколу, предложенному The Fetal Medicine Foundation [6].
Исследование концентрации трофобластических белков в первом триместре беременности проведено при значении копчико-теменного размера (КТР) плода 38,0–70,4 мм (по таблицам Hadlock) на аппарате Victor D3 (Perkin Elmer, Финляндия) иммунофлуоресцентным методом в течение 24 часов после забора периферической венозной крови. Расчет концентрации AFP, free β-hCG, PAPP-A и PLGF в образцах осуществлен с помощью программного обеспечения MultiCalc.
Полученные значения САД, ПИ в маточных артериях, концентрации сывороточных белков с учетом КТР плода и массы тела беременной конвертированы в МоМ.
Обработка полученных данных выполнена с использованием статистических пакетов Excel, Statistica 10.0 (BXXR207F383502FA-D).
Гипотезу о нормальности распределения признаков, характеризующихся количественными значениями, считали подтвержденной, если в интервал M±2σ попадало не менее 95% всех значений признаков [7].
При нормальном распределении признака использовали методы параметрической статистики. Оценку достоверности разности сравниваемых величин проводили на основании величины критерия Стъюдента (t). Для чего рассчитывали частоту встречаемости признака, средние значения, ошибки репрезентативности. Если при оценке количественных данных гипотезу о нормальности распределения признака в совокупности отвергали, для обработки использовали методы непараметрической статистики – критерий Манна–Уитни (U). Достоверность различия данных, характеризующих качественные признаки в исследуемых группах, определяли на основании величины критерия соответствия (χ2) или Фишера (F). Величину коэффициентов оценивали по таблице.
Результаты исследования считали достоверными, различия между показателями значимыми при вероятности безошибочного прогноза не менее 95,5% (p<0,05).
Большой объем выборки (n=511) позволил рассчитать пределы колебания нормальных значений САД (в МоМ) и ПИ (в МоМ) по формуле M±1σ и представить в виде диапазона значений.
Вероятность (шанс) наличия анализируемых факторов у пациентов с преэклампсией оценена с помощью статистических показателей: отношение шансов (ОШ) и его 95% доверительный интервал (95% ДИ). Показатель ОШ рассматривали как ОШ наступления события в группе исследования к шансу наступления события в группе сравнения.
Для определения точек диагностического разделения (cut-off point), чувствительности, специфичности анализируемых факторов использован метод ROC-анализа.
В модели прогнозирования преэклампсии для определения диагностической информативности анализируемых факторов и их диапазонов использованы метод А. Вальда, А. Генкина и формула С. Кульбака с применением статистического пакета Excel. Эффективность метода прогнозирования преэклампсии оценена путем расчета площади под ROC-кривой (AUC) и отношения правдоподобия положительного (LR+) и отрицательного (LR-) результата теста.
Результаты исследования и обсуждение
В группе исследования из 511 случаев одноплодной беременности 5,3% (n=27) осложнились развитием преэклампсии (О11, О14.0, О14.1, О14.9 согласно МКБ-10), что согласуется с данными ВОЗ [1]
и популяционными данными по Республике Беларусь [8]. Срок родоразрешения составил 36 (35–36) недель со средним значением массы тела новорожденного 2950 (2650–3270) г. Группу без преэклампсии составили 94,7% случаев (n=484), которые завершились срочными родами в 40 (39–40) недель со средним значением массы тела новорожденного 3440 (3130–3730) г. Выявлены статистически значимые различия по сроку родоразрешения (U=1965,5, p=0,001) и массе новорожденного (U=2375,5, p=0,019) между группами сравнения.
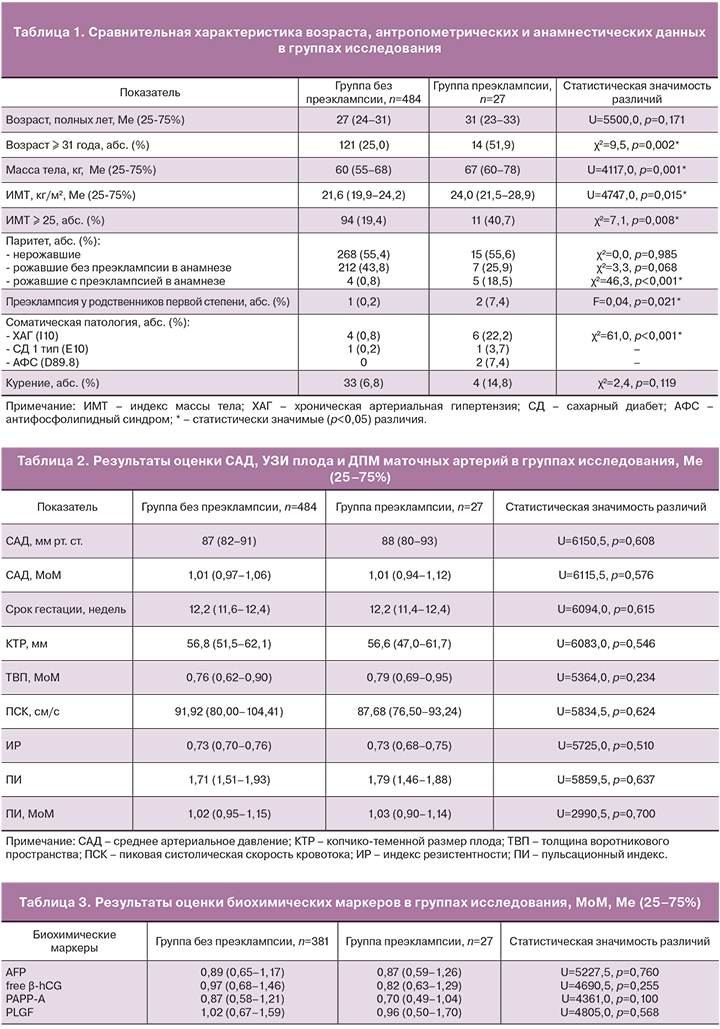
Сравнительная характеристика возраста, антропометрических и анамнестических данных в группах исследования представлена в табл. 1.
Пациенты групп сравнения были сопоставимы по возрасту. Однако в группе преэклампсии статистически значимо преобладали женщины в возрасте 31 года и старше.
Медиана индекса массы тела (ИМТ) в группе преэклампсии составила 24,0 (21,5–28,9), в группе без преэклампсии – 21,6 (19,9–24,2). ИМТ был статистически значимо выше у пациентов с развившейся преэклампсией, однако он не превышал нормальных значений. В то же время среди беременных группы преэклампсии статистически значимо чаще встречались пациенты с избыточной массой тела и ожирением различной степени выраженности (ИМТ>25 кг/м2).
В обеих группах нерожавшие женщины составили чуть более 50%. У пациентов с развившейся преэклампсией значительно чаще встречалась преэклампсия в предыдущей беременности, а также преэклампсия у родственников первой степени: матери или родной сестры (табл. 1).
Среди пациентов группы преэклампсии статистически значимо преобладали женщины с хронической артериальной гипертензией (ХАГ).
По результатам измерения артериального давления определена медиана САД в группе без преэклампсии (n=484), которая составила 87 (82–91) мм рт. ст. или 1,01 (0,97–1,06) МоМ (табл. 2). Рассчитан диапазон нормальных значений САД в МоМ в первом триместре беременности, который составил от 0,94 МоМ до 1,10 МоМ. Полученная величина САД согласуется с данными литературы [9]. Значение САД в группе преэклампсии статистически не отличалось от группы сравнения (p<0,05).
Результаты УЗИ плода и ДПМ маточных артерий представлены в табл. 2. Группы сравнения сопоставимы по сроку гестации, КТР плода, толщине воротникового пространства (ТВП).
Оценка кривых скоростей кровотока в маточных артериях выполнена при пиковой систолической скорости кровотока (ПСК) более 60,0 см/с, что соответствует методике проведения ДПМ в первом триместре беременности. Нулевые и отрицательные значения кровотока зарегистрированы не были.

В группе без преэклампсии определено среднее значение основного уголнезависимого ультразвукового маркера – ПИ, которое составило 1,71 (1,51–1,93) или 1,02 (0,95–1,15) МоМ. Рассчитан диапазон нормальных значений ПИ в МоМ в первом триместре беременности, который составил от 0,87 МоМ до 1,27 МоМ. Полученная величина ПИ согласуется с данными литературы [9]. Значение ПИ в группе преэклампсии статистически не отличалось от группы сравнения (p<0,05).
В рамках комбинированного пренатального скрининга первого триместра беременности оценивают три биохимических маркера (AFP, free β-hCG, PAPP-A), значения медиан которых в исследуемых группах представлены в табл. 3. Статистически значимых различий между группами сравнения не установлено (p>0,05).
Для прогнозирования преэклампсии была введена оценка нового трофобластического белка PLGF – маркера плацентарной недостаточности, который участвует в преобразовании стволовых клеток цитотрофобласта в эндотелиальные и тем самым обеспечивает рост новых сосудов в уже существующей сосудистой системе. Снижение уровня PLGF в кровотоке свидетельствует о недостаточности его функции ангиогенеза и нарушении процесса образования эмбриональной сосудистой системы [10]. Важно отметить, что изменение его концентрации в сыворотке крови наблюдается задолго до появления клинических симптомов преэклампсии [10, 11].
В группе без преэклампсии рассчитана медиана PLGF. Для устранения влияния нижеперечисленных факторов на величину данного показателя из группы исключены 103 случая. Критерии исключения: наличие объемных образований органов малого таза; соматические болезни; прием некоторых препаратов (дексаметазон, низкомолекулярные гепарины, противоэпилептические препараты); развившиеся акушерские осложнения (преждевременные роды, синдром задержки развития плода, хроническая фетоплацентарная недостаточность). Медиана PLGF при физиологически протекающей беременности составила 1,02 (0,67–1,59) МоМ, что согласуется с данными литературы [9], и статистически не отличалась от медианы в группе преэклампсии (табл. 3).
Для прогнозирования вероятности развития преэклампсии был установлен диагностический порог (cut-off point), а также оценены чувствительность и специфичность анамнестических, биофизических и биохимических факторов, отражающих ключевые звенья патогенеза указанного состояния (табл. 4).
Отмечена достаточно низкая чувствительность показателей САД, ПИ и PLGF (37,0, 27,3 и 39,1% соответственно) для прогнозирования преэклампсии в первом триместре беременности. В то же время специфичность составила 81,6, 85,0 и 85,1% соответственно, что позволяет с большой вероятностью прогнозировать течение беременности без преэклампсии в случае нормальных значений указанных показателей в первом триместре беременности.
Установив диагностический порог анализируемых факторов, с помощью ОШ и его 95% ДИ оценили вероятность (шанс) наличия каждого из них у пациентов с преэклампсией (табл. 5).
У женщин с развившейся преэклампсией вероятность наличия всех факторов была значимо выше (p<0,05), чем в группе без преэклампсии, за исключением биохимического маркера free β-hCG≤1,58 МоМ (p>0,05). Поэтому указанный фактор не может применяться для прогнозирования преэклампсии и в дальнейшем исследовании не использовался.
Так как анализируемые факторы неоднородны и степень влияния каждого из них на этапы развития преэклампсии различна, проведен многофакторный (мультифакторный) анализ. Последний позволяет оценить сочетанное влияние и вклад каждого из анамнестических данных, биофизических показателей и биохимических маркеров на вероятность возникновения преэклампсии. С учетом величины диагностического порога (cut-off point) значения всех факторов были разбиты на диапазоны, для каждого из которых рассчитан диагностический коэффициент (величина в баллах). Диагностические коэффициенты диапазонов округлены до единицы и выражены в целых числах со знаком (+) или (-). По значению каждого диапазона составлена таблица прогнозирования преэклампсии (табл. 6).
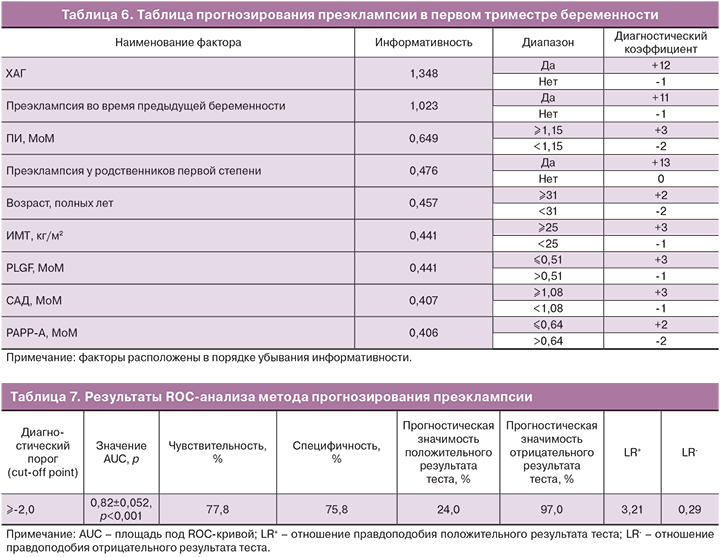
При оценке анализируемых факторов установлено, что наибольшей информативностью и диагностическим коэффициентом обладают анамнестические данные, что является известным фактом. Информативность же остальных факторов примерно одинаковая, поэтому данный метод позволяет выявить женщин группы высокого риска развития преэклампсии среди условно здоровых, то есть без ХАГ, преэклампсии в анамнезе женщины и родственников первой степени.
Для прогнозирования преэклампсии с применением разработанной таблицы необходимо оценить значения всех 9 факторов у беременной женщины и суммировать соответствующие им диагностические коэффициенты (баллы).
Рассчитан диагностический порог (cut-off point) метода прогнозирования преэклампсии – значение суммы диагностических коэффициентов равное (-2) балла (табл. 7). Следовательно, пациентов с суммой баллов (-2) и более следует относить к группе высокого риска развития преэклампсии.
Оценить клиническую значимость и эффективность метода прогнозирования преэклампсии можно с помощью значения AUC (площади под ROC-кривой), прогностической значимости и отношения правдоподобия.
Согласно системе академических баллов [12] тесты со значением AUC 0,80 и более являются полезными. Поскольку значение AUC для метода прогнозирования преэклампсии в первом триместре беременности составило 0,82±0,052 и было статистически значимым, клиническая значимость разработанного метода является полезной.
Прогностическая значимость – это вероятность заболевания при условии известного результата теста, которая зависит от пораженности популяции данным видом патологии. Прогностическая значимость положительного результата – вероятность наличия заболевания при положительном результате теста, составила 24,0%. Поскольку популяционная частота преэклампсии в Республике Беларусь составляет 4,8% [8], прогностическая значимость положительного результата теста в этой популяции будет низкой, даже при условии высокой чувствительности и специфичности теста. Прогностическая значимость отрицательного результата – вероятность отсутствия заболевания при отрицательном результате теста, составила 97,0%. Чем чувствительнее тест, тем выше прогностическая значимость его отрицательного результата и выше вероятность того, что отрицательные результаты отвергают наличие заболевания [13].
Отношение правдоподобия позволяет определить реальную ценность метода прогнозирования преэклампсии, потому что обобщает ту же информацию, что и показатели чувствительности, специфичности и прогностической значимости, но не зависит от распространенности болезни. Отношение правдоподобия демонстрирует, насколько результаты теста изменяют вероятность наличия болезни у пациента [13].
Отношение правдоподобия положительного результата теста (LR+) показывает, во сколько раз выше риск развития заболевания при положительном результате теста. Поскольку в нашем исследовании LR+=3,21, следовательно, вероятность развития преэклампсии у женщин с суммой баллов (-2) и более выше в 3,21 раза. Отношение правдоподобия отрицательного результата теста (LR-) показывает, во сколько раз выше вероятность отсутствия заболевания при отрицательном результате теста. В нашем исследовании LR-=0,29, следовательно, вероятность отсутствия преэклампсии у женщин с суммой баллов менее (-2) выше в 0,29 раза.
Согласно данным литературы, клиническая значимость теста является наиболее полезной при LR+>5 и LR-<0,2, полезной при 2<LR+≤5 и 0,2<LR-≤0,5, польза отсутствует при LR+≤2 и LR->0,5 [7]. Клиническая значимость разработанного метода (LR+=3,21 и LR-=0,29) является полезной.
Заключение
Проведенное исследование позволило оценить возможность использования анамнестических данных, биофизических факторов (САД, ПИ в маточных артериях) и биохимических маркеров (PAPP-A, PLGF) расширенного комбинированного пренатального скрининга первого триместра беременности для прогнозирования преэклампсии.
Рассчитан диапазон нормальных значений САД (0,94−1,10 МоМ) и ПИ (0,87−1,27 МоМ) в первом триместре беременности, а также медиана PLGF в группе без преэклампсии, которая составила 1,02 (0,67–1,59) МоМ.
Статистически значимых различий по значению САД, ПИ и PLGF между группами преэклампсии и без преэклампсии не выявлено (p>0,05). Однако установлена высокая специфичность указанных показателей (81,6, 85,0 и 85,1% соответственно), что позволяет с большой вероятностью прогнозировать течение беременности без преэклампсии в случае их нормальных значений в первом триместре беременности.
Установлено, что у женщин с преэклампсией вероятность наличия следующих факторов риска значимо выше (p<0,05), чем в группе без преэклампсии: возраст ≥31 год – в 3,2 раза; ИМТ ≥25,0 – в 3,7 раза; преэклампсия во время предыдущей беременности – в 27,3 раза; преэклампсия у родственников первой степени – в 38,7 раза; наличие ХАГ – в 34,3 раза; САД ≥1,08 МоМ – в 2,3 раза; ПИ ≥1,15 МоМ – в 6,2 раза; PAPP-A ≤0,64 МоМ – в 2,7 раза, PLGF ≤0,51 МоМ – в 2,5 раза.
Рассчитаны диагностические коэффициенты (величина в баллах) для анализируемых факторов и составлена бальная таблица прогнозирования преэклампсии в первом триместре беременности. Диагностическим порогом (cut-off point) разработанного метода является значение суммы диагностических коэффициентов равное (-2) балла. Пациентов с суммой баллов (-2) и более следует относить к группе высокого риска развития преэклампсии.
Разработанный метод прогнозирования преэклампсии имеет оценку «полезный» (AUC = 0,82±0,052, LR+–3,21 и LR-‒0,29) и может применяться в клинической практике.
Таким образом, расширенный комбинированный пренатальный скрининг, позволяющий оценить формирование трофобласта путем измерения периферического сопротивления кровотока в маточных артериях и концентрации трофобластических белков в сыворотке крови беременной женщины, в совокупности с анамнестическими данными может быть использован для прогнозирования преэклампсии уже в первом триместре беременности.



