Анемия — патологическое состояние системной гипоксии, связанное с дефицитом кислородоносителя в организме. Более 1,6 млрд человек, или ¼ населения мира, страдают анемией. Наибольшая частота анемии приходится на развивающиеся страны [1, 2]. Всемирной организацией здравоохранения (ВОЗ) принято условно разделять страны по частоте встречаемости анемии среди населения на 4 группы. Относительно благоприятными странами (1–2-я группы) считаются страны Северной Америки и Западной Европы, где частота анемии среди населения значимо меньше 20%. Наоборот, страны Центральной Африки и Юго-Восточной Азии являются наиболее подверженными распространению анемии (более 40% – 4-я группа). Для стран, превышающих пороговое значение в 20% (3–4-я группы) по частоте анемии, ВОЗ разработаны рекомендации по государственной профилактике анемии среди населения [2, 3].
В рейтинге ВОЗ среди стран по распространенности анемии Российская Федерация (РФ) отнесена к странам, где имеются значительные проблемы общественного здравоохранения (20–39,9% анемии среди населения). По официальным данным, в РФ заболеваемость наиболее уязвимых слоев населения выглядит следующим образом: 26,5% – среди детей дошкольного возраста, 20,8% – беременных женщин и 19,8% – женщин детородного возраста, что ставит нашу страну в рамки обязательного выполнения рекомендаций ВОЗ с целью снижения глобальных рисков заболеваемости и смертности [4–6].
Анемия является результатом широкого спектра причин, наиболее значимым фактором является дефицит железа (ДЖ). Среди других причин выделяют инфекции, рак, туберкулез и ВИЧ. Важными факторами в развитии анемий ВОЗ признает недостаточность витаминов А, В12, фолиевой кислоты, рибофлавина и меди. Для некоторых популяций также значимыми считаются врожденные гемоглобинопатии [6].
ДЖ обусловливает более половины всех случаев анемии. Такие анемии получили название железодефицитных анемий (ЖДА). Даже в США, где частота диагностированной анемии является минимальной в мире, получены данные, что в течение всего репродуктивного возраста у женщин стойко выявляется ДЖ [7]. Считается, что ДЖ выявляется у половины жителей Земли, а общая заболеваемость составляет 3,5 млрд человек [1, 3].
ВОЗ установлено, что при частоте анемии в популяции более 40% в 100% случаев имеется ДЖ [2, 8].
Основными факторами риска для ЖДА ВОЗ определяет [2]: низкое поступление, плохое всасывание железа, повышенное потребление (быстрый рост и беременность), хроническая кровопотеря в результате менструации у женщин репродуктивного возраста, паразитарные инфекции.
У женщин репродуктивного возраста потребность в экзогенном железе в 2,5 раза больше, чем у мужчин, что делает эту группу населения наиболее подверженной ДЖ и крайней его степени – ЖДА [9–11]. Именно воздействие нескольких причин одновременно приводит к высокой частоте анемии, связанной с ДЖ, в репродуктивном возрасте даже у относительно здоровых женщин [2, 5].
Клиническая картина и значение анемии для женщин репродуктивного возраста
Клинически выраженные стадии ДЖ – это латентный дефицит железа (ЛДЖ) и непосредственно ЖДА, когда концентрация гемоглобина (Hb) снижается менее 120 г/л. На этих стадиях выявляются изменения в анализах крови и появляются сидеропенические (при ЛДЖ и ЖДА) и анемические симптомы (при ЖДА) [12–14].
Если оценивать глобальное влияние анемии на здоровье нации, то анемия является показателем как плохого питания, так и плохого здоровья [6].
ВОЗ специально определяет наиболее серьезные медицинские и социальные последствия анемии, имеющие государственное и мировое значение: повышенный риск материнской и детской смертности, когнитивные и физические нарушения развития детей [2, 6]. Кроме анемии, ДЖ неблагоприятно влияет на утилизацию источников энергии мышечной тканью и, таким образом, на физическую работоспособность и производительность труда, а также на состояние иммунной системы и заболеваемость инфекционными болезнями [2, 15, 16]. Дефицит фолиевой кислоты (витамина B9), помимо анемии, связан с развитием дефектов нервной трубки плода, оказывает влияние на риски развития других пороков развития (скелета, мягких тканей лица, сердечно-сосудистой системы) [15, 16].
Дифференциальная диагностика анемий, связанных с дефицитом железа
ВОЗ рассматривает Hb и ферритин сыворотки крови (ФС) как наиболее эффективные показатели для определения анемии, связанной с ДЖ [8, 13]. Порог для диагностики ДЖ у взрослых ВОЗ определяет как показатель ФС <15–20 мкг/л без воспаления и ФС <30–50 мкг/л с воспалением [2, 17].
Основными лабораторными критериями ЖДА, помимо низкого ФС, являются характеристики эритроцитов (гипохромия и микроцитоз), низкое сывороточное железо, снижение насыщения трансферрина железом менее 16–20%, высокие показатели трансферрина [2, 8, 14, 15].
Все анемии с указанными характеристиками, вне зависимости от значений ФС, определяются как железодефицитные синдромы (ЖДС). Анемия хронической болезни (АХБ), развивающаяся в связи с перераспределением (депонированием) железа при воспалительных процессах (системных воспалительных заболеваниях, злокачественных новообразованиях, хронических инфекциях), характеризуется ФС >100 мкг/л и повышенными маркерами воспаления (С-реактивный белок (СРБ) и др.). Наличие хронического воспалительного процесса, пролиферативного (не обязательно злокачественного) заболевания, хронической инфекции нарушает всасывание железа в кишечнике и снижает выработку эритроцитов в костном мозге. Эти механизмы реализуются через гепцидиновый механизм, с одной стороны, и через неадекватную продукцию эндогенного эритропоэтина (ЭПО) – с другой. Выраженность того или иного процесса и приводит к развитию анемии по типу АХБ [14, 18, 19].
Чаще в практике гинеколога встречается сочетание ЖДА и АХБ – анемия, которая развивается на фоне абсолютного ДЖ и воспаления (ЖДА+АХБ).
Указанная дифференциация ЖДС требуется для принятия решения о тактике лечения. Для лечения ЖДА используются препараты железа, для ЖДА+АХБ – препараты железа и противовоспалительная терапия, для АХБ – патогенетическая коррекция причины развития анемии, при отсутствии подъема Hb – в сочетании со стимуляторами эритропоэза (рекомбинантный человеческий эритропоэтин – рч-ЭПО) [14, 20].
Частота, характеристика и патогенез анемии при гинекологических заболеваниях
Гинекологические заболевания, естественно, увеличивают частоту анемии, так как, с одной стороны, провоцируют развитие патологической кровопотери, с другой – нарушают метаболизм железа и кроветворения по механизму АХБ. Важнейшей причиной развития анемии у данного контингента до настоящего времени считали кровотечения из половых путей – более продолжительные и обильные в отличие от нормальной менструации, и ациклические кровотечения (дисменорея). Другие механизмы развития анемии описаны профессором В.А. Бурлевым в 2004 г., когда была выявлена неадекватная продукция ЭПО при миоме матки [21].
По нашим данным, полученным при обследовании 132 больных с доброкачественными заболеваниями женской репродуктивной системы, госпитализированных в гинекологический стационар, анемия выявлена у 50 (38%) пациенток. Данный показатель значительно превышает статистические показатели здорового женского населения, которые, как упоминалось ранее, составляют порядка 20%.
При изучении причин снижения Hb в этой группе отмечено отсутствие прямой связи между дисменореей и вероятностью развития анемии. Причем, при наличии миомы матки число пациенток с дисменореей было меньше, чем в других группах, и составило только 17,5%, а частота анемии была максимальной и составила 65%, что статистически выше, чем в общей группе (р<0,001). Данные указаны в табл. 1.
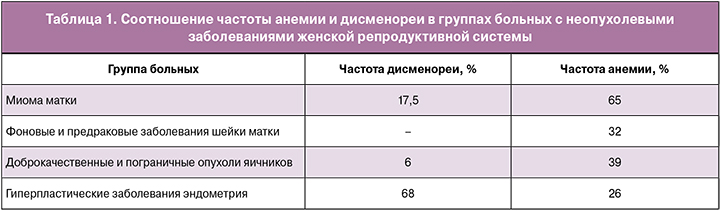
Таким образом, при доброкачественных заболеваниях женской репродуктивной системы анемия развивается как при хронической кровопотере, так и у больных с миомой матки, заболеваниями шейки матки и яичников без выраженной патологической кровопотери. Из полученных данных следует, что механизм развития анемии у данной категории больных связан как с ДЖ, так и с воздействием другой причины, для выяснения которой далее были изучены характеристики анемии и механизмы ее развития у представленных гинекологических больных.
Указанные 50 больных с анемией были обследованы по рутинным параметрам анемии, данные представлены в табл. 2.
Полученные данные свидетельствуют, что анемии при гинекологических заболеваниях по показателям эритроцитов являются гипохромными микроцитарными, по ФС характеризуются абсолютным ДЖ.
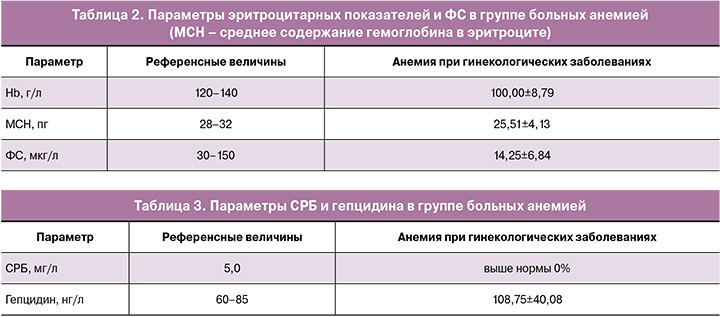
В связи с неясной причиной развития анемии (не у всех выявлена дисменорея) нами исследованы показатели СРБ и гепцидина. Данные приведены в табл. 3. Повышенные показатели последнего доказывают значимую роль воспаления в патогенезе анемий при гинекологических заболеваниях.
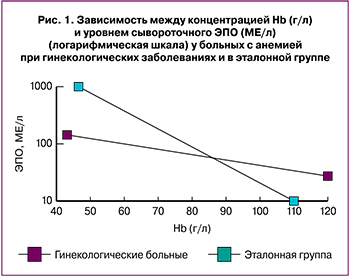 Другим доказательством того, что данные анемии являются не истинными ЖДА, послужило исследование ЭПО. Получено статистически значимое сниженное содержание ЭПО (р<0,05), снижение log (ЭПО) (р<0,01) у гинекологических больных анемией по сравнению с эталонной группой (классическая ЖДА, связанная с кровопотерей из органов желудочно-кишечного тракта (ЖКТ), 15 пациентов). Показатель О/П (отношение определяемого уровня к предполагаемому) log (ЭПО) в исследуемой группе составил 0,89±0,1 (р<0,05). Относительно низкий коэффициент обратной корреляции по уравнению линейной регрессии, О/П log (ЭПО) <0,9 свидетельствует о том, что у части больных имеет место некоторое угнетение продукции ЭПО. Неадекватно низкое содержание ЭПО степени тяжести анемии (О/П log (ЭПО) <0,9) выявлено у 67% больных при заболеваниях женской репродуктивной системы и только у 17% в эталонной группе (р<0,05). Данные показаны на рис. 1.
Другим доказательством того, что данные анемии являются не истинными ЖДА, послужило исследование ЭПО. Получено статистически значимое сниженное содержание ЭПО (р<0,05), снижение log (ЭПО) (р<0,01) у гинекологических больных анемией по сравнению с эталонной группой (классическая ЖДА, связанная с кровопотерей из органов желудочно-кишечного тракта (ЖКТ), 15 пациентов). Показатель О/П (отношение определяемого уровня к предполагаемому) log (ЭПО) в исследуемой группе составил 0,89±0,1 (р<0,05). Относительно низкий коэффициент обратной корреляции по уравнению линейной регрессии, О/П log (ЭПО) <0,9 свидетельствует о том, что у части больных имеет место некоторое угнетение продукции ЭПО. Неадекватно низкое содержание ЭПО степени тяжести анемии (О/П log (ЭПО) <0,9) выявлено у 67% больных при заболеваниях женской репродуктивной системы и только у 17% в эталонной группе (р<0,05). Данные показаны на рис. 1.
Таким образом, полученные данные позволяют утверждать, что анемия при доброкачественных заболеваниях женской репродуктивной системы:
- встречается чаще, чем в женской популяции репродуктивного возраста;
- наиболее характерна для миомы матки;
- по рутинным лабораторным показателям полностью соответствуют критериям ЖДА;
- имеет несколько основных причин развития: хроническая кровопотеря (дисменорея), высокий уровень гепцидина и неадекватная продукция ЭПО, то есть является по сути ЖДА+АХБ;
- в профилактике и лечении требует обязательного использования препаратов, содержащих железо, однако эффективность их использования, вероятно, будет ниже, чем при классической ЖДА.
Профилактика и лечение анемии и дефицита железа
Профилактические мероприятия по развитию анемии должны быть в первую очередь направлены на сохранение баланса между поступлением и потерей железа как основного механизма развития анемии у женщин детородного возраста [2]. Основные подходы к сохранению и пополнению железа в организме, по данным ВОЗ, включают [2]: диету (употребление продуктов, содержащих биодоступное железо), искусственное обогащение продуктов питания железом и фолиевой кислотой (фортификация), прием пищевых добавок, содержащих необходимые микроэлементы, насыщающая лекарственная терапия (саплементация).
Диета должна включать в себя значительное количество мяса, большое количество морепродуктов и витамина С (аскорбиновая кислота повышает биодоступность негемового железа) [22, 23]. Фортификация является эффективным долгосрочным подходом к улучшению статуса железа у населения в развивающихся странах; наоборот, часто вместо фортификации продуктов питания, особенно в западных странах, используют пищевые добавки. Так, примерно 14–18% американцев используют добавки, содержащие железо, причем женщины, которые кормят грудью, – около 60%, беременные – до 72% [24, 25].
В регионах, где частота анемии в популяции является высокой (более 20%), а среди женского населения составляет 40% и более, разработаны рекомендации ВОЗ, согласно которым всем менструирующим женщинам и девочкам-подросткам рекомендуется ежедневный прием препаратов железа и фолиевой кислоты в дозе элементарного железа 30–60 мг, фолиевой кислоты – 400 мкг [26–28]. Такую профилактическую саплементацию необходимо проводить в течение 3 месяцев подряд раз в году до наступления менопаузы. При плохой переносимости ежедневного приема железа возможно использование еженедельного приема в дозе не менее 60 мг элементарного железа и 2,8 мг фолиевой кислоты. Режим усиленной саплементации должен продолжаться непрерывно в течение 3 месяцев с последующим 3-месячным перерывом. Такие режимы приема позволяют достоверно снижать частоту анемии и ДЖ [29, 30]. Такие рекомендации полностью применимы и в нашей стране.
Согласно Российским клиническим рекомендациям по профилактике и лечению ЖДА, прием препаратов железа с профилактической целью предназначен для лиц из групп риска (обильная кровопотеря при менструации или иной природы, недостаточное потребление железа и предшествующий диагноз ЖДА). При этом скрининг для выявления анемии показан всем небеременным женщинам каждые 5–10 лет в течение всего детородного возраста. Ежегодному скринингу подлежат женщины с факторами риска развития ЖДА.
Лечение анемии должно начинаться с правильной ее диагностики. При обследовании на предмет анемии в обязательном порядке необходимо установить характер и причину анемии. При обнаружении анемии у женщины рекомендовано начинать ежедневный прием железа в дозе не менее 120 мг и обследование для выявления причины анемии. Лечение продолжают до полной нормализации гемоглобина и в дальнейшем переводят на профилактический прием препаратов железа [27, 28].
Важнейшим критерием эффективности лечения ЖДА является прирост концентрации гемоглобина более 10–20 г/л в первый месяц приема препаратов железа [11]. Многие рекомендации определяют этот период как знаковый, позволяющий планировать дальнейшее лечение и обследование пациенток.
По опубликованным данным, показана наибольшая эффективность двухвалентных препаратов железа (сульфат, фумарат, глюконат железа), которые и являются препаратами выбора при решении вопроса о проведении пероральной терапии (рекомендации ВОЗ) [12, 26, 29]. Доказана необходимость включения в состав препаратов железа аскорбиновой кислоты, которая увеличивает абсорбцию железа на 30% [12]. В этих же рекомендациях обсуждаются так называемые формы железа с замедленным высвобождением, позволяющие получить максимальный эффект с использованием меньших доз железа и при этом минимизировать побочные эффекты. При этом максимальная эффективная и безопасная разовая доза составляет 100 мг, а суточная не должна превышать 300 мг [12, 14].
Длительность пероральной терапии должна составлять не менее 3–4 месяцев, первые два из которых требуются на полное восстановление концентрации гемоглобина, последующие – на создание депо железа в организме [12, 14].
Учитывая высокую степень безопасности пероральных препаратов железа с доказанной эффективностью в районах, эндемичных по дефициту железа, они должны быть препаратами выбора при стартовой терапии ЖДА. Однако стоит помнить, что такие лекарственные формы нельзя назначать пациентам с острой патологией верхних отделов ЖКТ, не стоит рассчитывать на хороший эффект при использовании у пациенток с сопутствующими воспалительными заболеваниями [14, 18].
Альтернативной тактикой лечения ЖДА может быть использование парентеральных препаратов железа, однако они обычно рекомендуются при низкой эффективности и непереносимости (или невозможности назначения) пероральных лекарственных форм [14, 31].
По данным документа «Кровесберегающие технологии у гинекологических больных. Клинические рекомендации (протокол лечения)» рекомендовано использовать следующий алгоритм использования препаратов железа и лечения анемии: при анемии легкой степени показана терапия пероральными препаратами железа, при большей выраженности анемии необходима терапия препаратами железа парентерально, при тяжелой степени анемии (Hb <80 г/л) оправдано введение рекомбинантного ЭПО (рЭПО) в дополнение к парентеральному назначению железа.
В настоящее время из группы парентерального железа рекомендуется использовать только внутривенные лекарственные формы. Они в ряде случаев более эффективны, чем пероральные, но не могут использоваться рутинно, основные требования к их применению [14]: введение в условиях стационара; использование только при доказанном абсолютном дефиците железа, только расчетная доза (по формуле Ганзони).
При тяжелой анемии часто встает вопрос о гемотрансфузии как процедуре, наиболее быстро восстанавливающей показатели красной крови. Учитывая, что ЖДА – это всегда хронический процесс с медленно прогрессирующими клиническими проявлениями, то, как правило, пациенты начинают обследование и лечение еще до наступления тяжелого состояния, требующего интенсивной терапии. Для принятия решения о проведении процедуры переливания эритроцитарной массы необходимо всегда оценивать и сопоставлять как тяжесть анемии по лабораторным показателям, так и тяжесть клинических проявлений анемии и признаков органной недостаточности [14, 32].
В связи с наличием препаратов железа как эффективного патогенетического метода лечения, как правило, у больных ЖДА отмечается быстрый подъем концентрации Hb, быстрое купирование клинических симптомов анемии и сидеропении, что не требует трансфузии эритроцитов даже при тяжелой анемии [12, 14]. Для ЖДА необходимо ориентироваться на предельную концентрацию Hb, ниже которой следует учитывать возможность гемотрансфузий, соответствующую 30–40 г/л [12].
Лечение анемии при гинекологических заболеваниях
Для формирования собственного мнения изучили эффективность лечения ЖДА у указанной группы из 50 гинекологических больных. Терапию препаратами железа проводили с использованием наиболее эффективного на российском рынке препарата железа «Сорбифер Дурулес».
Данный препарат был выбран в связи с наличием у него уникального сочетания следующих характеристик: рекомендованное ВОЗ основное действующее вещество – сульфат двухвалентного железа, максимальная эффективная разовая доза в одной таблетке (100 мг элементарного двухвалентного железа), наличие аскорбиновой кислоты, усиливающей всасывание железа и, наконец, уникальная технология Дурулес, обеспечивающая замедленное высвобождение железа. Максимальная эффективная доза железа в одной таблетке позволяет использовать препарат «Сорбифер Дурулес» всего один раз в сутки при проведении профилактики анемии и лечении ЛДЖ. А двукратный прием, который используют при лечении ЖДА, обеспечивает пациента адекватной суточной дозой железа. Технология Дурулес позволяет отнести данный препарат к препаратам с максимальной степенью безопасности, так как предотвращает контакт атомов металла со слизистой желудка, что значимо снижает побочные эффекты, высвобождая его только при смене кислотности среды в просвете двенадцатиперстной кишки, где осуществляется основной объем абсорбции железа.
Использовали препарат «Сорбифер Дурулес» по 1 таблетке 2 раза в день до нормализации эритроцитарных показателей и стабилизации ФС. Длительность лечения составила от 2 до 6 месяцев, средняя продолжительность – 2,8±1,18 месяца. Данные сроки лечения в среднем являются даже меньшими, чем рекомендует ВОЗ, что подтверждает высокую эффективность данной лекарственной формы.
Из особенностей лечения хочется отметить результаты терапии пациенток с миомой матки (наиболее распространенной причиной развития анемии). В нашей группе пациенток с анемией 26/50 были с диагнозом миомы матки. Ответ на лечение данной группы мы сравнивали с остальными 24/50 пациентками с доброкачественными заболеваниями женской репродуктивной системы (группа контроля). Оценку результатов проводили по показателям Hb и ФС до, через 1 месяц, который является важным этапом принятия решения о дальнейшей тактике лечения (см. выше), и после окончания лечения (около 3 месяцев приема препарата «Сорбифер Дурулес»). При сравнении результатов терапии не получено различий по средним значениям Hb. Однако результаты восстановления средних значений ФС у больных с миомой матки оказались значимо ниже (11,6±2,6 мкг/л, ≈0,05), чем показатели ФС в группе контроля (20,5±4,3), и не достигли нормальных значений (рис. 2). Таким образом, доказано, что наличие пролиферативного, даже незлокачественного заболевания, в данном случае миомы матки, может значимо влиять на результаты лечения препаратами железа, подавляя его всасывание в двенадцатиперстной кишке, чувствительной к высокой концентрации гепцидина. Влияние миомы матки на кроветворение с помощью нарушения продукции ЭПО и высоких показателей гепцидина достоверно сказывается на результатах терапии.
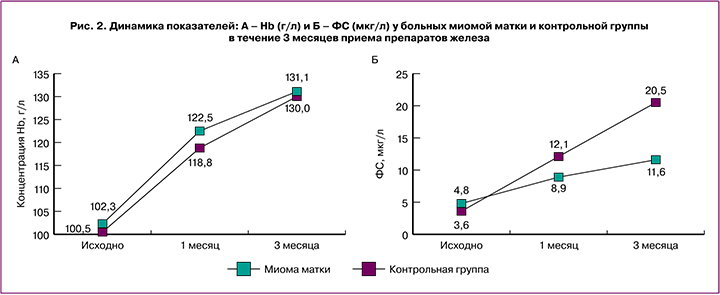
Полученные результаты лечения показывают, что анемии при доброкачественных заболеваниях женской репродуктивной системы, несмотря на свои характеристики, соответствующие ЖДА+АХБ, эффективно лечатся пероральными препаратами железа. Такой ответ позволяет утверждать, что основной патогенетический механизм их развития – это ДЖ, который и должен являться основной мишенью лечения анемии. Однако такую терапию необходимо проводить с учетом причины развития анемии, а при наличии миомы матки она должна проводиться дольше.
Еще один важный аспект использования пероральных препаратов железа – это их переносимость, развитие побочных эффектов, которые связаны с активным поступлением и накоплением железа в клетках кишечника. При использовании двухвалентных препаратов железа проникновение в энтероциты данного металла не ограничивается активностью ферментов мембраны клетки, а происходит по градиенту концентрации. Напротив, выход из кишечника в кровь лимитирован работой ряда транспортных и окислительных ферментов (ферропортин, гефестин, церулоплазмин). Поэтому, когда способность данных белков переносить железо в кровь снижается (воспаление, инфекция, опухоль), а также при отсутствии выраженного ДЖ, при лечении пероральными препаратами железа развивается неадекватно высокая его внутриклеточная концентрация. Это приводит к диспепсическим явлениям: тяжести в животе, тошноте, рвоте, диарее, запорам, развитию острого гастрита и язвы желудка.
В связи с этим даже таблетированные формы железа необходимо использовать только по показаниям, только с целью профилактики и таргетной коррекции ДЖ. По нашим данным, при отсутствии патологии ЖКТ переносимость препарата «Сорбифер Дурулес» у женщин с заболеваниями репродуктивной системы абсолютно удовлетворительная. Количество диспепсических явлений в нашей группе составило всего 3%, они не были серьезными и не потребовали отмены препарата. Однако при наличии сочетанных заболеваний ЖКТ (15 больных, для исследования ЭПО) мы получили до 20% жалоб, что значимо повлияло на качество жизни пациенток.
Заключение
В связи с представленными в работе данными можно сделать заключение, что анемии у женщин репродуктивного возраста встречаются часто и требуют обязательной профилактики, будь то назначение лекарственных препаратов или регулярное обследование. Наличие гинекологических заболеваний резко увеличивает частоту развития анемии, которая в этой группе больных достигает 38%. Данные анемии характеризуются абсолютным ДЖ, связаны как с хронической кровопотерей, так и с другими механизмами нарушения метаболизма железа и кроветворения. Учитывая ведущий патогенетический механизм анемии, эти больные должны получать препараты железа. Варианты использования и дозы препаратов зависят от тяжести и варианта анемии. При выраженной и тяжелой анемии, наличии признаков воспаления необходимо проводить противовоспалительное лечение и с большим предпочтением использовать внутривенные препараты. Однако в связи с доказанной высокой эффективностью и переносимостью пероральных препаратов в этой группе больных они остаются золотым стандартом лечения анемии и тем более – коррекции ДЖ. Использование препарата «Сорбифер Дурулес» доказало свою высокую эффективность и безопасность при лечении пациенток с заболеваниями репродуктивной системы.
Для достижения представленных в статье высоких результатов при использовании пероральных препаратов железа у гинекологических пациенток с анемией, по нашему опыту, требуется выполнение нескольких обязательных условий:
- обязательный выбор контингента (патология ЖКТ, воспаление, злокачественные опухоли, инфекция снижают эффективность и переносимость лечения, требуют специализированного подхода);
- предупреждение пациентов о возможных отрицательных эффектах;
- соблюдение сроков лечения, контроль эффективности;
- использование трапециевидной схемы назначения препарата: вначале назначают 100 мг железа в день в течение 3–5 дней до адаптации организма больного к экзогенному металлу, затем после полной нормализации состояния дозу доводят до лечебной (препарат назначают по 100 мг два раза в день); когда значения Hb приблизятся к нормальным, вновь переходят на поддерживающую дозу, которую надо продолжать не менее 2–3 месяцев или до нормализации ФС.
Надо помнить, что препараты железа необходимо принимать натощак, запивать их большим количеством воды, не употреблять одновременно чай, кофе, молоко.
Таким образом, своевременная профилактика и адекватное лечение анемии у гинекологических больных с использованием международных и российских рекомендаций в будущем позволят улучшить состояние здоровья женского населения и решить проблему анемии.



