В настоящее время актуальным является вопрос разработки более безопасных и приемлемых для пациента протоколов стимуляции яичников, которые позволили бы при минимальном риске терапии увеличить вероятность рождения живого здорового ребенка при одноплодной беременности [20].
Сейчас все большее число исследователей предпочитают модифицированные протоколы стимуляции, в том числе и так называемые «мягкие» протоколы [1, 7–9, 19, 20]. Особое значение выбор оптимального протокола стимуляции суперовуляции и стартовой дозы рекомбинантного ФСГ имеет у пациенток с высоким риском развития синдрома гиперстимуляции яичников (СГЯ) [12, 15, 17]. Учитывая тенденции сегодняшнего дня, заключающиеся в снижении медикаментозной нагрузки и осложнений, возникающих в процессе стимуляции функции яичников, является чрезвычайно важным проведение анализа эффективности и безопасности применения данных протоколов стимуляции [7, 20].
В последние годы интерес исследователей также сконцентрирован на поиске прогностических критериев лечения бесплодия в программах экстракорпорального оплодотворения (ЭКО) путем анализа состава фолликулярной жидкости (ФЖ) каждого из аспирируемых фолликулов и поиске корреляций между концентрацией содержащихся в ней цитокинов, качеством полученных ооцитов, эмбрионов и частотой наступления беременности, а также путем определения молекулярно-биологических маркеров, ассоциированных с исходом программ ЭКО [3]. Оптимизация программы ЭКО и переноса эмбриона (ПЭ) у пациенток с высоким риском развития СГЯ путем использования модифицированного «мягкого» протокола стимуляции суперовуляции является актуальным и перспективным направлением современной репродуктологии, что и явилось целью настоящего исследования.
Материал и методы исследования
Были обследованы 146 супружеских пар репродуктивного возраста, которые нуждались в лечении бесплодия и проведении программы ЭКО. Из них І группу (исследуемую) составили 75 пациенток в
возрасте до 35 лет, которым стимуляция суперовуляции была проведена с использованием «мягкой» схемы с 5-го дня менструального цикла (МЦ). Группа І была поделена на 2 подгруппы: 54 пациентки – с мультифолликулярными яичниками, 21 пациентка – с синдромом поликистозных яичников (СПКЯ). Вторую группу (сравнения) составила 71 пациентка, стимуляция суперовуляции которой была проведена по стандартному протоколу с антагонистами гонадотропин-рилизинг гормона (ГнРГ)
со 2–3-го дня МЦ. Группа IІ поделена на 2 подгруппы: 46 пациенток – с мультифолликулярными
яичниками, 25 пациенток – с СПКЯ. Из группы сравнения 46 пациенткам был произведен ПЭ в цикле стимуляции, у 25 пациенток в связи с высоким риском развития СГЯ произведена криоконсервация эмбрионов и последующий их перенос в следующем МЦ.
Статистический анализ результатов проводили с использованием пакета прикладных программ
Statistica for Windows v. 7.0, StatSoft Inc (США). Статистически значимыми считали отличия при р<0,05 (95% уровень значимости) и при р<0,01 (99% уровень значимости). Связь между изучаемыми показателями оценивали по результатам корреляционного анализа с вычислением коэффициента
корреляции Спирмена (R) и последующим установлением его значимости по критерию t.
В работе были использованы следующие схемы стимуляции суперовуляции:
· стимуляция суперовуляции по стандартному протоколу с антагонистом ГнРГ проводилась со
2–3-го дня МЦ препаратом рекомбинантного фолликулостимулирующего гормона (рФСГ) в стартовой дозе 150 МЕ. Введение антагониста ГнРГ в дозе 0,25 мг осуществляли при достижении максимальным фолликулом диаметра 16 мм по день введения триггера овуляции включительно;
· стимуляция суперовуляции по «мягкому» протоколу начиналась с 5-го дня МЦ препаратом рФСГ в стартовой дозе 75 МЕ с последующим аналогичным введением антагониста ГнРГ.
Критерием назначения триггера овуляции (препарат хорионического гонадотропина –ХГ в дозе
8000–10000 МЕ) в обеих группах считали наличие в яичниках, по крайней мере, трех фолликулов
диаметром более 17 мм. Через 35–36 ч после введения триггера проводили трансвагинальную пункцию яичников с целью аспирации преовуляторных ооцитов.
Процедура ЭКО и ПЭ были аналогичны в обеих группах.
Критериями включения в исследование явились: возраст женщин до 35 лет, высокий овариальный
резерв; мультифолликулярные яичники; отсутствие оперативных вмешательств на яичниках у
пациенток без СПКЯ; патологии эндометрия, по данным ультразвукового исследования; тяжелых
соматических заболеваний, представляющих угрозу течению беременности и родов, субфертильная
сперма супруга.
Применяли стандартные методы лабораторных обследований перед программой ЭКО и ПЭ, а также специальные методы исследования:
1. Определение уровней сосудисто-эндотелиального фактора роста (СЭФР, VEGFA) и его
рецепторов 1 и 2 типов методом иммуноферментного анализа в сыворотке крови в день введения
препарата ХГ и в день ПЭ с целью прогнозирования риска развития СГЯ.
2. Пайпель-биопсия эндометрия была проведена на этапе подготовки к программе ЭКО и ПЭ на
7–8-й день МЦ и в период «имплантационного окна» с оценкой профиля экспрессии мРНК генов
цитокинов методом полимеразной цепной реакции (ПЦР) в 34 образцах эндометрия, биоценоза
влагалища и степени контаминации эндометрия условно-патогенной флорой.
3. Оценка 87 образцов ФЖ, полученных при трансвагинальной пункции яичников по молекулярно-генетическим параметрам, осуществлена с использованием метода ПЦР в режиме реального
времени с определением спектра генов: фактора некрза опухоли α (ФНО-α), интерлейкина-2 (ИЛ-
2), ИЛ-10, ИЛ-6, ИЛ-1β, фактора, ингибирующего лейкемию (LIF) и его рецептора, трансфор-
мирующего фактор роста (TGF-β1), VEGFA121, VEGFA189, VEGFA165, антигенов тканевой совместимости (HLA-G5) и HLA-G1.
Результаты исследования и их обсуждение
Пациентки обеих групп достоверно не различались по возрасту, частоте экстрагенитальной патологии, перенесенных гинекологических операций, невынашиванию беременности. Пациентки с СПКЯ в обеих группах имели бóльшую длительность бесплодия, достоверно бóльший объем яичников, бóльшее число антральных фолликулов; значения лютеинизирующего гормона и антимюллерового гормона (АМГ) практически в 2 раза превышали те же показатели по сравнению с подгруппами пациенток без СПКЯ. Как известно, АМГ является информативным показателем, отражающим овариальный резерв [5, 6, 10, 19].
Далее были проанализированы основные показатели стимуляции суперовуляции при применении «мягкого» и стандартного протоколов c антагонистом ГнРГ (см. таблицу).
Таблица. Основные показатели стимуляции суперовуляции у пациенток исследуемых групп.
Во II группе больных средняя суммарная доза препарата рФСГ достоверно превысила в 1,4 раза
тот же показатель в I группе. В I группе число фолликулов, полученных ооцитов и общее число полученных эмбрионов было достоверно ниже, чем в группе сравнения. Однако доля зрелых ооцитов и число эмбрионов «хорошего» качества в исследуемой группе достоверно превысило те же показатели в группе сравнения и составило: 76,1% и 4,9 против 56,5% и 3,2 соответственно. Полученные данные согласуются с мнением M.F. Verberg [20], что несмотря на небольшое число получаемых ооцитов при
применении «мягкого» протокола стимуляции, они представляют более гомогенную группу
ооцитов хорошего качества, а не патологическое снижение ответа яичников на стимуляцию
[3, 4].
Принимая во внимание существующее представление о том, что этапы созревания яйцеклетки, развития эмбриона и имплантации являются цитокинзависимыми процессами и контролируются иммунной системой, поиск молекулярно-биологических маркеров, ассоциированных с исходом программ ЭКО, в настоящее время представляется актуальной проблемой.
В связи с этим на следующем этапе работы был проведен сравнительный анализ результатов молекулярно-генетического исследования 87 образцов ФЖ, полученных при трансвагинальной пункции яичников, и 34 образцов эндометрия, взятых путем пайпель-биопсии на этапе подготовки к программе ЭКО на 7-й день МЦ и в период «имплантационного окна».
Результаты исследования профиля экспрессии мРНК генов цитокинов в ФЖ у пациенток с высоким риском развития СГЯ показали, что при применении «мягкой» схемы стимуляции, в период «имплантационного окна» достоверно повышается уровень экспрессии мРНК HLA-G1 в 3,4 раза, мРНК
HLA-G5 – в 2,5 раза по сравнению со стандартным протоколом (рис. 1).
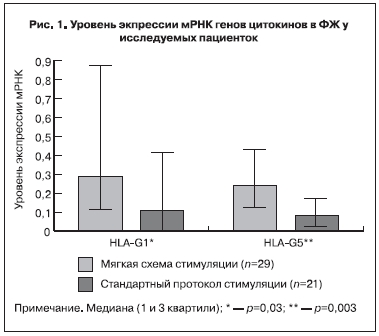
Известно, что повышение уровня экспрессии мРНК HLA-G играет ключевую роль в процессе имплантации, поддерживает локальное иммуносупрессивное состояние и может быть ассоциировано
с благоприятным исходом программы ЭКО и ПЭ [16, 21].
Оценка профиля экспрессии мРНК генов цитокинов в ткани эндометрия показала, что у пациенток
в программе ЭКО и ПЭ при неудачах имплантации в эндометрий в период «имплантационного окна»
имеет место повышение экспрессии мРНК генов провоспалительных цитокинов: ФНО-α – в 5 раз,
ИЛ-18 – в 3,2 раза, ИЛ-1β – в 6,2 раза в цикле, предшествующем стимуляции (рис. 2), что может явиться неблагоприятным прогностическим признаком для наступления беременности.
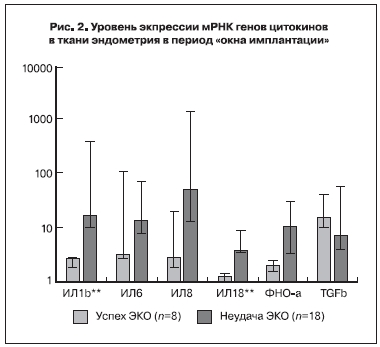
Очевидно, что пациентки с высоким овариальным резервом имеют больше шансов на наступление
беременности, чем пациентки с бедным ответом. С другой стороны, при одновременном росте слишком большого числа фолликулов существенно повышается риск развития СГЯ. Частота развития СГЯ
в исследуемой группе была в 1,8 раз достоверно ниже, чем в группе сравнения и составила 12 и 22%
соответственно.
Рассматривая патогенез СГЯ, многие ученые делают акцент на ключевую роль системы СЭФР в повышении сосудистой проницаемости. В связи с тем что в группах обследованных пациенток в предыдущих циклах стимуляции были случаи развития СГЯ, представляется актуальным изучение возможных предикторов данного осложнения. В настоящем исследовании были определены уровни СЭФР и рецепторов СЭФР 1 и 2 типов в день введения ХГ и в день ПЭ у 83 из 146 пациенток, включенных в исследование.
В день ПЭ уровень СЭФР в группе сравнения в 1,2 раза превысил тот же показатель в исследуемой
группе и составил 431,8±52,4 и 351,6±53,1 пг/мл соответственно. В день введения овуляторной дозы
ХГ уровни рецепторов СЭФР-1 составили 96,8±2,3 и 81,4±2,7, а рецептора СЭФР-2 – 15742,2±482,3 и
13197,9±486,2 пг/мл в группе сравнения и в исследуемой группе соответственно. Установлена умеренная корреляционная связь между рецептором СЭФР 2 типа и развитием СГЯ в группе сравнения (rS=0,4, р=0,04); в исследуемой группе корреляции не выявлено. Так как в группе сравнения частота развития СГЯ была достоверно выше, чем в исследуемой группе, повышение уровней СЭФР и рецепторов СЭФР 1 и 2 типов может подтверждать их прогностическую роль в развитии данного синдрома, что согласуется с данными P. Peitsidis [2, 13].
На следующем этапе исследования была проведена сравнительная оценка эффективности реализации программы ЭКО у обследованных пациенток при применении «мягкого» и стандартного протоколов стимуляции суперовуляции. Частота наступления беременности на ПЭ при применении «мягкой» схемы стимуляции составила 36,5%, в группе с применением стандартного протокола – 32,7%, однако различия были статистически незначимы (p≥0,05). Различия в частоте наступления беременности могут быть обусловлены значительной долей циклов с ПЭ в исследуемой группе в отличие от группы сравнения, где частота отмены переноса в связи с риском развития СГЯ была выше.
В рамках профилактики СГЯ широкое применение получил метод криоконсервации эмбрионов и переноса их в полость матки в следующем МЦ с предварительной гормональной подготовкой эндометрия.
В связи с этим представилось важным провести оценку частоты наступления беременности в расчете
на 1 цикл ПЭ при применении «мягкой» схемы стимуляции и, в качестве альтернативы, при переносе
криоконсервированных эмбрионов у пациенток с высоким риском развития СГЯ. Все криоконсервированные эмбрионы, перенесенные в полость матки, были сходны по всем параметрам, криоконсервированы методом витрификации. У всех пациенток после цикла переноса остались криоконсервированные эмбрионы для переноса их в следующих циклах. В итоге выявлены достоверные различия в частоте наступления беременности на ПЭ в группе с применением «мягкой» схемы стимуляции суперовуляции по сравнению с группой, где переносили криоконсервированные эмбрионы (36,5 и 25,3% соответственно, р=0,03).
Таким образом, полученные в ходе выполнения исследования данные свидетельствуют о несомненной связи между определенными иммунными факторами в сыворотке крови, ФЖ и эндометрия и эффективностью реализации репродуктивной функции, что диктует необходимость поиска новых молекулярно-биологических маркеров на этапе подготовки к программе ЭКО и ПЭ и совершенствования правильного выбора протоколов стимуляции суперовуляции для различных групп пациенток. С целью снижения риска развития СГЯ без отсрочки ПЭ и связанных с этим психологической нагрузкой, дополнительным временем и затратами на проведение криоконсервации эмбрионов и самой процедуры криопереноса, у пациенток с высоким риском развития СГЯ представляется целесообразным применение «мягкого» протокола стимуляции.



