Воспалительные заболевания – традиционно значимая проблема акушерства и гинекологии, весомость которой определяется как широкой распространенностью воспалительных заболеваний [1], так и тяжестью их отдаленных последствий, проявляющихся в снижении или полной утрате фертильности [2].
Терапия воспалительных заболеваний половой сферы, направленная на быструю и радикальную элиминацию возбудителей, затрудняется высокой частотой встречаемости микроорганизмов с множественной антибиотикорезистентностью [3]. Это проблема усугубляется тем, что новые антибактериальные препараты в последнее время практически не появляются, а устойчивость патогенов к вновь созданным развивается весьма быстро [4–6]. Таким образом, патогены оказываются более успешными в конфронтации между человеком и микроорганизмами, и если эта тенденция сохранится, мы рискуем вернуться в доантибиотическую эру [7]. Эта угроза заставляет искать новые способы сохранения эффективности имеющихся антибиотиков [8].
Одним из таких подходов является использование так называемых «ассистентов антибиотиков» – веществ, которые могут модифицировать чувствительность микроорганизмов к антибиотикам [9]. Мы полагаем, что потенциальными кандидатами на роль «ассистентов антибиотиков» могут быть метаболиты нормальной микрофлоры женского репродуктивного тракта. В пользу этого свидетельствуют данные о зависимости результатов терапии инфекций, передающихся половым путем, от наличия или отсутствия нормальной микрофлоры [10], а также то, что совместное применение пробиотиков и антибиотиков более эффективно, чем их использование по отдельности [11]. Пока не известно, какие конкретно метаболиты вагинальных лактобацилл ответственны за этот феномен. Перспективными в этом отношении кажутся пероксид водорода [12], молочная кислота [13, 14] и сурфактанты [15, 16], продукцией которых принято объяснять способность лактобацилл предотвращать колонизацию патогенными микроорганизмами женских половых органов.
Исходя из вышеизложенного, целью настоящего исследования стало изучение влияния метаболитов лактобацилл, выделенных из влагалища здоровых женщин, и пробиотических препаратов на чувствительность оппортунистических микроорганизмов к антибиотикам.
Материал и методы исследования
В исследовании были использованы: 24 штамма Lactobacillus spp., выделенных от здоровых женщин-добровольцев репродуктивного возраста и идентифицированных по комплексу морфологических, культуральных и биохимических свойств [17]; L. casei subsp. rhamnosus (Lcr35) был выделен из пробиотического препарата лактожиналь. В качестве тест-штаммов использовали вагинальные клинические изоляты Escherichia coli (28 штаммов), метициллинчувствительных Staphylococcus aureus (31 штамм), Klebsiella spp. (15 штаммов), Streptococcus spp. (β-гемолитических стрептококков (36 штаммов)), коагулазоотрицательных Staphylococcus spp. (КОС (33 штамма)) и Gardnerella vaginalis (9 штаммов) из коллекции Института клеточного и внутриклеточного симбиоза УрО РАН, Оренбург. Штаммы лактобацилл культивировали на среде MRS; E. coli, S. aureus, Klebsiella spp. и КОС на среде Mueller Hinton; Streptococcus spp. на среде Todd Hewitt и Gardnerella vaginalis на среде Columbia в соответствующих атмосферных и температурных условиях.
Для получения бесклеточных супернатантов лактобациллы выращивали в среде MRS, бактерии осаждали центрифугированием (10000 g, 10 мин), двукратно отмывали и готовили взвесь (~107 КОЕ/мл) в стерильной среде (0,8 мМ MgSO4, 0,3 мМ MnSO4, 11,5 мМ K2HPO4 и 11,5 мМ глюкозы, pH=7,0) согласно методике [12]. Затем взвесь инкубировали 4 часа в аэробных условиях, бактерии удаляли центрифугированием, полученные супернатанты стерилизовали фильтрованием (0,22 μм, Millipore).
Продукцию сурфактантов оценивали по наличию эмульгирующей активности супернатантов по описанной ранее методике [18].
Для определения концентрации пероксида водорода в лунки 96-луночного планшета вносили по 50 мкл супернатантов и раствора, содержащего 5 мМ тетраметилбензидина (Sigma-Aldrich) и 0,5 U/мл пероксидазы хрена (Sigma-Aldrich) в цитратнофосфатном буфере (рН=4,5). Калибровочные пробы готовили на основе вышеописанной среды. Реакцию останавливали через 5 минут инкубации при 25°С добавлением 50 мкл 5% раствора H2SO4 и замеряли оптическую плотность (λ=450 нМ).
Концентрацию молочной кислоты в супернатантах измеряли с помощью наборов для определения молочной кислоты (kits stereo-specific D- and L-lactate (Sigma-Aldrich Co.)), согласно инструкции производителя.
При необходимости супернатанты лактобацилл обрабатывали каталазой (10 мг/мл) или смесью хлороформ/метанол (2:1 об/об) для исключения влияния пероксида водорода или сурфактантов соответственно. Действие молочной кислоты нейтрализовывали раствором 6 N NaOH до pH 7.0. Для исключения влияния бактериоцинов все супернатанты обрабатывали протеиназой К (20 мг/мл) и трипсином (20 мг/мл) и стерилизовали фильтрованием.
Чувствительность тест-штаммов к антибиотикам определяли методом серийных микроразведений, согласно рекомендациям Clinical and Laboratory Standards Institute [19]. Антибиотики использовали в концентрациях от 2 минимальных ингибиторных концентраций (МИК) и ниже с шагом разведения 10% МИК.
Влияние метаболитов лактобацилл на чувствительность изучали в 96 луночных полистироловых планшетах. Для этого в каждую лунку добавляли 20 мкл антибиотика в количестве, требуемом для достижения нужной конечной концентрации, 20 мкл супернатанта с известной концентрацией метаболитов лактобацилл и 160 мкл инокулята тест-штамма в концентрации 105 КОЕ/мл, приготовленного из ночной культуры в соответствующей питательной среде. В качестве позитивного контроля роста служил инокулят тест-штаммов, негативного контроля роста – питательная среда, контроля отсутствия бактерицидного действия метаболитов – инокулят и нативный или частично инактивированный супернатант, контроля отсутствия влияния предобработки – инокулят и полностью обработанный супернатант. Планшеты инкубировали 12 часов с перемешиванием на орбитальном шейкере. Наименьшую концентрацию антибиотика, при которой не наблюдалось видимого роста, считали МИК.
Экспериментальные данные представлены в виде средних арифметических трех независимых серий экспериментов (М). Для оценки достоверности различий между группами использовали критерии Манна–Уитни и согласия Пирсона (χ2). Во всех процедурах статистического анализа уровень значимости p принимали равным 0,05.

Результаты исследования
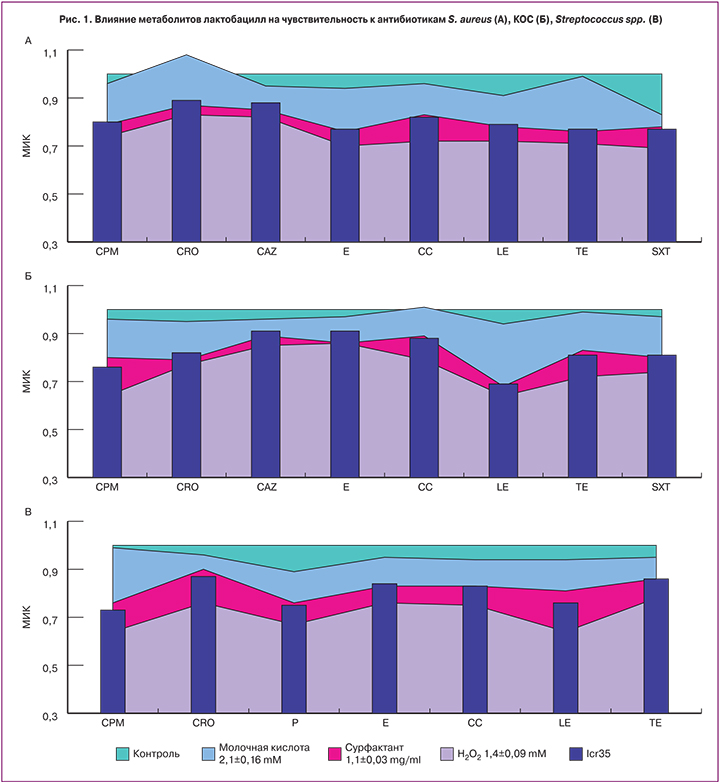
Предварительная обработка тест-штаммов метаболитами пероксидпродуцирующих лактобацилл повышала их чувствительность к антибиотикам на 16–54%. Наиболее выраженно увеличивалась чувствительность S. aureus к макролидам, триметоприму, фторхинолонам и тетрациклинам (рис. 1А), КОС – к фторхинолонам и цефалоспоринам (рис. 1Б), β-гемолитических стрептококков – к фторхинолонам, цефалоспоринам и пенициллинам (рис. 1В), E. coli – к цефалоспоринам и защищенным пенициллинам (рис. 2А) и Klebsiella spp. – к фторхинолонам (рис. 2Б). Чувствительность Gardnerella vaginalis ко всем тестируемым антибиотикам возрастала практически двукратно (рис. 2В).
Молочная кислота не оказывала значительного влияния на чувствительность тест-штаммов к антибиотикам, за исключением некоторых случаев. В частности, молочная кислота снижала МИК гентамицина в отношении Klebsiella spp. на 13% (рис. 2Б), МИК триметоприма в отношении S. aureus – на 17% (рис. 1А), МИК пенициллина против β-гемолитических стрептококков – на 11% (рис. 1В) и МИК ципрофлоксацина в отношении Gardnerella vaginalis – на 12% (рис. 2В). Кроме того, устойчивость КОС к клиндамицину (рис. 1Б) и S. aureus к цефтриаксону (рис. 1А) под влиянием молочной кислоты даже усиливалась.
Предварительная обработка метаболитами лактобацилл, продуцирующих сурфактанты, повышала чувствительность к антибиотикам всех тест-штаммов, но существеннее этот эффект был в отношении грамотрицательных микроорганизмов (на 20–44%). Наиболее значительно повышалась чувствительность E. coli к фторхинолонам, цефалоспоринам и пенициллинам (рис. 2А), Klebsiella spp. – к фторхинолонам и карбапинемам (рис. 2Б). В отношении Gardnerella vaginalis наиболее существенно повышалась чувствительность к ципрофлоксацину и клиндамицину (рис. 2В). В отношении грамположительных бактерий мы наблюдали снижение МИК от 10 до 32%. Наиболее выраженно повышалась чувствительность S. aureus к макролидам, триметоприму, фторхинолонам и тетрациклинам (рис. 1А) и чувствительность КОС к фторхинолонам (рис. 1Б).
Данные результаты свидетельствуют о том, что повышение чувствительности к антибиотикам происходит под влиянием сурфактантов или Н2О2, но не молочной кислоты.
Описанные выше результаты, полученные с использованием клинических изолятов лактобацилл, обнадеживают в отношении возможностей повышения эффективности антибиотикотерапии. Однако в реальной клинической практике допустимо использование только хорошо изученных и одобренных к применению пробиотических препаратов. Кроме того, для использования пробиотика не только после антибиотикотерапии, но и непосредственно во время нее необходимо, чтобы сам пробиотический штамм обладал устойчивостью к большинству антибиотиков. Это позволит пробиотической культуре, сохраняя жизнеспособность, продуцировать метаболиты, необходимые для потенцирования действия антибиотиков. Учитывая вышеизложенное, для оценки влияния нативных метаболитов пробиотических штаммов на антибиотикорезистентность мы посчитали возможным [20] использовать культуру Lcr35, выделенную из препарата лактожиналь.
Культуральная жидкость не продуцирующего пероксид водорода пробиотического штамма LCR35, содержащая 0,8±0,01 мг/мл сурфактантов и 1,9±0,12 мM молочной кислоты, повышала чувствительность к антибиотикам всех тест-штаммов. Наиболее выраженное влияние было зафиксировано в отношении грамвариабельной Gardnerella vaginalis (снижение МИК в среднем на 37% (рис. 2В)), несколько меньше (рис. 2А и 2Б) в отношении грамотрицательных E. coli и Klebsiella spp. – в среднем на 25%, Чувствительность к антибиотикам грамположительных S. aureus, β-гемолитических стрептококков и КОС под влиянием метаболитов LCR35 повышалась в среднем на 18%. Несмотря на то, что содержание сурфактантов в культуральной жидкости штамма Lcr35 было ниже, чем у исследованных клинических штаммов, эффект пробиотика был сопоставим и в половине случаев даже превосходил последние (рис. 1, 2).
Обсуждение
Лактобациллы являются доминирующими представителями нормальной микрофлоры влагалища, обеспечивающими защиту половых органов от колонизации патогенами [21]. Это становится возможным за счет продукции широкого спектра антимикробных веществ, таких как пероксид водорода, молочная кислота, бактериоцины и др. [12, 22]. Кроме того, помимо прямой защиты биотопа, лактобациллы обладают свойством повышать эффективность антимикробного действия факторов естественной резистентности [12] и, как было показано в настоящем исследовании, антибиотиков. Это позволяет рассматривать метаболиты лактобацилл в качестве «ассистентов антибиотиков». Удалось выяснить, что этот феномен обусловлен в основном продукцией пероксида водорода и сурфактантов. Вероятно, это связано с похожими механизмами действия этих веществ. Известно, что эффект антибиотиков опосредован оксидативным стрессом [23–25], а дополнительное смещение баланса про- и антиоксидантов в клетках патогенов под влиянием пероксида водорода и сурфактантов облегчает действие антимикробных веществ [26]. Лактат сам по себе заметно не усиливал чувствительность бактерий к антибиотикам, но его комбинация с сурфактантами, как было показано на примере пробиотического штамма LCR35, значительно повышала эффективность антибиотиков. Следует иметь в виду, что концентрация молочной кислоты, используемая в нашем исследовании, ниже, чем в вагинальной жидкости здоровых женщин, поэтому в дальнейшем необходимо изучить влияние более высоких концентраций лактата. Кроме того, молочная кислота может влиять на эффективность антибиотиков опосредованно, например, за счет инактивации бактериальных аминов [27], обеспечивающих резистентность микроорганизмов к антибиотикам в условиях бактериального вагиноза. Можно предположить, что в этом случае применение пробиотической культуры LCR35 может повышать чувствительность к антибиотикам как прямо, за счет сурфактантов, так и опосредованно за счет нейтрализации аминов молочной кислотой. С учетом того, что препарат лактожиналь помимо клеток лактобацилл LCR35 уже содержит их лиофилизированные метаболиты, которые, как мы показали, могут служить в качестве «ассистентов антибиотиков», его применение должно быть особенно эффективным. Однако для доказательства этого необходимы дальнейшие клинические исследования в отношении конкретных инфекций и антибиотиков.
Заключение
Проведенное исследование обнаружило феномен потенцирования действия антибиотиков метаболитами нормальной микрофлоры влагалища и пробиотического штамма LCR35. Это заставляет задуматься о том, что для повышения эффективности терапии воспалительных заболеваний необходимо учитывать состояние нормальной микрофлоры половых органов на момент применения антибиотиков, при необходимости восполняя ее дефицит антибиотикорезистентными пробиотическими штаммами, способными к продукции «ассистентов антибиотиков».



