Оперативные вмешательства при трубной беременности проводятся в условиях острого и подострого воспалительного процесса органов малого таза и способствуют рецидиву развития спаек [1], поэтому широко используемая интраоперационная антибактериальная терапия должна носить этиотропный характер, направленный на лечение воспалительного процесса, приведшего к поражению эпителия маточных труб, и предупреждение развития спаечной болезни в послеоперационном периоде. Основной причиной возникновения внематочной беременности является воспалительный процесс маточных труб [2], вызываемый Chlamydia trachomatis, Neisseria gonorrhoeae, аэробной и анаэробной флорой [3, 4].
В результате бессимптомного течения хламидиоз часто не диагностируется и не лечится своевременно, следствием чего является хроническая инфекция, приводящая к спаечному процессу, бесплодию или эктопической беременности [5–7]. До сих пор до конца не ясно, каким образом оперативное вмешательство, выполняемое в брюшной полости, приводит в действие воспалительный ответ, ведущий к развитию спаечного процесса [8]. Для предотвращения формирования спаек используется различная стратегия, такая как аппликация жидкостей и мембран. Большинство спаек у пациентов с аппликацией барьеров развиваются на непокрытой поверхности в брюшной полости, что диктует необходимость использования жидкостных противоспаечных агентов для покрывания всех потенциальных повреждений брюшины [9], например препарат ETHICON Intercoat [10, 11]. Однако ни один из существующих методов не дает полного предотвращения образования спаек [12–14], что требует проведения дальнейших исследований для повышения эффективности противоспаечных мероприятий. Одним из возможных вариантов усовершенствования интраоперационной терапии пациенток с трубной беременностью может быть применение этиотропной антибактериальной терапии – сумамед (азитромицин) с использованием противоспаечных барьеров.
Целью исследования стало обоснование интраоперационной терапии у пациенток с трубной беременностью, направленной на снижение частоты и выраженности спайкообразования органов малого таза.
Материал и методы исследования
Проведено обследование 121 женщины с трубной беременностью – основная группа, а также 24 пациентки группы сравнения с бесплодием, подвергнутые диагностической лапароскопии для исключения трубно-перитонеального фактора бесплодия. Операции проводились под эндотрахеальным наркозом. Все пациентки были проинформированы о проводимом исследовании в соответствии со статьями 30, 31, 32 и 43 Основ законодательства Российской Федерации об охране здоровья граждан, добровольно подписывали информационное согласие на обследование, одобренное локальным Этическим комитетом. Критерием включения для группы сравнения было наличие отрицательных результатов ДНК диагностики Сhlamydia trachomatis, Neisseria spp. и gonorrhoeae, Ureaplasma urealyticum, Mycoplasma hominis, Mycoplasma genitalium, Trichomonas vaginalis, серонегативность иммуноглобулинов к Сhlamydia trachomatis, а также отсутствие патологии малого таза (изменений маточных труб, спаечного процесса, эндометриодных гетеротопий, миомы матки, опухолей и опухолевидных образований яичников) при выполнении оперативного вмешательства. Всем пациенткам с трубной беременностью проведена идентификация Сhlamydia trachomatis, Neisseria spp. и gonorrhoeae, Ureaplasma urealyticum, Mycoplasma hominis, Mycoplasma genitalium, Trichomonas vaginalis путем ПЦР диагностики биоптатов шейки матки 3 мм в диаметре, а также маточных труб (3×3 мм) и спаек, удаленных во время оперативного вмешательства. Весь материал немедленно был заморожен до 70°С для дальнейшего исследования. Во время хирургического вмешательства произведен забор венозной крови (10 мл) от каждой пациентки для серологического исследования на наличие антител к Chlamidya trachomatis. По поводу трубной беременности пациенткам основной группы произведены адгезиолизис, сальпингоовариолизис, сальпинготомия или сальпингоэктомия. После анализа клинических, анамнестических данных и результатов ПЦР для определения эффективной интраоперационной терапии все пациентки основной группы (с трубной беременностью) были разделены на 4 подгруппы. Исследование носило характер рандомизированного контролируемого. В основе дизайна исследования лежало сравнение параллельных групп. В первую подгруппу вошли пациентки (n=28), которым вводился сумамед (азитромицин) интраоперационно в дозе 500 мг и в послеоперационном периоде в той же дозе однократно в сутки в течение 5 дней в общей сложности с созданием условий гидрофлотации (400,0 мл 0,9% раствора хлорида натрия, Бракстон, Англия). Вторая подгруппа сформирована из пациенток, которым помимо назначения сумамеда по той же схеме вводили гель Intercoat в брюшную полость (n=26) в объеме от 10 до 30 мл в зависимости от обширности зоны адгезиолизиса. В третьей подгруппе больных использовался интраоперационно цефтриаксон (2 г внутривенно с продолжением до 7 дней в послеоперационном периоде по 2 г в сутки) с созданием эффекта гидрофлотации (n=37). Четвертая подгруппа сформирована из женщин, которым помимо введения цефтриаксона по той же схеме вводили гель в брюшную полость (n=30). Повторные эндоскопические операции с целью оценки результатов лапароскопии произведены через 6–12 недель. Спаечная болезнь органов малого таза оценивалась интраоперационно во время проведения первичной и second-look-лапароскопии по шкале аднексальных спаек Американского общества фертильности (АОФ, 1988). В связи с отказом части пациенток от выполнения second-look-лапароскопии оценка спаечного процесса выполнена в первой подгруппе у 17 пациенток, во второй – у 13, в третьей – у 33, в четвертой – у 15. Средний возраст женщин составил 29,34±0,86 года в основной группе и 27,31±0,64 года в контрольной (статистических отличий не найдено, р=0,124).
Сбор образцов, выделение ДНК, анализ и интерпретация результатов проводились согласно инструкциям производителя (фирма «АмплиСенс» производства ФГУН ЦНИИ Эпидемиологии Роспотребнадзора, Москва). Иммуноглобулины класса G, А, М к Chlamydia trachomatis, G к главному белку наружной мембраны (МОМР) и плазмидному белку Рgp3 Chlamydia trachomatis, G к белку теплового шока (HSP60) в сыворотке крови пациентов основной группы определяли тест-системами производства ЗАО «Вектор-Бест» (Россия). Статистическая обработка исходных рядов признаков осуществлялась с использованием лицензионных пакетов AtteStat 7.3, MedCalc, Microsoft Excel 2003, Statistica 6.0. Анализ полученных данных предусматривал последовательное выполнение нескольких этапов:
- Распределение исходных переменных на нормальность проверяли критерием Колмогорова– Смирнова.
- Рассчитывали дескриптивные статистики – медиана, 1-й и 3-й квартили (Me; 25, 75‰).
- Статистическую значимость различий между группами определяли по показателю Спирмена, различия считали статистически значимыми при р<0,05.
- Для измерения тесноты связи между показателями рассчитывали коэффициенты корреляции (r).
- Для сравнения межгрупповых различий использовали парный критерий Вилкоксона. Достоверность полученных результатов рассчитывалась при доверительной вероятности 0,95.
Результаты исследования и их обсуждение
Полученные данные, характеризующие результаты ПЦР-диагностики, представлены в табл. 1.
Сочетание Ureaplasma urealyticum и Mycoplasma hominis в шейке матки было у 3 пациенток (2,48%), это же сочетание отмечено в спайке у других 3 женщин. Кроме того, в спайках также в 3 случаях выделены в сочетании Chlamydia trachomatis, Ureaplasma urealyticum и Trichomonas vaginalis. В остальных случаях определялся только один возбудитель как в брюшной полости, так и в шейке матки. Диагностическая значимость ПЦР для Ureaplasma urealyticum, Chlamydia trachomatis и Neisseria spp. статистически значимо выше в брюшной полости по сравнению с шейкой матки (р<0,05). При сопоставлении результатов исследований в нижних и верхних отделах генитального тракта выявлено, что отрицательные результаты из верхних и/или нижних отделов наблюдались у 57 пациенток (47,11%), совпадение результатов отмечено у 13 (10,74%) и несовпадение – у 51 (42,15%) пациентки. Для того чтобы трактовать представленный материал, имеет смысл обратиться к литературным данным о характере оказываемого повреждения различными инфектами на эпителий маточных труб. По мнению А. Baczynska и соавт. (2007), Mycoplasma genitalium, но не Mycoplasma hominis приводит к повреждению ресничек [15]. Однако этот эффект весьма умеренный по сравнению с действием Chlamydia trachomatis и Neisseria gonorrhoeae. Возможно, Mycoplasma hominis является часто «сопровождающей» бактерией, которая следует за патогенными микроорганизмами в верхние отделы гениталий. Что касается Ureaplasma urealyticum, которая чаще определяется в верхних отделах гениталий, то, возможно, это микроорганизм-комменсал, способный расти в том числе в здоровых маточных трубах [16, 17]. Trichomonas vaginalis не оказывает значимого воздействия на эпителий труб, является «проводником» остальных инфектов в верхние отделы гениталий. Несмотря на то что данные ПЦР-диагностики показали невысокий процент выявления хламидиоза, согласно литературным источникам, значимость хламидийной инфекции в генезе эктопической беременности не вызывает сомнений. Хламидиоз может приводить к воспалительному процессу органов малого таза, аднекситу, локальному или диффузному перитониту, формированию спаек [18, 19].
По данным W. Dietrich (2010), только у 1% обследованных бесплодных женщин выявляется Chlamydia trachomatis методом ПЦР в шейке матки, причем уровень идентификации не повышается за счет исследования образцов из других точек и серологического исследования [20].
 В нашей работе мы получили наименьший процент выявления Сhlamydia trachomatis в брюшной полости при отрицательном в шейке матки, а терапия сумамедом, тем не менее, была эффективной. Можем ли мы утверждать, что Сhlamydia trachomatis не играет столь большой роли в этиологии трубной беременности, а эффективность терапии сумамедом связана с другими микроорганизмами, не определяемыми в нашей работе? Наши данные не совпадают с результатами H.C. Gerard и соавт. (1998), выявившими в 7 образцах (у 10 женщин) биоптатов маточных труб, взятых при операции по поводу эктопической беременности, метаболически активные клетки хламидий [6]. При проведении гистологического исследования биоптатов труб в этой работе уровень воспаления был различен. Авторы полагают, что хламидийная инфекция верхних половых путей может не достигать уровня тяжелого воспаления для того, чтобы повлиять на изменение репродуктивной функции. Исследование тропных к Сhlamydia trachomatis тканей чаще дает отрицательные результаты, как при синдроме Рейтера, что помогает объяснить причину отрицательных результатов в нашем исследовании. Кроме того, инфекция, вызванная Chlamydia trachomatis, наиболее часто определяется у молодых женщин менее 20 лет и снижается после 30 лет [21]. Возраст пациенток в проводимом нами исследовании приближался к 30 годам. В течение этого периода времени женщины, как правило, получают по поводу различных, в том числе экстрагенитальных заболеваний, антибиотикотерапию, часто включающую в себя макролиды и тетрациклины, что, несмотря на отсутствие указания на лечение хламидиоза в анамнезе, может привести к элиминации инфекта после уже необратимого поражения маточных труб, а также снизить остроту заболевания, тем самым объяснить низкий инфекционный уровень при диагностике.
В нашей работе мы получили наименьший процент выявления Сhlamydia trachomatis в брюшной полости при отрицательном в шейке матки, а терапия сумамедом, тем не менее, была эффективной. Можем ли мы утверждать, что Сhlamydia trachomatis не играет столь большой роли в этиологии трубной беременности, а эффективность терапии сумамедом связана с другими микроорганизмами, не определяемыми в нашей работе? Наши данные не совпадают с результатами H.C. Gerard и соавт. (1998), выявившими в 7 образцах (у 10 женщин) биоптатов маточных труб, взятых при операции по поводу эктопической беременности, метаболически активные клетки хламидий [6]. При проведении гистологического исследования биоптатов труб в этой работе уровень воспаления был различен. Авторы полагают, что хламидийная инфекция верхних половых путей может не достигать уровня тяжелого воспаления для того, чтобы повлиять на изменение репродуктивной функции. Исследование тропных к Сhlamydia trachomatis тканей чаще дает отрицательные результаты, как при синдроме Рейтера, что помогает объяснить причину отрицательных результатов в нашем исследовании. Кроме того, инфекция, вызванная Chlamydia trachomatis, наиболее часто определяется у молодых женщин менее 20 лет и снижается после 30 лет [21]. Возраст пациенток в проводимом нами исследовании приближался к 30 годам. В течение этого периода времени женщины, как правило, получают по поводу различных, в том числе экстрагенитальных заболеваний, антибиотикотерапию, часто включающую в себя макролиды и тетрациклины, что, несмотря на отсутствие указания на лечение хламидиоза в анамнезе, может привести к элиминации инфекта после уже необратимого поражения маточных труб, а также снизить остроту заболевания, тем самым объяснить низкий инфекционный уровень при диагностике.
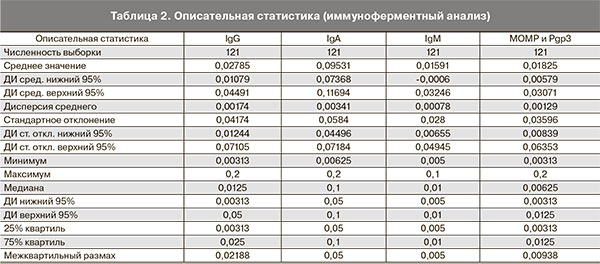
Для определения титра антител в пробе при положительном значении сыворотка разводились от 1/10 до 1/320. С целью стандартизации полученные результаты переведены в приведенные величины. Согласно полученным данным, наибольшую диагностическую значимость имеют антитела к МОМР и Рgp3, поскольку они определяются в наибольшем разведении, наименьшей диагностической ценностью обладают антитела А, которые, соответственно, определяются в наименьшем разведении в сыворотке крови (табл. 2).
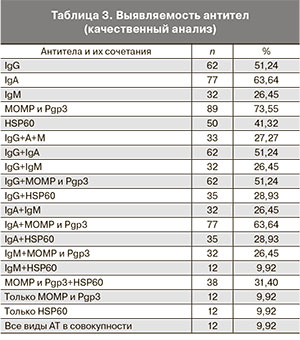
Необходимо отметить, что количественный анализ не выполнен для антител HSP60, поскольку они, по данным лаборатории иммуноферментного анализа, определяются только качественным методом в значениях положительный либо отрицательный результат. Анализ различных сочетаний антител показал, что наиболее характерным для трубной беременности является сочетание антител А и к МОМР и Рgp3 (63,64%) (табл. 3).
Подобные представленным нами данные о несоответствии серологического исследования и ПЦР ранее зафиксированы разными исследователями [20, 22]. Повышение антител при патологии дистального отдела маточных труб и трубной беременности при отрицательных результатах ДНК диагностики, по мнению W. Dietrich (2010), подтверждает, что повторяющееся воздействие Сhlamydia trachomatis через реактивацию и реинфекцию приводит к поражению маточных труб [20].
Отсутствие значимого повышения антител G к Сhlamydia trachomatis также укладывается в канву наших рассуждений, поскольку эти иммуноглобулины не отражают течение инфекции из-за невозможности отличить по уровню этих антител излеченность и персистирующую инфекцию [23–26]. А антитела к МОМР, согласно недавним исследованиям, ассоциируются с протективным иммунным ответом [27, 28]. Похожие результаты были получены C. Bjartling и соавт. в 2007 г.
[29]. В 55 замороженных образцах маточных труб при эктопической беременности не получено ни одного положительного результата идентификации Сhlamydia trachomatis методом ПЦР. Специфические антитела к HSP60 Сhlamydia trachomatis ассоциированы с трубной беременностью, а IgG к Сhlamydia trachomatis – с предшествующими воспалительными заболеваниями малого таза. По мнению авторов, наличие морфологических изменений в контрлатеральной трубе, а также повышение уровня антител к Сhlamydia trachomatis подтверждают ее роль в повреждении маточных труб при эктопической беременности. Персистирующая хламидийная инфекция не была выявлена в тканях маточных труб вследствие элиминации возбудителя, предшествующей трубной беременности [29].
При выполнении операции second-look в подгруппах произведен анализ спаечной болезни (рисунок см. на вклейке).
В I подгруппе степень спаечного процесса составила 7 (5; 10), во II – 4 (4; 5), в III – 18 (15; 21), в IV – 14 (12; 18,5). Наличие статистически значимых различий между подгруппами убедительно доказывает преимущество тактики ведения, выбранной для II подгруппы, – использование сумамеда интраоперационно с введением геля в брюшную полость. Оральное и парентеральное применение антибиотиков приводит к редукции формирования послеоперационных спаек у животных [30, 31].
Но на сегодняшний день нет достаточного количества опубликованных исследований, подтверждающих правильность этой практики [32]. Одним из возможных объяснений эффективности азитромицина, несмотря на отрицательные результаты определения Сhlamydia trachomatis, является его высокая способность проникать из сыворотки крови в ткани, концентрируясь в фагоцитах и не нарушая их функцию, мигрировать к очагу воспаления и накапливаться в максимальных концентрациях непосредственно в очаге.
До сих пор широко используемая в практике методика «гидрофлотации» (от 500 мл до 3 литров вводится в брюшную полость в конце лапароскопии) не дала положительных результатов в плане предупреждения спаечной болезни в нашей работе. Независимо от объема, эта жидкость адсорбируется в васкулярную систему в течение 24–48 ч, что является слишком коротким промежутком времени для предотвращения формирования спаек [33]. Кроме того, инстилляция растворов в перитонеальную полость может быть ассоциирована с дискомфортом в брюшной полости, отеком наружных половых органов, легких и периферическими отеками. Большой объем жидкости в брюшной полости приводит к снижению антибактериальной активности брюшины [34]. Образование спаек является локальным процессом, для предотвращения которого необходимо изолировать травмированные поверхности друг от друга хотя бы на 2 дня [35]. В нашем случае это был гель ETHICON Intercoat. В то же время лекарственная терапия, проводимая внутривенно или внутриперитонеально, представляется менее важной из-за трудности доставки препарата в ишемизированную зону, изолированную наложениями фибрина [36]. В 2011 году опубликованы идентичные нашим данные о высокой эффективности геля при операциях по поводу внематочной беременности лапароскопическим доступом, что подтверждено повторной лапароскопией [37].
Однако отличительной особенностью нашего исследования является доказательство эффективности антибактериальной терапии препаратом сумамед в сочетании с гелем.
Заключение
Таким образом, хламидийная инфекция даже при субклиническом течении крайне неблагоприятно сказывается на репродуктивной функции женщин. Для предупреждения этих последствий очень важно назначать адекватную терапию как можно раньше.
Нецелесообразно проводить забор материала на исследование различных инфектов методом ПЦР в верхних отделах генитального тракта во время операций по поводу трубной беременности. Наиболее часто диагностируемыми антителами к Chlamydia trachomatis у больных с трубной беременностью являются антитела к МОМР и Рgp3 (73,55%), менее значимыми – А и G (63,64 и 51,24%). Характерным для трубной беременности является сочетание антител А и к МОМР и Рgp3 (63,64%).
Для предупреждения спаечной болезни после оперативного вмешательства по поводу трубной беременности эффективным является интраоперационное внутривенное использование сумамеда и введение геля Intercoat в брюшную полость, что приводит к снижению выраженности спаечного процесса с 18 баллов при использовании гидрофлотации с цефалоспоринами до 4 баллов (р<0,01) по шкале аднексальных спаек Американского общества фертильности и может способствовать сохранению репродуктивной функции пациенток.