Актуальность проблемы лечения миомы матки обусловлена широкой ее распространенностью, значительным влиянием на качество жизни пациенток, увеличением частоты появления с возрастом и очевидным «омоложением» заболевания. Средний возраст выявления миомы матки составляет 32,8±0,47 года, а показания к хирургическому лечению (часто к радикальному) появляются примерно к 45 годам [1].
Изменение социальных условий существования женщины, которая планирует беременность в гораздо более позднем возрасте, требует заменить привычное «наблюдение» активными действиями, позволяющими затормозить заболевание.
В настоящее время обозначился новый тренд в органосохраняющих методах ведения женщин с миомой матки – в связи с доказанной ролью прогестерона в контроле пролиферации клеток миомы на ведущее место в фармакотерапии выходят селективные модуляторы прогестероновых рецепторов (СМПР). Доступными селективными модуляторами рецепторов прогестерона являются мифепристон, улипристал, азоприснил [2–4].
С помощью данной патогенетической терапии возможно не только уменьшать проявление основных симптомов заболевания, но и отсрочить оперативное лечение (при миоме матки, не превосходящей размеры 12-недельной беременности).
Из всего спектра медикаментозных средств, применяемых для лечения миомы матки, СМРП отличаются лучшим профилем безопасности и сравнимой или более высокой эффективностью [5]. Как и любая лекарственная терапия, применение СМРП при миоме не демонстрирует абсолютной эффективности, однако существуют теоретические предпосылки ее повышения. Резервом повышения эффективности применения СМРП в лечении миомы матки является персонализация их назначения, для чего требуется выявление маркера эффективности, который можно будет использовать в индивидуальном подборе терапии конкретной пациентке. Для этого необходим анализ данных динамического исследования ключевых молекулярно-фармакологических и биохимических параметров женщин с миомой в зависимости от успеха антигормонального лечения.
В качестве объекта исследования нами выбраны мононуклеарные клетки периферической крови (МНФК), которые в последнее время используются для мониторинга лечения гормонозависимых заболеваний репродуктивной системы женщины [6]. МНФК экспрессируют практически все рецепторы половых стероидных гормонов, что подтверждает эндокринный контроль функции иммунокомпетентных клеток [7]. Ранее нами показано, что в МНФК преобладает экспрессия следующих стероидных рецепторов: мембранный рецептор эстрадиола (mER), ядерный рецептор прогестерона типа А (PR-A), ядерные глюкокортикоидные (GR) и андрогеновые (AR) рецепторы [8].

Учитывая роль половых гормонов в патогенезе миомы матки и наличие/функциональное значение рецепторов стероидов в иммунокомпетентных клетках, нами в качестве молекулярно-фармакологических кандидатов выбраны параметры стероидно-рецепторного транскриптома клеток МНФ периферической крови пациенток с миомой матки до лечения мифепристоном.
Цель работы – изучить экспрессию генов рецепторов эстрадиола (mER), прогестерона (PR-A), глюкокортикоидов (GR), андрогенов (AR) в МНФК пациенток с миомой матки в зависимости от эффективности терапии мифепристоном.
Материал и методы исследования
 В исследование были включены 50 пациенток в возрасте от 18 до 45 лет с миомой матки, соответствующей по величине 6–12-недельной беременности с интерстициальной и интерстициально-субсерозной локализацией миоматозных узлов. Критериями исключения служили: субмукозное расположение миоматозного узла, миома матки размером более 12 недель беременности, мено- и метроррагии, вызывающие анемию (гемоглобин <90 г/л), быстрый рост миомы (увеличение размеров на 4 недели и более за 1 год), нарушение функции тазовых органов, беременность, лактация, тяжелые экстрагенитальные заболевания, опухоли яичников, гиперпластические процессы эндометрия, любые другие новообразования, помимо миомы матки, длительная кортикостероидная терапия, прием препаратов половых гормонов в течение последних 30 дней, индивидуальная непереносимость препарата. Любые другие заболевания или состояния, серьезные отклонения лабораторных показателей от нормы, которые, по мнению врача-исследователя, могут искажать результаты исследования и ограничивать участие пациентки в исследовании.
В исследование были включены 50 пациенток в возрасте от 18 до 45 лет с миомой матки, соответствующей по величине 6–12-недельной беременности с интерстициальной и интерстициально-субсерозной локализацией миоматозных узлов. Критериями исключения служили: субмукозное расположение миоматозного узла, миома матки размером более 12 недель беременности, мено- и метроррагии, вызывающие анемию (гемоглобин <90 г/л), быстрый рост миомы (увеличение размеров на 4 недели и более за 1 год), нарушение функции тазовых органов, беременность, лактация, тяжелые экстрагенитальные заболевания, опухоли яичников, гиперпластические процессы эндометрия, любые другие новообразования, помимо миомы матки, длительная кортикостероидная терапия, прием препаратов половых гормонов в течение последних 30 дней, индивидуальная непереносимость препарата. Любые другие заболевания или состояния, серьезные отклонения лабораторных показателей от нормы, которые, по мнению врача-исследователя, могут искажать результаты исследования и ограничивать участие пациентки в исследовании.
Пациентки проходили обследование и терапевтическое лечение на базе Московского областного научно-исследовательского института акушерства и гинекологии и Национального медико-хирургического центра им. Н.И. Пирогова.
Все пациентки подписывали информированное согласие на участие в клинико-лабораторном исследовании. Пациенток, включенных в клиническое исследование, в зависимости от успеха терапии мифепристоном разделили на две группы. Характеристика групп представлена в таблице.
В процессе рутинного обследования наряду с бимануальным исследованием использовали ультразвуковое сканирование (трансабдоминальное и трансвагинальное), позволяющее оценить исходные размеры матки, величину, расположение и структуру миоматозных узлов. С целью исключения патологии эндометрия в ряде клинических наблюдений до лечения производили гистероскопию, лечебно-диагностическое выскабливание матки, с последующим гистологическим исследованием полученного материала. После проведенного курса лечения мифепристоном изучали особенности восстановления менструального цикла, его характер, оценивали общее состояние, динамику клинических симптомов, размеров матки и миоматозных узлов. Мифепристон (гинестрил, Stada) пациентки принимали внутрь начиная с 1–2-го дня менструального цикла ежедневно, непрерывно в дозе 50 мг. Курс приема препарата составил 3 месяца.
Перед началом терапии у пациенток на 19–23-й день менструального цикла забирали кровь из локтевой вены для стандартного биохимического исследования. Материалом для молекулярно-генетических исследований служили мононуклеарные клетки периферической крови. МНФК из цельной крови выделяли в градиенте плотности фиколла (плотность – 1,077, ПанЭко). Для получения мРНК использовали комплекс реагентов «Рибо-преп» (ИнтерЛабСервис, Россия), для синтеза кДНК на матрице мРНК комплекс реагентов «Реверта-L» (ИнтерЛабСервис, Россия).
Уровень экспрессии генов рецепторов эстрадиола, прогестерона, андрогенов и глюкокортикоидов в МНФК изучали при помощи метода RT-PCR (IQ5 iCycler, Bio-Rad, США). В качестве референсных транскриптов использовали ген «домашнего хозяйства» (GAPDH). Уровень и сравнительный количественный анализ экспрессии генов рецепторов производили по формулам 0,5∆Ct и 2-∆∆Ct [9]. Проверку однородности исследуемых групп осуществляли при помощи критерия χ2, оценку достоверности различий между исследуемыми признаками проводили с использованием U-критерия Манна–Уитни. Для корреляционного анализа связи между параметрами внутри одной выборки использовали коэффициент ранговой корреляции Спирмена. Разница между значениями сравниваемых показателей считалась вероятной при р≤0,05.
Результаты исследования
 В исследование вошли 50 пациенток, женщины получали мифепристон (гинестрил) в дозе 50 мг/сут внутрь, ежедневно, однократно, в течение 3 месяцев.
В исследование вошли 50 пациенток, женщины получали мифепристон (гинестрил) в дозе 50 мг/сут внутрь, ежедневно, однократно, в течение 3 месяцев.
Клиническая эффективность антигормональной терапии в нашем исследовании составила 86% (43 из 50). Разделение пациенток на две группы позволило нам оценить транскрипционно-рецепторный профиль в МНФК женщин в зависимости от эффективности терапии мифепристоном. Для исключения возможного влияния внешних факторов на результаты исследования был проведен частотный анализ клинико-лабораторных данных пациенток двух групп, который показал отсутствие достоверных отличий (таблица).
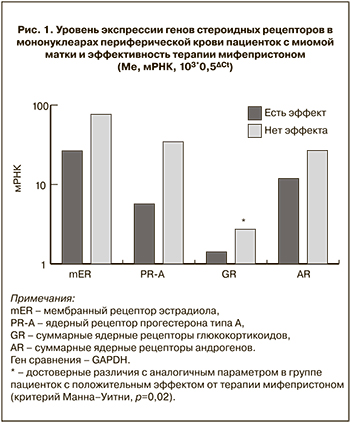
Результаты сравнительного анализа уровня мРНК генов стероидных рецепторов в мононуклеарах периферической крови пациенток с миомой матки в зависимости от эффективности последующей терапии мифепристоном представлены на рис. 1.
Как видно из данных диаграммы в МНФК пациенток II группы, у которых терапевтический эффект мифепристона в отношении размеров миомы отсутствовал, выявлена повышенная экспрессия генов суммарных ядерных глюкокортикоидных рецепторов в 5 раз и тенденция к повышению экспрессии генов рецептора прогестерона типа А (PR-A, p=0,1) по сравнению с аналогичным параметром в МНФК пациенток из I группы. Уровень мРНК mER и AR не различался в МНФК пациенток этих групп. Следовательно, уровень экспрессии GR может служить маркером прогноза эффективности применения мифепристона в лечении пациенток с миомой матки.
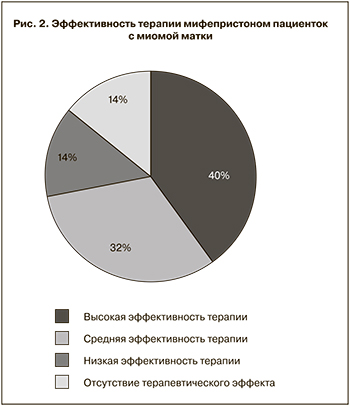
Корреляционный анализ связи между изученными параметрами потребовал табуляции непрерывной переменной данных эффективности терапии. Для этого мы провели перекодирование данных с разбивкой диапазона их изменения на небольшое число интервалов. В качестве основного параметра эффективности терапии использовали степень уменьшения объема опухоли от первоначальных значений в процентах. Весь диапазон эффектов был расчленен на три интервала: «высокая эффективность» – уменьшение размеров миоматозных узлов к завершению лечения от 40 до 100%, «средняя эффективность» – уменьшение размеров миоматозных узлов от 20 до 40% и «низкая эффективность» – уменьшение размеров узлов менее чем на 20%.
В соответствии с такой табуляцией у 40% пациенток с множественной лейомиомой матки в нашем исследовании наблюдали высокую эффективность лечения, у 32% – среднюю эффективность лечения и у 14% обнаружен низкий терапевтический эффект мифепристона. Отсутствие терапевтического действия мифепристона на миоматозные клетки выявили у 14% пациенток (рис. 2).
Корреляционный анализ экспериментальных данных с параметрами эффективности антигормональной терапии позволил выявить, что экспрессия GR в мононуклеарах периферической крови пациенток с миомой матки (до начала лечения) имеет отрицательную корреляцию с успехом последующей терапии мифепристоном (CI 95% Spearman r=0,46, р=0,02).
Обсуждение
Как показали полученные данные, мифепристон вызывает существенный регресс опухоли: эффективность терапии составила 86%, что совпадает с данными отечественных и международных клинических исследований [1, 10, 11].
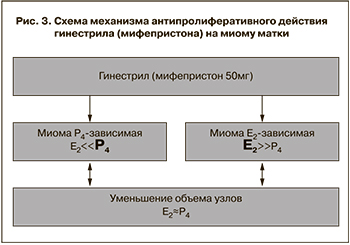 Известно, что в зависимости от клеточного и тканевого контекста мифепристон оказывает агонистическое или антагонистическое прогестерону действие, поэтому он вместе с азоприснилом и улипристалом входит в группу так называемых селективных модуляторов рецепторов прогестерона. Успешное применение мифепристона в терапии миомы матки объясняется способностью восстанавливать физиологический баланс между эстрогенными и гестагенными сигналами, контролирующими деление клеток в ткани миомы (рис. 3). Как известно, эстрадиол осуществляет разрешающее, а прогестерон – собственно пролиферативное действие на клетки миомы. При этом гормоны действуют в неразрывном тандеме. В случае преобладания эстрогенных сигналов в ткани (доминируют рецепторы эстрадиола) принято говорить об эстроген-зависимости патологического процесса, и наоборот – преобладание гестагенных сигнальных путей в ткани является признаком гестагенной зависимости опухолевого роста. Уникальная способность мифепристона приспосабливаться к конкретной транскрипционной ситуации в ткани позволяет оказывать антипролиферативное действие в ткани миомы при любом варианте ее гормональной зависимости. В случае прогестерон-зависимой миомы мифепристон работает в ткани как антигестаген, в случае эстрогенной зависимости патологического процесса препарат проявляет свойства гестагена, реализуя косвенное антиэстрогенное действие (рис. 3).
Известно, что в зависимости от клеточного и тканевого контекста мифепристон оказывает агонистическое или антагонистическое прогестерону действие, поэтому он вместе с азоприснилом и улипристалом входит в группу так называемых селективных модуляторов рецепторов прогестерона. Успешное применение мифепристона в терапии миомы матки объясняется способностью восстанавливать физиологический баланс между эстрогенными и гестагенными сигналами, контролирующими деление клеток в ткани миомы (рис. 3). Как известно, эстрадиол осуществляет разрешающее, а прогестерон – собственно пролиферативное действие на клетки миомы. При этом гормоны действуют в неразрывном тандеме. В случае преобладания эстрогенных сигналов в ткани (доминируют рецепторы эстрадиола) принято говорить об эстроген-зависимости патологического процесса, и наоборот – преобладание гестагенных сигнальных путей в ткани является признаком гестагенной зависимости опухолевого роста. Уникальная способность мифепристона приспосабливаться к конкретной транскрипционной ситуации в ткани позволяет оказывать антипролиферативное действие в ткани миомы при любом варианте ее гормональной зависимости. В случае прогестерон-зависимой миомы мифепристон работает в ткани как антигестаген, в случае эстрогенной зависимости патологического процесса препарат проявляет свойства гестагена, реализуя косвенное антиэстрогенное действие (рис. 3).
Но даже такие универсальные препараты, как СМРП в отдельных случаях оказываются не эффективными. Самыми частыми причинами отсутствия эффекта любого препарата являются уменьшение его концентрации в крови (за счет активации метаболизма) или снижение чувствительности ткани (за счет снижения плотности рецепторов и/или их мутации) [12]. То есть, существует материальная причина отсутствия эффекта, которую можно использовать для персонального подбора адекватной терапии. При этом биологический материал должен быть доступен для рутинного анализа (исключены биопсии тканей миомы или печени). МНФ периферической крови является удобным и информативным объектом для научных и практических целей [6].
Глюкокортикоиды являются физиологическими регуляторами иммунного ответа и влияют на разные функции лимфоцитов и антигенпрезентирующих клеток. Глюкокортикоиды через собственные рецепторы угнетают активность клеток лимфоидного ряда, тормозят продукцию антител B-лимфоцитами и плазматическими клетками, уменьшают продукцию лимфокинов, цитокинов разными иммунокомпетентными клетками и угнетают фагоцитарную активность лейкоцитов. Повышенная экспрессия генов глюкокортикоидных рецепторов в МНФК у пациенток с отсутствием терапевтического эффекта мифепристона может отражать нарушение активности иммунокомпетентных клеток у этих пациенток (II группа).
Таким образом, нами обнаружены молекулярно-фармакологические особенности МНФК женщин с миомой матки, отражающие чувствительность конкретных пациенток к гормональной терапии.
Т.е. транскрипционно-рецепторный профиль иммунокомпетентных клеток может служить косвенным прогностическим признаком эффективности/целесообразности применения мифепристона в терапии пациенток с миомой матки. Следующим этапом нашего исследования будет создание алгоритма подбора рациональной гормональной терапии пациенткам детородного возраста с узлами миомы до 5 см3 с интерстициальной и интерстициально-субсерозной локализацией.
Выявление потенциально чувствительных к антигестагенной терапии пациенток позволит избежать лишних материальных и моральных затрат на лечение и повысить эффективность гормональной терапии миомы матки.
Выявлен потенциальный маркер прогноза эффективности мифепристона в терапии миомы матки у пациенток позднего репродуктивного возраста (уровень мРНК ядерных рецепторов глюкокортикоидов в мононуклеарах крови (RT-PCR)).
Заключение
В работе выявлен дополнительный механизм плейотропного антипролиферативного действия мифепристона у пациенток с миомой матки. Рецепторный профиль иммунокомпетентных клеток может служить косвенным прогностическим признаком эффективности и целесообразности применения мифепристона в терапии пациенток с миомой матки.



