Апоплексия яичника – внезапно наступившее кровоизлияние в яичник, сопровождающееся нарушением целостности его ткани и кровотечением в брюшную полость (синонимы – гематома яичника, кровотечение из яичника, разрыв кисты желтого тела, разрыв яичника) [1]. Апоплексия яичника занимает второе место после внематочной беременности среди причин внутрибрюшного кровотечения [2]. Апоплексия яичника имеет тенденцию к увеличению за 8 лет: в структуре острых гинекологических заболеваний ее частота возросла с 3% в 1997 г. до 17% в 2005 г. [2]. Вместе с тем известно, что травма яичника ведет к глубоким расстройствам кровоснабжения, иннервации органа и гибели части генеративных элементов [1].
После заболевания в 41,9% случаев наблюдается бесплодие, которое обусловлено не только травмой яичника, но и возникновением спаечного процесса в органах малого таза в 99,8% [3]. В связи с этим актуальной является проблема разработки методов послеоперационного восстановления женской репродуктивной системы и профилактики рецидива данного заболевания.
Материал и методы исследования
Проведено открытое проспективное исследование длительностью 12 месяцев, включающее 112 пациенток после оперативного лечения апоплексии яичника. Пациентки были разделены на 2 группы, которые были сопоставимы по возрасту и тяжести заболевания. В группу сравнения вошли 30 пациенток, которые по каким-либо причинам не прошли курс реабилитации (жительницы отдаленных районов Волгоградской области). В основной группе, состоящей из 82 женщин, пациентки через 1,5–2 месяца после апоплексии яичника получали влагалищные тампоны грязи озера Эльтон 4 раза в неделю, с продолжительностью процедуры 30 минут, температурой грязи 40˚С, с последующим орошением влагалища рапой. Курс лечения составил 10 процедур [4]. Рапа представляла собой воду минерального соленого озера Эльтон хлоридно-натриево-магниевого типа. В состав рапы входит: хлористый натрий – 214,5 г/л; хлористый магний – 70,96 г/л; сернистый магний – 20,08 г/л; углекислый кальций – 3,38 г/л; сернокислый кальций – 0,34 г/л; органические вещества – 13,24 г/л; бром, бор [4].
Перед началом лечения пациентками основной группы оформлялось информированное согласие на проведение физиотерапевтического лечения. Критериями включения являлись: 1) подтвержденный интраоперационно диагноз апоплексии яичника; 2) возраст женщины от 18 до 40 лет; 3) наличие информированного согласия на участие в исследовании. Критерии исключения: 1) консервативное лечение апоплексии яичника; 2) возраст пациентки младше 18 и старше 40 лет; 3) общие и гинекологические заболевания, исключающие санаторно-курортное лечение; 4) отказ пациентки от участия в исследовании.
Эффективность лечения оценивалась на основании тестов функциональной диагностики (измерение ректальной температуры тела) и ультразвукового исследования органов малого таза с допплерометрией кровотока в яичниковой артерии с помощью ультразвукового аппарата ALOKA-5000 (Япония), выполненных через 2 месяца после апоплексии яичника до и после пелоидотерапии. Для выяснения особенностей гормонального профиля проведено определение уровня гонадотропинов и яичниковых гормонов в сыворотке крови иммунофлюоресцентным методом через 2 месяца после апоплексии яичника на 2–5-й день менструального цикла: пролактин, лютеинизирующий гормон (ЛГ), фолликулостимулирующий гормон (ФСГ), эстрадиол, тестостерон, глобулины, связывающие половые гормоны (ГСПГ), 17-ОН прогестерон, дегидроэпиандростерон-сульфат (ДГЭА-сульфат), индекс свободных андрогенов (ИСА), рассчитанный по формуле: ИСА = общий тестостерон х 100/ГСПГ. Прогестерон определялся на 20–22-й день менструального цикла. Гормональное исследование проводилось дважды – до и после лечения.
Определение врожденной тромбофилии проводилось методом полимеразной цепной реакции с аллель-специфичными праймерами. Исследуемым материалом для анализа являлась цельная венозная кровь, диагностика проводилась с использованием комплекта реагентов для амплификации «SNP-экспресс».
В каждой клинической группе для оценки показателей составлялись вариационные ряды с последующей их статистической обработкой: определялась средняя арифметическая выборки М, среднее квадратичное отклонение σ, ошибка репрезентативности m=σ/n, где n – число объектов при выборке. Оценка достоверности результатов проводилась с применением критерия Стьюдента. За достоверность различий изучаемых параметров принимали р<0,05.
Результаты исследования и обсуждение
Средний возраст пациенток группы сравнения составил 23±4,3 года, основной группы – 24±3,2 года. Группы были сопоставимы по структуре генитальной, экстрагенитальной патологии и объему оперативного вмешательства, в связи с чем нижеприведенные данные обобщены. Хронические процессы органов дыхания диагностированы в 13,4% случаев, желудочно-кишечного тракта – в 13,6% случаев, хронические заболевания почек – в 8,9% случаев. Хронический двухсторонний сальпингоофорит в анамнезе имели 39% пациенток, что обусловливало первичное бесплодие в 6,7% случаев. Альгодисменорея выявлена у 25% пациенток, гиперполименорея – у 10%.

Резекция патологически измененного яичника выполнялась в 42,8% случаев, цистэктомия – в 25%, коагуляция места разрыва – в 16,7%, зашивание места разрыва – в 10,7%. Легкая степень апоплексии яичника (кровопотеря до 150 мл) диагностирована в 18,3% случаев в основной группе, в 13,3% – в группе сравнения. У большинства пациенток выявлена апоплексия яичника средней степени тяжести с кровопотерей до 500 мл (в 76,8 и 86,7% случаев в основной и в группе сравнения соответственно) [1].
После апоплексии яичника пациенткам выполнялось исследование крови на наличие тромбогенных мутаций в геноме. Мутации С677Т в гене метилентетрагидрофолатредуктазы, G455A в гене фибриногена и G20210A в гене протромбина обнаружены в двух группах в 83,9% случаев. Тромбогенные мутации являются противопоказанием к назначению комбинированной оральной контрацепции согласно «Медицинским критериям приемлемости методов контрацепции» (ВОЗ) 1–4 апреля 2008 г. [5], в связи с чем данная клинико-фармакологическая группа пациенткам после перенесенной апоплексии яичника не назначалась.
Нормальная двухфазная кривая имела место лишь у 6 (20%) пациенток группы сравнения и у 14 (17,1%) пациенток основной группы (рI-II<0,05). Монофазная кривая (ановуляторный менструальный цикл) по данным базальной термометрии наблюдалась у 15 (50%) пациенток группы сравнения и 40 (41%) пациенток основной группы (рI-II<0,01). Длительная гипотермическая первая фаза и недостаточное повышение температуры во вторую фазу, характерные для сочетанной эстроген-гестагенной недостаточности, отмечались у 9 (30%) пациенток группы сравнения и 28 (34,1%) пациенток основной группы (рI-II<0,05).
По данным ультразвукового исследования признаки овуляции (спадающаяся полость фолликула, жидкость в позадиматочном пространстве) были выявлены только у 7 пациенток (23,3%) группы сравнения и у 14 (17,1%) основной группы (рI-II<0,05), мультифолликулярный тип яичников – у 17 (56,7%) и 46 (56,1%) (рI-II<0,05), персистенция фолликула – у 6 (20%) и 22 (26,8%) (рI-II<0,05) соответственно. При этом для пациенток с апоплексией яичника в 43,3% случаев в группе сравнения и в 46,3% случаев в основной группе (рI-II<0,05) были характерны гипоплазия матки и несоответствие М-эхо периовуляторному периоду – отсутствие эхографических признаков трехслойного эндометрия при толщине менее 9 мм [6].
При допплерометрии магистральный кровоток в яичниковой артерии ранее поврежденного яичника был снижен. Он характеризовался повышенным сосудистым сопротивлением (0,58±0,05 в группе сравнения, 0,56±0,03 в основной группе), высоким пульсационным индексом (0,79±0,04 и 0,78±0,04) и низким значением максимальной систолической скорости (14,65±0,67 и 15,9±0,78). Различия между сравниваемыми параметрами кровотока в двух группах были не достоверны.
Проведенное исследование гормонального профиля выявило, что для пациенток после оперативного лечения апоплексии яичника характерна нормогонадотропная нормопролактинемическая гипофункция яичников, диагностированная у 18 (60%) пациенток группы сравнения и 43 (52,4%) пациенток основной группы (рI-II<0,05). Коэффициент ЛГ/ФСГ больше 2,5 определялся у 7 (23,3%) пациенток группы сравнения и у 10 (12,2%) основной группы (рI-II<0,05). Гиперсекреция тестостерона отмечалась у трети больных: у 9 (30%) пациенток группы сравнения и у 20 (24,4%) основной группы (рI-II<0,05).
Таким образом, проведенные исследования показали, что у пациенток, перенесших апоплексию яичника, в отдаленном периоде после операции имеются расстройства кровообращения в яичниковой артерии, нарушения гипоталамо-гипофизарно-яичниковой системы, которые требуют коррекции.
Выбор пелоидотерапии обусловлен свойствами эльтонской грязи. Неорганические вещества абсорбируются слизистыми оболочками, воздействуют на многочисленные рецепторы и сосуды, активизируют микроциркуляцию. Сероводород и аминные основания, а также растворенные в липоидах ионы неорганических и органических кислот, содержащихся в грязи озера Эльтон, обладают гормоноподобным действием. В этом отношении эффект от применения пелоидов напоминает действие фолликулина и других эстрогеноподобных веществ [7]. Выбор данного компонента комплексного лечения также обусловлен свойствами эльтонской грязи нормализовывать микробный баланс, оказывать протеолитическое действие, стимулировать созревание коллагеновых структур и подавлять аутоиммунные процессы [8].
Ультразвуковое исследование органов малого таза после пелоидотерапии продемонстрировало, что признаки овуляции имели место у 75 (91,5%) пациенток основной группы, в отличие от группы сравнения, где овуляторный цикл наблюдался только у 8 (26,7%) пациенток (рI-II<0,001). У этого же контингента больных овуляция была подтверждена с помощью тестов функциональной диагностики (нормальная двухфазная кривая).
Ановуляторный менструальный цикл диагностирован у 16 (53,3%) пациенток группы сравнения и у 4 (4,87%) основной группы (рI-II<0,01). Недостаточность лютеиновой фазы подтверждена у 12 (40%) пациенток группы сравнения и 5 (6,1%) основной группы (рI-II<0,05) на основании выявленных эхо-признаков гиполютеинизма, низкой температурной кривой во 2-ю фазу менструального цикла и снижения концентрации прогестерона на 21–22-й день менструального цикла (1,2±0,35 нг/мл против 16,4±0,7 нг/мл в группе сравнения и в основной группе соответственно, рI-II<0,01) [9].
Гормональные изменения пациенток после пелоидотерапии продемонстированы в табл. 1.
Лабораторные данные, продемонстрированные в табл. 1, подтвердили эстрогеноподобное действие грязи озера Эльтон. В основной группе концентрация эстрадиола превышала значения гормона в группе сравнения в 1,7 раза (рI-II<0,01). Вследствие повышения концентрации эстрогенов происходило снижение синтеза тестостерона до нормальных значений.
Разработанная схема грязелечения продемонстрировала свое положительное влияние не только на функцию яичников, но и на тело матки. Ультразвуковые параметры матки пациенток до и после пелоидотерапии приведены в табл. 2.
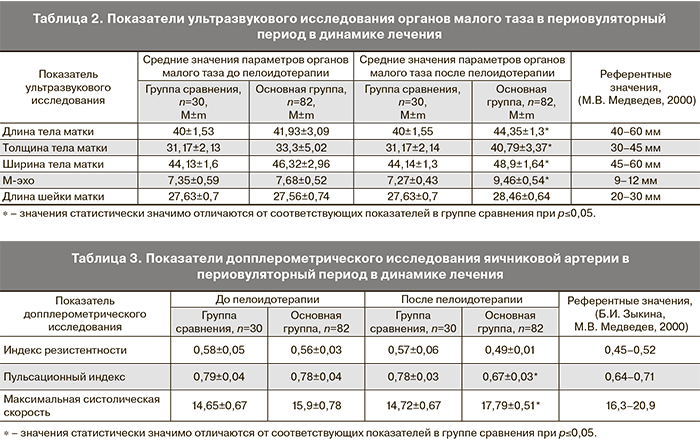
Как видно из полученных результатов, после грязелечения наблюдалось увеличение длины и ширины тела матки в среднем на 10%, толщины тела матки – на 20%. При этом после пелоидотерапии все показатели находились в референтном интервале, в отличие от группы сравнения, где размеры тела матки отставали от нормальных значений. Грязелечение способствовало увеличению М-эха на 1,8±0,19 мм в основной группе, в отличие от группы сравнения, где по-прежнему наблюдалось несоответствие М-эха периовуляторному периоду.
Гипоплазия матки и «тонкий» эндометрий, наблюдаемые у пациенток до грязелечения, не были выявлены ни в одном случае после проведенной пелоидотерапии, тем самым обеспечившей подготовку плодовместилища к планируемой беременности.
Влияние грязи озера Эльтон на кровоток в сосудах яичников показано в табл. 3.
После пелоидотерапии произошло увеличение систолической скорости кровотока и снижение пульсационного индекса в 1,2 раза по сравнению с пациентками группы сравнения (рI-II≤0,05). Устранение нарушений в сосудистом русле яичников в основной группе было вероятной причиной нормального распределения циркулирующих гонадотропинов вокруг доминантного фолликула, что могло способствовать восстановлению овуляторного менструального цикла [10–12].
Заключение
Таким образом, для пациенток в отдаленный период оперативного лечения апоплексии яичника характерны ановуляция или недостаточность лютеиновой фазы, гипоплазия матки, «тонкий» эндометрий, нарушение магистрального кровотока поврежденного яичника. Пелоидотерапия, обладая свойством улучшения микроциркуляции, эстрогеноподобным эффектом, оказалась эффективным методом послеоперационной реабилитации пациенток, способствуя подготовке организма к планируемой беременности.



