D.O. Ott Research Institute of Obstetrics, Gynecology, and Reproductology, Saint Petersburg 199034, Mendeleevskaya liniya 3, Russia;
Department of Obstetrics, Gynecology, and Reproductology, Medical Faculty, Saint Petersburg State University, Saint Petersburg, Russia
Objective. To study the role of abnormal weight gain (AWG) during pregnancy as a risk factor for gestational diabetes mellitus (GDM), by performing a meta-analysis.
Materials and methods. To solve the set problem, literature data from the leading bibliographic sources MEDLINE, Cochrane col., and EMBASE were analyzed. The WHO guidelines and the revised criteria of the Institute of Medicine (IOM, 2009) were used to estimate body mass index (BMI) and normal weight gain during pregnancy. The incidence of GDM was separately assessed for each of three groups of BMI indicators in terms of normal weight gain. The indicators were estimated by performing a meta-analysis using the Review Manager 5.3 (Cochrane col.).
Results. 13 investigations meeting the search criteria were selected for analysis. A total of 85,559 pregnant women were examined. The odds ratio for a GDM risk in AWG for the normal BMI group was established to be 1.67 (95% CI, 1.28-2.18) (χ2 = 32.1; р = 0.001), that for the baseline overweight group was 2.13 (95% CI, 1.47-3.11) (χ2 = 24.9; р = 0.009), and that for the obesity group was 2.0 (95% CI, 1.53-2.63).
Conclusion. AWG during pregnancy is an important factor in the development of GDM. The performed investigation allows pregnant women with AWG to be identified as a group at high risk for carbohydrate metabolic disturbances. Timely detecting AWG and more carefully following the balanced diet and exercise recommendations in such patients will be able to reduce the incidence of GDM and related perinatal complications.
gestational diabetes
abnormal weight gain
obesity
Частота гестационного сахарного диабета (ГСД) во всем мире продолжает неуклонно расти [1, 2]. Это связано с увеличением распространенности избыточного веса и ожирения среди женщин репродуктивного возраста [3, 4]. В то время как избыточный вес и материнское ожирение являются установленным риском развития ГСД, значение патологической прибавки веса (ППВ) во время беременности как предиктора развития данного осложнения остается неясной. Спорным является вопрос о том, что первично: ППВ определяет развитие ГСД или наоборот?
Чрезмерное увеличение веса во время беременности может быть связано с развитием инсулинорезистентности, которая, в свою очередь, приводит к нарушению функции β-клеток поджелудочной железы [5].
Ожирение у матери значительно влияет на развитие ГСД в связи с большей инсулинорезистентностью. Данный механизм хорошо изучен и обусловлен весомым вкладом плацентарных контринсулярных гормонов, гиперэкспрессией провоспалительных цитокинов и фактора некроза опухоли-α (TNFa) [6, 7].
Метаболические изменения способствуют нарушению функциональности рецепторов инсулина в скелетной мускулатуре и снижению транспорта глюкозы в жировой ткани [8]. Несмотря на то что механизм развития ГСД у тучных женщин установлен, вклад и частота ППВ в структуре развития нарушений толерантности к глюкозе до конца не определены [9].
В 2009 году Институт медицины (IOM) пересмотрел руководящие принципы рациональной прибавки веса при беременности [10], которые напрямую зависят от предшествующего индекса массы тела (ИМТ) женщины до зачатия [11, 12]. Считается, что более строгие рекомендации по значению прибавки массы для отдельных весовых категорий помогут снизить частоту осложнений беременности, родов, ожирения у детей. К сожалению, эти предложения не дают оптимальные значения прибавки веса по триместрам для отдельных весовых категорий женщин.
Несмотря на данные рекомендации, в недавнем исследовании в США установлено, что 73% беременных женщин имеют избыточную прибавку веса во время беременности [13].
Высокая распространенность диабета беременных, неблагоприятное влияние его на перинатальные исходы обусловливают несомненную актуальность исследования вклада ППВ в патогенез развития данных нарушений. Интересен и анализ вклада ППВ у различных весовых категорий беременных женщин.
Материал и методы исследования
Для решения поставленной задачи был проведен анализ литературных данных из ведущих библиографических источников – MEDLINE, Cochrane collaboration, EMBASE. Электронный поиск производился в период с 01.01.1995 по 31.01.2015. С учетом полученных данных в анализ взяты исследования, опубликованные только на английском языке.
Использовалась следующая терминология для поиска в различных комбинациях:
- Гестационный сахарный диабет;
- Патологическая прибавка веса;
- Индекс массы тела;
- Ожирение;
- Избыток массы тела.
Наш поиск в системе MEDLINE показал 988 результатов. Поиск в других системах (EMBASE, Cochrane) показал тождественные результаты и выявил 4 и 11 отдельных исследований соответственно. Алгоритм поиска и отбора результатов представлен на рис. 1.
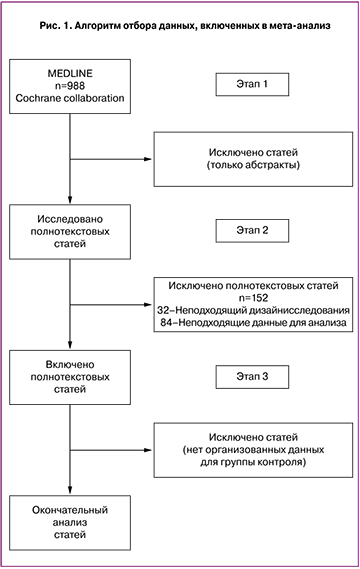
На основании проведенного анализа были отобраны 13 исследований, удовлетворяющих поставленным задачам:
- Когортное ретроспективное – 2;
- Когортное проспективное – 9;
- Рандомизированное контролируемое – 1;
- Исследование случай – контроль – 1.
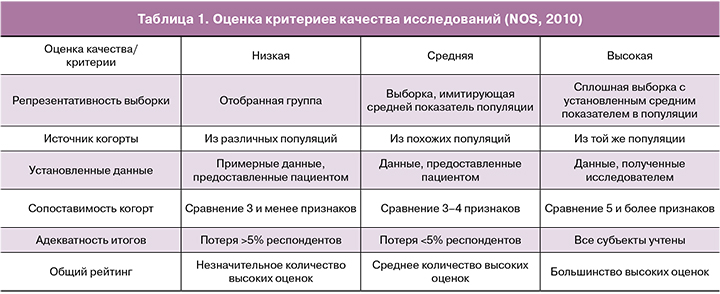
Качество включенных исследований оценивали при помощи критериев шкалы Ньюкасл–Оттава [14].
Были оценены репрезентативность открытых и контрольных групп, средства, с помощью которых воздействие было установлено, и период наблюдения исследования. На основании оценки критериев качество исследования было установлено как низкое, среднее и высокое (табл. 1). Оценку показателей проводили методом мета-анализа при помощи Review Manager 5.3 (Cochrane col., UK).
Для оценки показателей ИМТ и норм прибавки веса во время беременности использовались рекомендации ВОЗ и пересмотренные критерии Института медицины (IOM, 2009). Частота развития ГСД оценивалась отдельно для каждой из трех групп показателей ИМТ с учетом нормы прибавки веса: нормальная масса тела (18,5–24,9 кг/м2) (11,3–15,9 кг); избыток массы тела (25,0–29,9 кг/м2) (6,8–11,3 кг), ожирение (≥30 кг/м2) (5–9,1 кг).
Результаты
Всего было проанализировано 13 исследований, соответствующих критериям поиска. Большая часть исследований была представлена из США – 9, меньшая из стран Юго-Восточной Азии: Япония – 1, Южная Корея – 1, Тайвань – 1. Одно исследование проводилось в Турции. Общее количество беременных, вошедших в мета-анализ, составило 85 559 (табл. 2).
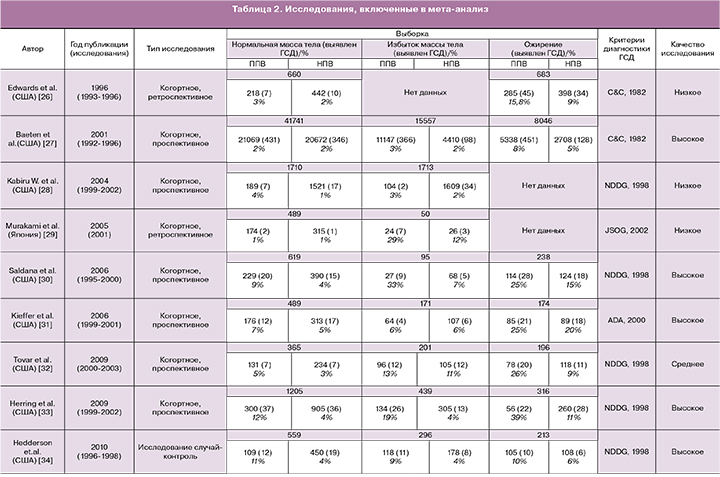
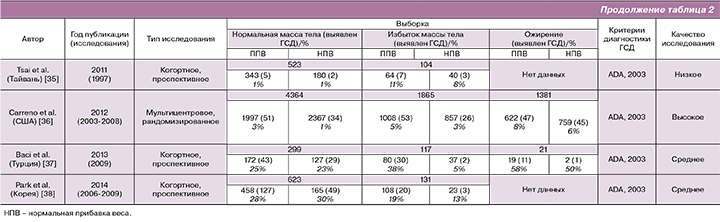
Для диагностики ГСД применялись различные критерии, которые характеризовались как в различиях методики, так и в интерпретации данных результатов. Большая часть исследований проводилось с использованием критериев Американской диабетической ассоциации (ADA, 2000, 2003) [15] и Национальной исследовательской группы по изучению диабета (NDDG, 1998) [16]. В двух случаях применялись критерии Карпентера и Кустена (С&С, 1982) [17], в одном критерии Японского общества акушеров и гинекологов [18].
На основании оценки качества исследований большая часть была высокой – 6, средней – 2, низкой – 5 (табл. 2). Низкие критерии для четырех исследований из пяти были обусловлены отсутствием или недостаточностью данных для группы беременных с исходным ожирением и избытком массы тела.
При оценке частоты ГСД в группе беременных с исходно нормальной массой тела при ППВ случаи развития данного осложнения чаще встречались при наличии большей прибавки веса. Однако в одном исследовании высокого качества [19] и двух низкого [20, 21] они были сопоставимы. В недавнем корейском исследовании низкого качества, напротив, частота ГСД при нормальной прибавке веса была несколько больше (30%), чем в группе с ППВ (28%) [22].
В группе с избыточной массой тела, за исключением одного исследования высокого качества [23], частота ГСД при ППВ была выше. Беременные с исходным ожирением и ППВ имели достоверно большую частоту развития ГСД (табл. 2).
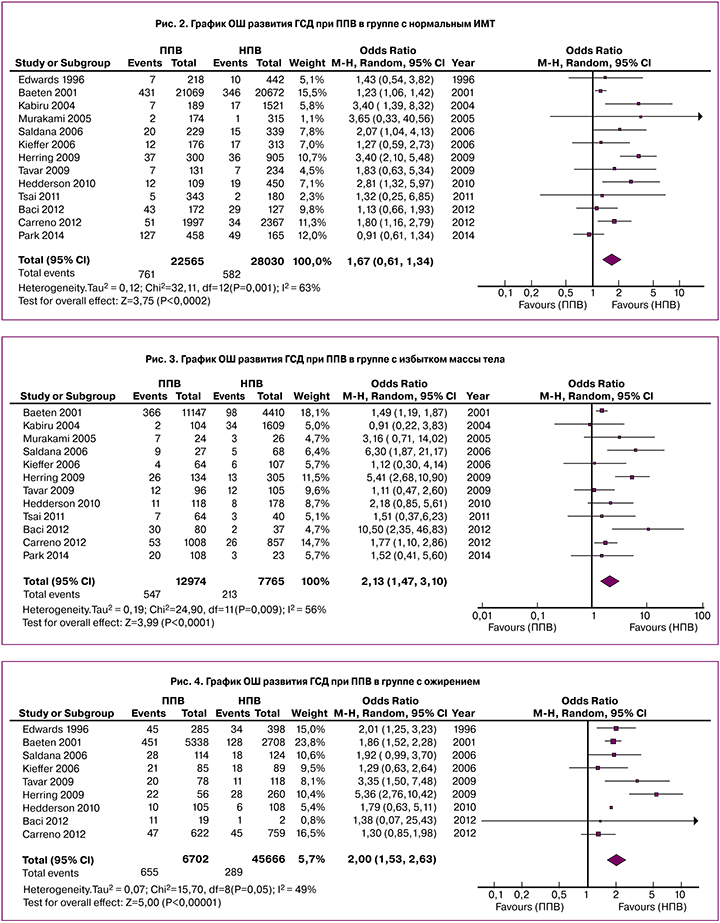
При построении графика распределения для исследуемых женщин с исходной нормальной массой тела установлено, что при меньшей выборке беременных с ППВ (25 565/28 030) количество случаев выявленного ГСД было больше (761 против 582). Рассчитанное отношение шансов (ОШ) для данных групп составило 1,67 (95% ДИ 1,28–2,18) (Chi2 32,1 р=0,001) (рис. 2). Количество женщин с ППВ в группе с ИМТ и ожирением было больше. Для группы с исходным избытком массы тела расчет ОШ составил 2,13 (95% ДИ 1,47–3,11) (Chi2 24,9, р=0,009), с ожирением 2,0 (95% ДИ 1,53–2,63) (Chi2 5,7, р<0,05) (рис. 3, 4). Как видно из всех представленных графиков, развитие ГСД достоверно чаще определяется у женщин с ППВ.
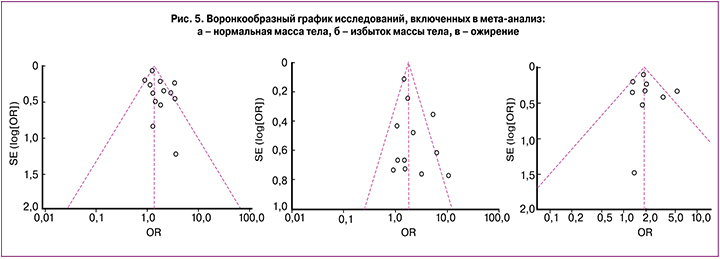
Воронкообразные графики (funnel plot) характеризуют степень предвзятости и возможного смещения анализируемых данных. Исходя из рис. 5, для групп с нормальной и избыточной массой тела большая часть исследований соответствовала правильным характеристикам распределения. Для группы с ожирением характерна неоднородность полученных данных.
Обсуждение результатов
При анализе данных установлено, что наличие ППВ было связано с развитием ГСД в нескольких хорошо представленных исследованиях [10, 24].
С другой стороны, были обнаружены противоположные результаты, не подтверждающие данную связь [25, 26]. Противоречивость полученных данных может быть обусловлена различными методологическими подходами и критериями диагностики как ГСД, так и ППВ.
До пересмотра рекомендаций IOM в 2009 г. в мире существовала неопределенность относительно норм рациональной прибавки веса во время беременности для различных весовых категорий. Исходя из этого, сам термин ППВ и ее норма мог по-разному трактоваться исследователями [27, 28]. Другой значимой проблемой является отсутствие четко определенных, единых методик и критериев диагностики ГСД во всем мире. Это делает затруднительным анализ полученных результатов.
Как было указано выше, диагностика нарушений толерантности к глюкозе во всех исследованиях была проведена в рамках внутренних рекомендаций. Возможно, переход к стандартизированной методики IADSG (2011) [29, 30] для диагностики ГСД поможет более четко интерпретировать результаты в дальнейшем.
Основной целью данного исследования была оценка вклада ППВ как предиктора развития ГСД. На основании полученных результатов, проведенного систематического обзора и мета-анализа мы установили очевидный вклад ППВ в развитие диабета при беременности.
Беременные с патологической прибавкой массы тела имеют двукратный риск развития ГСД при наличии избытка массы тела и ожирения, и в 1,6 раза при нормостеническом телосложении.
Достоверность полученных данных обусловлена высокой оценкой качества исследований. В группе с нормальной массой тела наиболее высокие результаты ОШ развития ГСД представлены двумя когортными исследованиями с низким уровнем качества [20, 31] и двумя – с высоким [32, 33]. В группе с избытком массы тела наиболее значимые результаты были представлены одним когортным исследованием со средним уровнем качества [34], и двумя – с высоким [32, 35]. В группе с ожирением большая часть исследований была высокого качества (рис. 4).
Несомненно, значимый вклад (60–66%) в расчет ОШ для всех групп оказало когортное исследование высокого качества с крупной выборкой [19].
Неоднородность полученных данных для группы с ожирением, характеризующаяся funnel plot графиком, по-видимому, может быть связана с отсутствием значений этой группы в некоторых исследованиях. Данное смещение может оказывать влияние на исходное значение расчета ОШ для третьей группы, которое, несмотря на большую частоту ГСД, оказалось сопоставимо с результатом беременных с избытком массы тела (рис. 5).
Стоит отметить, что наследственность по сахарному диабету, возраст матери, количество родов, ИМТ, принадлежность к азиатской и негроидной расе в некоторых исследованиях были не менее сильными предикторами развития ГСД, чем ППВ [23, 35, 36].
Данное исследование имеет ряд ограничений, о которых было указано ранее. К ним относятся: различные критерии диагностики ГСД и норм ППВ.
Заключение
Таким образом, ППВ при беременности является значимым фактором развития ГСД. Проведенное исследование позволяет выделить беременных с ППВ в группу высокого риска по развитию нарушений углеводного обмена. Своевременное выявление ППВ и более тщательное соблюдение рекомендаций по сбалансированному питанию и физической нагрузке у таких женщин позволит снизить частоту развития ГСД и сопряженных с ним перинатальных осложнений.
- Figure 1. Study selection process
- Figure 2. Risk for gestational dibetes mellitus (GDM) in excessive weight gain (EWG) vs normal weidht gain (NWG) during pregnancy in NON-OVERWEIGHT women
- Figure 3. Risk for gestational dibetes mellitus (GDM) in excessive weight gain (EWG) vs normal weidht gain (NWG) during pregnancy in OVERWEIGHT women
- Figure 4. Risk for gestational dibetes mellitus (GDM) in excessive weight gain (EWG) vs normal weidht gain (NWG) during pregnancy in OBESE women
- Figure 5. Funnel plot: а – normal weight, b – overweight, c - obesy
- Table 1: Quality assessment criteria (NOS, 2010)
- Table 2. Quality assessment of included studies
1. American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care. 2013; 36(Suppl.1): 67-74.
2. Hunt K.J., Schuller K.L. The increasing prevalence of diabetes in pregnancy. Obstet. Gynecol. Clin. North Am. 2007; 34(2): 173-99.
3. Dabelea D., Mayer-Davis E.J., Lamichhane A.P., D’Agostino R.B. Jr., Liese A.D., Vehik K.S. et al. Association of intrauterine exposure to maternal diabetes and obesity with type 2 diabetes in youth: the SEARCH Case-Control Study. Diabetes Care. 2008; 31(7): 1422-6.
4. Callaway L.K., Prins J.B., Chang A.M., McIntyre H.D. The prevalence and impact of overweight and obesity in an Australian obstetric population. Med. J. Aust. 2006; 184(2): 56-9.
5. Xiang A.H., Kawakubo M., Trigo E., Kjos S.L., Buchanan T.A. Declining beta-cell compensation for insulin resistance in Hispanic women with recent gestational diabetes mellitus: association with changes in weight, adiponectin, and C- reactive protein. Diabetes Care. 2010; 33(2): 396-401.
6. Kirwan J.P., Hauguel-De Mouzon S., Lepercq J., Challier J.C., Huston-Presley L., Friedman J.E. et al. TNF-α is a primary mediator of insulin resistance in human pregnancy. Diabetes. 2002; 51(7): 2007-13.
7. Dandona P., Aljada A., Bandyopadhyay A. Inflammation: the link between insulin resistance, obesity and diabetes. Trends Immunol. 2004; 25(1): 4-7.
8. Buchanan T.A., Xiang A.H. Gestational diabetes mellitus. J. Clin. Invest. 2005; 115(3): 485-91.
9. Guelinckx I., Devlieger R., Beckers K., Vansant G. Maternal obesity: pregnancy complications, gestational weight gain and nutrition. Obes. Rev. 2008; 9(2): 140-50.
10. Rasmussen K.M., Yaktine A.L., eds. Weight gain during pregnancy: reexamining the guidelines. Washington, DC: The National Academies Press; 2009.
11.Poston L. Gestational weight gain: influences on the long-term health of the child. Curr. Opin. Clin. Nutr. Metab. Care. 2012; 15(3): 252-7.
12.Siega-Riz A.M., Viswanathan M., Moos M.-K., Deierlein A., Mumford S., Knaack J. et al. A systematic review of outcomes of maternal weight gain according to the Institute of Medicine recommendations: birth weight, fetal growth, and postpartum weight retention. Am. J. Obstet. Gynecol. 2009; 201(4): 339. e1-14.
13.Johnson J., Clifton R.G., Roberts J.M., Myatt L., Hauth J.C., Spong C.Y. et al. Pregnancy outcomes with weight gain above or below the 2009 Institute of Medicine guidelines. Obstet. Gynecol. 2013; 121(5): 969-75.
14.Wells G., Shea B., O’Connell D., Peterson J., Welch V., Losos M., Tugwell P. The Newcastle-Ottawa Quality Assessment Scale (NOS) for assessing the quality of nonrandomized studies in meta-analysis. 2010. Available at: http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp
15.American Diabetes Association. Gestational diabetes mellitus. Diabetes Care. 2004; 27(Suppl. 1): S88-90.
16.American College of Obstetricians and Gynecologists Committee on Practice Bulletins--Obstetrics. ACOG Practice Bulletin. Clinical management guidelines for obstetrician-gynecologists. Number 30, September 2001 (replaces Technical Bulletin Number 200, December 1994). Gestational diabetes. Obstet. Gynecol. 2001; 98(3): 525-38.
17.Carpenter M.W., Coustan D.R. Criteria for screening tests for gestational diabetes. Am. J. Obstet. Gynecol. 1982; 144(7): 768-73.
18.Japan Society of Obstetrics and Gynecology. Definition and criteria of gestational diabetes mellitus. Nippon Sanka Fujinka Gakkai Zasshi. 2002; 54: 11-4.
19.Gibson K.S., Waters T.P., Catalano P.M. Maternal weight gain in women who develop gestational diabetes mellitus. Obstet. Gynecol. 2012; 119(3): 560-5.
20. Sommer C., Mørkrid K., Jenum A.K., Sletner L., Mosdøl A., Birkeland K.I. Weight gain, total fat gain and regional fat gain during pregnancy and the association with gestational diabetes: a population-based cohort study. Int. J. Obes. 2014; 38(1): 76-81.
21.Li N., Liu E., Guo J., Pan L., Li B., Wang P. et al. Maternal prepregnancy body mass index and gestational weight gain on pregnancy outcomes. PLOS One. 2013; 8(12): e82310.
22.Hackmon R., James R., O'Reilly Green C., Ferber A., Barnhard Y., Divon M. The impact of maternal age, body mass index and maternal weight gain on the glucose challenge test in pregnancy. J. Matern. Fetal Neonatal Med. 2007; 20(3): 253-7.
23.Viswanathan M., Siega-Riz A.M., Moos M.K., Deierlein A., Mumford S., Knaack J. et al. Outcomes of maternal weight gain. Evid. Rep. Technol. Assess. (Full Rep). 2008; (168): 1-223.
24.Metzger B.E., Gabbe S.G., Persson B., Buchanan T.A., Catalano P.A. International Association of Diabetes Pregnancy Study Groups Consensus Panel. International association of diabetes and pregnancy study groups recommendations on the diagnosis and classification of hyperglycemia in pregnancy. Diabetes Care. 2010; 33(3): 676-82.
25.Black M.H., Sacks D.A., Xiang A.H., Lawrence J.M. The relative contribution of prepregnancy overweight and obesity, gestational weight gain and IADPSG-defined gestational diabetes mellitus to fetal overgrowth. Diabetes Care. 2013; 36(1): 56-62.
26. Edwards L.E., Hellerstedt W.L., Alton I.R., Story M., Himes J.H. Pregnancy complications and birth outcomes in obese and normal-weight women: effects of gestational weight change. Obstet. Gynecol. 1996; 87(3): 389-94.
27.Baeten J.M., Bukusi E.A., Lambe M. Pregnancy complications and outcomes among overweight and obese nulliparous women. Am. J. Publ. Health. 2001; 91(3): 436-40.
28.Kabiru W., Raynor B.D. Obstetric outcomes associated with increase in BMI category during pregnancy. Am. J. Obstet. Gynecol. 2004; 191(3): 928-32.
29.Murakami M., Ohmichi M., Takahashi T., Shibata A., Fukao A., Morisaki N. et al. Prepregnancy body mass index as an important predictor of perinatal outcomes in Japanese. Arch. Gynecol. Obstet. 2005; 271(4): 311-5.
30.Saldana T.M., Siega-Riz A.M., Adair L.S., Suchindran C. The relationship between pregnancy weight gain and glucose tolerance status among black and white women in central North Carolina. Am. J. Obstet. Gynecol. 2006; 195(6): 1629-35.
31.Kieffer E.C., Tabaei B.P., Carman W.J., Nolan G.H., Guzman J.R., Herman W.H. The influence of maternal weight and glucose tolerance on infant birthweight in Latino mother-infant pairs. Am. J. Publ. Health. 2006; 96(12): 2201-8.
32.Tovar A., Must A., Bermudez O.I., Hyatt R.R., Chasan-Taber L. The impact of gestational weight gain and diet on abnormal glucose tolerance during pregnancy in Hispanic women. Matern. Child Health J. 2009; 13(4): 520-30.
33.Herring S.J., Oken E., Rifas-Shiman S.L., Rich-Edwards J.W., Stuebe A.M., Kleinman K.P. Weight gain in pregnancy and risk of maternal hyperglycemia. Am. J. Obstet. Gynecol. 2009; 201(1): 61. e1-7.
34.Hedderson M.M., Gunderson E.P., Ferrara A. Gestational weight gain and risk of gestational diabetes mellitus. Obstet. Gynecol. 2010; 115(3): 597-604.
35.Tsai I.H., Chen C.P., Sun F.J., Wu C.H., Yeh S.L. Associations of the pre-pregnancy body mass index and gestational weight gain with pregnancy outcomes in Taiwanese women. Asia Pac. J. Clin. Nutr. 2012; 21: 82-7.
36.Carreno C.A., Clifton R.G., Hauth J.C., Myatt L., Roberts J.M., Spong C.Y. et al. Excessive early gestational weight gain and risk of gestational diabetes mellitus in nulliparous women. Obstet. Gynecol. 2012; 119(6): 1227-33.
37.Baci Y., Ustuner I., Keskin H.L., Ersoy R., Avsar A.F. Effect of maternal obesity and weight gain on gestational diabetes mellitus. Gynecol. Endocrinol. 2013; 29(2): 133-6.
38.Park S., Kim M.H., Kim S.H. Early gestational weight gains within current recommendations result in increased risk of gestational diabetes mellitus among Korean women. Diabetes Metab. Res. Rev. 2014; 30(8): 716-25.
Received 19.10.2015
Accepted 27.11.2015
Kapustin Roman Victorovich, PhD, doctor, Department of pathology of pregnancy, D.O. Ott Research Institute of Obstetrics, Gynecology, and Reproductology. 199034, Russia, Saint-Petersburg, Mendeleevskaya liniya 3. E-mail:
Kapustin.Roman@gmail.com. orcid.org/0000-0002-2783-3032
Arzhanova Olga Nikolaevna, MD, Professor, Head of the Department of Pathology of pregnancy, D.O. Ott Research Institute of Obstetrics, Gynecology, and Reproductology. 199034, Russia, Saint-Petersburg, Mendeleevskaya liniya 3. E-mail:
arjanova_olga@mail.ru
Bespalova Olesya Nikolaevna, MD, Main Senior Researcher, Department of Pathology of pregnancy, D.O. Ott Research Institute of Obstetrics, Gynecology, and Reproductology. 199034, Russia, Saint-Petersburg, Mendeleevskaya liniya 3. E-mail:
Pakin Vladimir Stepanovich, postgraduate, D.O. Ott Research Institute of Obstetrics, Gynecology, and Reproductology. 199034, Russia, Saint-Petersburg, Mendeleevskaya liniya 3. E-mail:
pakins@list.ru
Ailamazyan Eduard Karpovich, MD, Professor, D.O. Ott Research Institute of Obstetrics, Gynecology, and Reproductology. 199034, Russia, Saint-Petersburg, Mendeleevskaya liniya 3
For citations: Kapustin R.V., Arzhanova O.N., Bespalova O.N., Pakin V.S., Ailamazyan E.K. Abnormal weight gain as a factor in the development of gestational diabetes mellitus: Systematic review and meta-analysis. Akusherstvo i ginekologiya/Obstetrics and Gynecology. 2016; (5): 12-19. (in Russian)
http://dx.doi.org/10.18565/aig.2016.5.12-19









