Женщины в постменопаузе испытывают различные симптомы, связанные с гормональным дефицитом и обусловленные физиологическими и психологическими возрастными изменениями. Одними из первых проявлений эстрогенного дефицита являются вазомоторные симптомы, которые отмечают до 75% женщин в пери- и постменопаузе. Вторым по частоте проявлением является генитоуринарный менопаузальный синдром (ГУМС), с которым сталкиваются более половины женщин в постменопаузе [1].
Дефицит эстрогена вызывает вульвовагинальную атрофию (ВВА), которая проявляется следующими симптомами: диспареуния, раздражение, зуд, кровоточивость слизистой влагалища при половом акте или гинекологическом осмотре, сухость влагалища и ощущение жжения. В постменопаузе слизистая оболочка влагалища истончается, утрачивает защитные свойства, легко подвергается травматизации с последующим инфицированием как патогенными, так и условно-патогенными микроорганизмами. Те же процессы характерны и для уротелия. Этот период может сопровождаться симтомами нижних мочевыводящих путей или симптомами нарушения мочеиспускания, включая учащенное мочеиспускание, императивные позывы, ноктурию и недержание мочи [2–5]. Термин «ГУМС» обобщает генитальные (сухость, зуд и жжение во влагалище), симптомы нижних мочевых путей (недержание, гиперактивный мочевой пузырь (ГМП)), инфекции мочевыводящих путей), а также сниженное половое влечение, диспареунию, относящиеся к сексуальным симптомам. Все эти симптомы серьезно нарушают качество жизни женщин в постменопаузе [3–6].
В пери- и постменопаузе частота расстройств мочеиспускания у женщин значительно возрастает, по сравнению с репродуктивным периодом. При анализе эпидемиологических данных показано, что в группе женщин от 30 до 60 лет частота недержания мочи составила 21,5%, у женщин старше 60 лет – 44%. Выявлена взаимосвязь длительности менопаузы и частоты нарушений мочеиспускания: так при продолжительности постменопаузы до 5 лет нарушения мочеиспускания встречаются у 15% женщин, 20 лет и более – до 70% [7].
Влагалище, мочевой пузырь, уретра и часть мочеточников развиваются из урогенитального синуса; этим во многом обусловлена их схожая чувствительность к эстрогенам [6, 8], что имеет важное значения для подбора комплексной терапии проявлений ГУМС и нарушений мочеиспускания. Одной из частых патологий в постменопаузе является ГМП [2, 8].
ГМП представляет собой симптомокомплекс, состоящий из следующих симптомов: учащенное мочеиспускание (часто, более 8 раз в сутки), императивные (ургентные) позывы к мочеиспусканию и ноктурия (мочеиспускание в ночное время более 2 раз) при отсутствии других (например, неврологических) состояний. Эти симптомы могут быть связаны с ургентным недержанием мочи, что приводит к определению «влажного» ГМП [2, 8].
ГМП широко распространен среди населения в целом: от 10 до 45% в зависимости от изучаемой популяции [2, 6]. Распространенность ГМП увеличивается с возрастом, что само по себе считается основным фактором риска развития этого заболевания. Этиология ГМП является многофакторной и связана с проблемами, на которые влияют анатомические изменения, факторы, связанные с образом жизни, сопутствующие заболевания и генетическая предрасположенность. У женщин в постменопаузе распространенность ГМП значительно увеличивается, что еще раз подчеркивает связь этого заболевания с дефицитом эстрогенов [2, 6, 9–11].
К сожалению, часто симптомы нарушения мочеиспускания недооцениваются, как пациентками, так и врачами. Женщины, не обладая достаточной информацией, относятся к этому, как к закономерным проявлениям старения. Врачи-гинекологи, встречая пациенток с данной патологией в рутинной практике, не всегда диагностируют ГМП, и как следствие, не проводят корректное лечение.
Данные симптомы серьезно влияют на качество жизни, а в тяжелых случаях могут привести к полной социальной изоляции. Недержание – это особенно неприятное и потенциально инвалидизирующее состояние, которое может привести к депрессии, социальной изоляции и ухудшению общего состояния здоровья. Объективные исследования женской сексуальности сообщают о высокой распространенности женской сексуальной дисфункции у женщин с ГМП. ГМП и недержание мочи у пожилых женщин связаны с повышенной заболеваемостью и инвалидностью, низкой самооценкой, нарушениями сна, снижением ощущения эмоционального благополучия. ГМП приводит к снижению качества жизни, связанного со здоровьем, в большей степени, чем сахарный диабет, гипертония, астма или депрессия [2, 3, 12–14]. Пожилой возраст связан со снижением минеральной плотности костной и повышенным риском остеопороза, для которого переломы являются серьезным осложнением. У пожилых женщин ГМП, ургентное недержание мочи и ноктурия связаны с повышенным риском падений и переломов, что часто вызвано ночным вставанием в туалет. По данным исследований, около 55% пациентов с ГМП имеют минимум 1 падение в течение года, и 5% пациентов отмечают 3 и более падений в год [12]. ГМП с ургентным недержанием мочи может часто сопровождаться дерматитом в области промежности с образованием язв. Особенно серьезен риск у пациентов с ограниченной подвижностью, так как у них повышен риск присоединения инфекции мочевых путей. В более запущенных случаях ГМП может приводить к развитию ригидности стенок мочевого пузыря, пузырно-мочеточниковому рефлюксу и, как следствие, хронической почечной недостаточности [12–15].
Все вышесказанное указывает на необходимость проведения своевременной терапии нарушенного мочеиспускания.
Поэтапный комплексный подход к лечению симптомов ГМП включает изменение образа жизни, тренировку мышц тазового дна и мочевого пузыря, медикаментозную терапию. Лечение ГМП включает поведенческую терапию, направленную на снижение частоты позывов к мочеиспусканию, а также на увеличение емкости мочевого пузыря. Фармакологическое лечение представлено двумя группами препаратов, непосредственно воздействующих на рецепторы, расположенные в мочевом пузыре: м-холинолитики и агонисты β3-адренорецепторов. Особого внимания заслуживает пока единственный в нашей стране представитель агонистов β3-адренорецепторов мирабегрон (Бетмига). Препарат продемонстрировал значимый и сравнимый с м-холинолитиками эффект контроля ургентных позывов к мочеиспусканию, ургентного недержания и ноктурии, но лучший профиль безопасности, сопоставимый с плацебо. В связи с принципиально иным механизмом действия и отсутствием влияния на м-холинорецепторы, препарат не вызывает свойственных м-холинолитикам сухости во рту и запоров, а также не ухудшает когнитивные функции пациентов, что особенно важно для женщин в климактерии [16, 17].
В клинических рекомендациях по лечению ГУМС/ВВА показано, что наиболее эффективным методом лечения проявлений ГУМС является эстрогенотерапия, как системная, так и локальная (возможно их сочетание). Эстрогены быстро уменьшают симптомы сухости и жжения во влагалище, увеличивают толщину слизистой оболочки влагалища, снижают рН влагалища. Для лечения ГУМС, сочетающегося с вазомоторными симптомами менопаузы, чаще выбирают системную менопаузальную гормональную терапию [2, 18, 19].
Ранее исследовалась эффективность локальных форм эстрогена при лечении недержания мочи. Исследования показывают ограниченную эффективность локальных форм эстрогенов в воздействии на мочевые симптомы, но значимую в лечении ВВА. Поэтому комбинация локального эстриола и агониста β3-адренорецепторов представляется обоснованной с целью лечения сочетанных симптомов ГУМС и ГМП [15, 18, 19].
Постановка диагноза, учитывая все выявленные симптомы, играет основную роль при выборе терапии. Так, зачастую ГМП не диагностируется, и женщины с симптомами ГМП остаются без должного лечения. У всех пациенток в пери- и постменопаузе, независимо от причины обращения, необходимо выяснять наличие симптомов урогенитальной атрофии, и не менее важно выяснять наличие симптомов ГМП с недержанием мочи или без него.
Цель исследования: оптимизировать терапию ГМП у женщин в пери- и постменопаузе.
Материалы и методы
Из 335 пациенток 55–70 лет, обратившихся в поликлиническое отделение ГБУЗ «Московский областной научно-исследовательский институт акушерства и гинекологии» (ГБУЗ МО МОНИИАГ) по поводу ГУМС и нарушений мочеиспускания, выделены пациентки с симптомами ургентности.
В исследование было включено 70 пациенток (средний возраст 57 лет) с длительностью постменопаузы от 2 до 10 лет (в среднем 6,3 лет). Пациенты предъявляли жалобы на сухость, зуд, жжение во влагалище, учащенное мочеиспускание днем и/или ночью и ургентные позывы с недержанием или без недержания мочи.
Пациентки были разделены на 2 группы в зависимости от проводимой терапии. В группу 1 включены 35 женщин, которым назначали эстриол 0,5 мг интравагинально (Овестин по 1 дозе интравагинально 21 день ежедневно, далее по 1 дозе 2 раза в неделю). Группу 2 составили 35 пациенток, получавшие комбинацию агониста β3-адренорецепторов мирабегрона (Бетмига 50 мг в сутки) и эстриола микронизированного 0,5 мг (Овестин по 1 дозе интравагинально 21 день ежедневно, далее по 1 дозе 2 раза в неделю) длительно.
Критерии включения в исследование:
- продолжительность постменопаузы 2 года и более;
- возраст женщин, включенных в исследование, 55–70 лет;
- наличие симптомов ГМП: ургентные (императивные) позывы к мочеиспусканию как с недержанием мочи, так и без него, ночные эпизоды мочеиспускания – ноктурия (2 и более мочеиспусканий ночью), учащенное мочеиспускание (поллакиурия, более 8 мочеиспусканий в день);
- симптомы ГУМС и ВВА: зуд, жжение, сухость во влагалище, недостаточная любрикация, диспареуния;
- отсутствие приема лекарственных препаратов по поводу урогенитальной атрофии и/или ГМП в течение 6 месяцев до включения в исследование.
Критериями исключения из исследования были тяжелые соматические заболевания, в том числе сердечно-сосудистые, желудочно-кишечного тракта, почечная недостаточность, печеночная недостаточность, нейродегенеративные заболевания, установленные урогенитальные инфекции.
Методы исследования
1. Заполнение опросников и дневников мочеиспускания (в течение трех дней).
2. Проведение осмотра, гинекологическое исследование, проведение проб на выявление стрессового недержания мочи: проба Вальсальвы, кашлевая проба.
3. Применение шкалы G. Bochman для оценки выраженности урогенитальной атрофии [20].
4. Комплексное уродинамическое исследование (КУДИ).
5. Проведение необходимых общеклинических обследований для назначения менопаузальной гормональной терапии.
Все полученные данные обработаны методом вариационной статистики.
Частота обследования пациенток с ГМП приведена в таблице 1.
Результаты
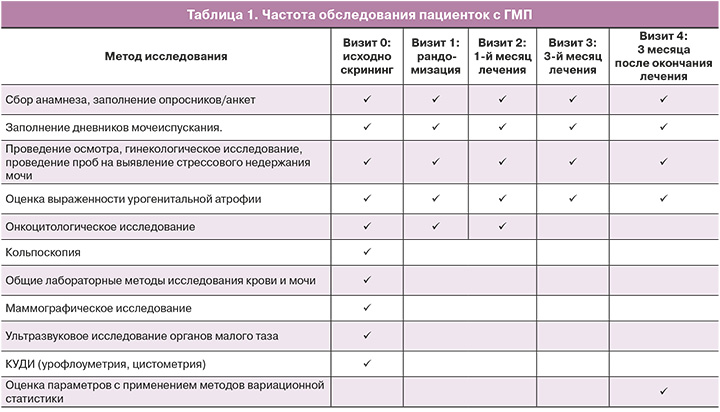
Были выявлены следующие симптомы нарушений мочеиспускания: поллакиурия – в 88,6% (63/70) случаев, ноктурия – в 78,6% (55/70), ургентность – в 67,1% (47/70), ургентное недержание мочи – в 11,4% (8/70) (табл. 2).
У большей части пациенток выявлена избыточная масса тела и ожирение I степени. Средняя масса тела пациенток с нарушениями мочеиспускания составила 68,4 кг; при среднем росте – 162,5 см (индекс массы тела (ИМТ) 27,9 кг/м2). У женщин с ИМТ более 25 кг/м2 было отмечено повышение относительного риска нарушений мочеиспускания RR=1,79 (95% ДИ 1,06–2,30; р<0,05).
Метаболические нарушения часто сопровождают период постменопаузы и могут значимо увеличивать риски развития ГУМС и недержания мочи. Это может быть обусловлено повышением внутрибрюшного давления и влиянием его на нижние отделы урогенитального тракта, особенно учитывая начинающиеся атрофические изменения в тканях.
Влияние симптомов на качество жизни оценивалось с помощью специальной шкалы, где 0 – минимальное, незначительное влияние, а 10 – выраженное, максимальное. Практически все пациентки с симптомами нарушенного мочеиспускания отмечали значимое ухудшение качества жизни. Наиболее выраженные изменения были зафиксированы у пациенток с недержанием мочи (средний бал 9,2). Снижение качества жизни у пациенток было связано с необходимостью ежедневного использования прокладок, социальной изоляцией в связи с симптомами, а соответственно, с отсутствием полноценной личной и социальной жизни.
Появление ночных мочеиспусканий и более частых дневных расценивается многими женщинами, как возрастная норма. Недержание мочи воспринимается, как старение организма. Часто женщины считают, что подобные симптомы в постменопаузе естественны и не требуют лечения. Но все опрошенные соглашаются в одном: эти симптомы являются серьезной проблемой для всех сфер жизни и причиной снижения ее качества.
Обе группы пациенток регулярно заполняли дневники мочеиспускания, с отметкой частоты и объема мочеиспусканий, ургентных позывов при их наличии и недержании мочи в течение трех суток. Результаты оценки дневников мочеиспускания представлены на рисунке 1 и в таблице 2.
При объективном обследовании был оценен соматический статус, анамнез, вес, рост, ИМП, наличие или отсутствие экстрагенитальной патологии. По данным обследования полиморбидность отмечена более, чем у половины участниц (сопутствующие сердечно-сосудистые, метаболические нарушения, заболевания щитовидной железы и др.).
У всех пациенток были выявлены атрофические изменения урогенитального тракта различной степени тяжести (табл. 3).
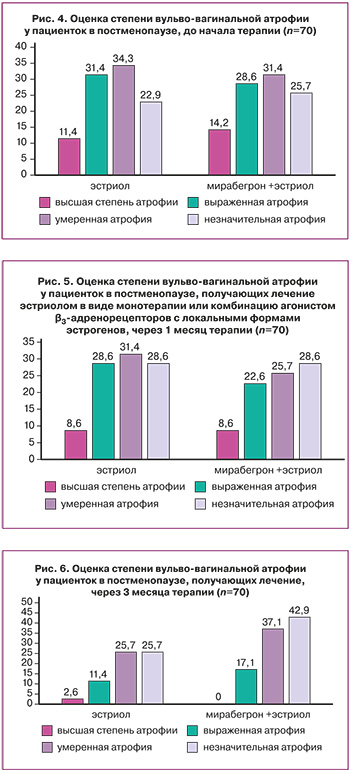
Более трети женщин – 23/70 (32,9%) имели атрофию умеренной степени, характеризующуюся сухостью слизистой, кровоточивостью при интенсивном заборе материала, уровнем рН 5,1–5,5, средней эластичностью. 21/70 (30%) пациенток имели выраженную атрофию – сухость слизистой, сниженную эластичность, кровоточивость при осмотре, щелочной рН 5,6–6,0. Высокая степень атрофии диагностировалась у 9/70 (12,8%) женщин и проявлялась отсутствием эластичности, транссудата, наличием петехиальных кровоизлияний, рН>6,1, выраженной сухости и воспалительных изменений слизистой. В 24,3% (17/70) случаев выявлялась незначительная степень атрофии; данная группа была представлена женщинами с длительностью постменопаузы менее 8 лет (табл. 3).
Онкоцитологическое исследование шейки матки было проведено всем пациенткам (по классификации Папаниколау и системе Бетесда). Выявлены атрофические изменения слизистой шейки матки при отсутствии атипических клеток. При оценке общеклинических анализов значимых отклонений выявлено не было. Ни у одной пациентки не было выявлено противопоказаний к назначению локальной гормонотерапии.
Оценка параметров КУДИ у женщин в постменопаузе с симптомами ГМП
Всем пациенткам основной группы было проведено КУДИ (табл. 4).
У всех пациенток было продемонстрировано снижение основных количественных показателей урофлоуграммы (объем выделенной мочи – V, время мочеиспускания – tmict), а также повышение времени достижения максимального потока мочи (tQmax) у женщин с ГМП. Изменение указанных показателей урофлоуграмм может быть обусловлено наличием гиперактивности детрузора и снижением объема мочевого пузыря, сопровождающих ГМП.
После выполнения урофлоуметрии у всех пациенток определялся объем остаточной мочи, величина которого не превышала 30,0 мл.
В ходе цистометрии наполнения вычислялось детрузорное давление, цистометрическая емкость мочевого пузыря, чувствительность мочевого пузыря, оценивались провокационные пробы (кашлевая проба, проба с водой) (табл. 5).
Результаты лечения пациенток с симптомами
ГМП и ГУМС в постменопаузе локальными формами эстрогенов в качестве монотерапии и в сочетании с агонистом β3-адренорецепторов
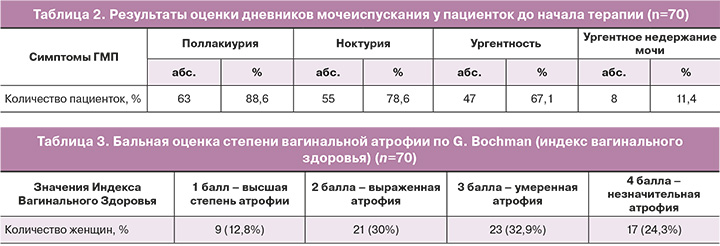
Установлено, что через 1 месяц лечения в обеих группах отмечалось снижение поллакиурии (частоты мочеиспускания), ночных мочеиспусканий (ноктурии) и частоты ургентных позывов к мочеиспусканию. Однако во 2-й группе участниц, которые принимали комбинированную терапию, была отмечена более выраженная динамика (рис. 1, 2, табл. 6.)
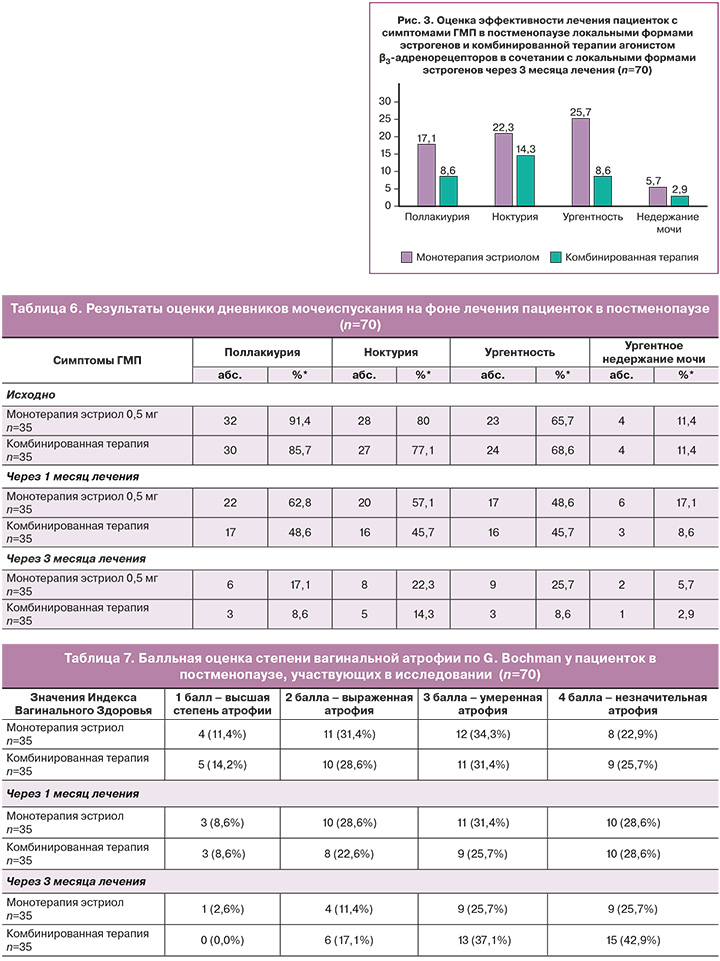
Через 3 месяца лечения пациентки обеих групп отмечали значительное клиническое улучшение. При этом сохранялось различие между группами: в группе комбинированной терапии результаты были лучше (табл. 6). Трем пациенткам, у которых сохранялись жалобы на ургентное недержание мочи (4,3%) было рекомендовано продолжение курса комбинированной терапии.
Была продемонстрирована более высокая эффективность комбинированной схемы в лечении симптомов ургентности – практически 90% излеченных больных через 3 месяца терапии агонистом β3-адренорецепторов в сочетании с локальными эстрогенами, по сравнению с 60% уменьшения симптомов при монотерапии эстрогенами.
Было показано, что значимый положительный эффект при лечении симптомов поллакиурии, ноктурии и ургентности выявлялся уже через месяц и был значимым у пациенток обеих групп, по сравнению с исходными данными, но значительно более выраженным в группе комбинированной терапии (рис. 2).
Через 3 месяца оба вида терапии продемонстрировали значимую эффективность в отношении всех симптомов ГМП, однако в группе комбинированной терапии эффективность была значимо выше; так, частота ургентности была в 4 раза ниже, чем у пациенток, получавших только локальный эстриол (рис. 3).
При оценке переносимости препаратов после окончания исследования нежелательных явлений у пациенток обеих групп выявлено не было.
Оценка изменений степени атрофии урогенитального тракта через 1 и 3 месяца лечения проводилась у всех пациенток (табл. 7).
В обеих группах пациенток отмечено выраженное снижение признаков ВВА.
В обеих группах, как через 1, так и через 3 месяца терапии отмечались положительные изменения вагинального эпителия лечения: снижение частоты высшей степени атрофии и выраженной атрофии (рис. 4–6).
Контрольные показатели общеклинических лабораторных исследований в обеих группах были в пределах нормативных значений.
Частота рецидивов симптомов ГМП у пациенток оценивалась на 4-м визите. Жалобы на возобновление симптомов ГМП отметили 14/70 пациенток (20%). Среди таких симптомов чаще всего отмечена была ургентность (71%), поллакиурия (57%), учащенное мочеиспускание, ноктурия (42%). Жалобы на возобновление ургентного недержания мочи предъявила 1/70 (0,7%) пациентка. Всем 14 пациенткам с рецидивами было рекомендовано продолжение комбинированной терапии мирабегроном (агонистом β3-адренорецепторов) в комбинации с локальными эстрогенами.
Схемы лечения агонистом β3-адренорецепторов (мирабегрон 50 мг) в сочетании с локальным эстрогеном (эстриол 0,5 мг) продемонстрировали значимую эффективность и благоприятный профиль переносимости у пациенток в постменопаузе с симптомами ГМП и ГУМС.
В ходе исследования еще раз была показана связь атрофических изменений урогенитального тракта с симптомами ГМП. Эффективность локальных форм эстрогенов в уменьшении выраженности ВВА подтверждена снижением частоты тяжелой и умеренной степеней атрофии, как через 1, так и через 3 месяца лечения (рис. 4–6).
Показано, что частота нарушений мочеиспускания, в том числе симптомы ГМП и недержание мочи, неуклонно растет с возрастом и длительностью постменопаузы [21, 22]. Учитывая общемировую тенденцию старения населения медицинскому сообществу необходимо уделять все больше внимания лечебным, диагностическим и прогностическим аспектам нарушений мочеиспускания. Как правило, лечением подобных нарушений занимаются урологи, но сейчас становится очевидным, что только междисциплинарное взаимодействие гинекологов, урологов, терапевтов, эндокринологов может привести к действительно значимым результатам уменьшения данной патологии. Особенно важным является участие гинекологов в лечении нарушений мочеиспускания у женщин в периоде постменопаузы [23, 24].
Результаты, полученные в данном исследовании, совпадают с результатами большинства обзоров, указывающих на рост частоты ургентного компонента (симптомов ГМП) у женщин в постменопаузе [17, 24].
Заключение
Наши данные продемонстрировали, что у пациенток с проявлениями ГМП и ГУМС преобладают следующие симптомы: поллакиурия (88,6%), ноктурия (78,6%) и ургентность (67,1%). Кроме того, подавляющем большинстве случаев симптомы ГМП у женщин в постменопаузе сочетаются с атрофическими изменениями урогенитального тракта различной степени выраженности. Значимыми факторами нарушений мочеиспускания у женщин в постменопаузе является ИМТ более 25 кг/м2.
Комбинированная терапия агонистом β3-адренорецепторов (мирабегрон 50 мг) в сочетании с локальными эстрогенами (эстриол 0,5 мг интравагинально) более эффективна в отношении всех симптомов ГМП, чем монотерапии интравагинальным эстриолом. Важным преимуществом комбинированной терапии является также уменьшение частоты рецидивов в 2 раза. Локальная терапия эстриолом эффективна в отношении симптомов ВВА, как в форме монотерапии так и при комбинированном лечении.
Учитывая частоту возможных рецидивов симптомов ГУМС и ГМП, рекомендовано продолжать лечение комбинированной терапией агонистом β3-адренорецепторов в сочетании с локальными эстрогенами (эстриол 0,5 мг интравагинально). Ограничений для длительного приема обоих препаратов нет.



