Российская Федерация, согласно экспертным оценкам ВОЗ, включена в список 22 стран с наибольшим бременем туберкулеза. Однако анализ регистрируемого туберкулеза в России за последние 5 лет показывает устойчивую тенденцию к снижению заболеваемости (с 85,1 в 2008 г. до 68,1 на 100 тыс. населения в 2012 г.). Показатель смертности среди постоянного населения от туберкулеза также снизился по России с 17,9 в 2008 г. до 12,5 на 100 тыс. населения в 2012 г. [1].
Анализ половозрастной структуры больных туберкулезом за период 2008–2012 гг. выявил стагнацию показателя заболеваемости среди женского населения (30,0–31,3 на 100 тыс. женского населения). При этом пик заболеваемости у женщин приходится на фертильный возраст – 18–44 года. Заболеваемость туберкулезом в этой возрастной группе за период 2008–2012 гг. остается достаточно высокой – 61,5–62,4 на 100 тыс. населения [2].
Активная туберкулезная инфекция в организме женщины и проводимая химиотерапия влияют на репродуктивную систему, вызывая ряд характерных нарушений. Данные немногочисленных исследований [3–6] по этому вопросу свидетельствуют о развитии нарушений в гипофизарно-яичниково-надпочечниковой системе, биоценозе слизистых урогенитального тракта, реализации репродуктивной функции среди женщин, больных туберкулезом органов дыхания. Поэтому детальное изучение репродуктивных нарушений, а также своевременная их коррекция в настоящее время представляют несомненную актуальность.
Цель исследования: изучить особенности репродуктивных нарушений у женщин, больных активным туберкулезом органов дыхания, в период их пребывания в специализированном стационаре.
Материал и методы исследования
За период 2010–2012 гг. на базе Центрального научно-исследовательского института туберкулеза РАМН обследованы 268 женщин. При этом было выделено две группы: 1-я группа (основная) – 142 пациентки с активным туберкулезом органов дыхания (ТОД), находившиеся на обследовании и лечении в условиях терапевтических и хирургических отделений; 2-я группа (контрольная) – 126 здоровых женщин. Пациенткам было проведено общее и специализированное обследование: сбор анамнеза, осмотр, анализ данных рентгено-томографических исследований органов дыхания, клинический и биохимический анализ крови, коагулограмма, микробиологическое и молекулярно-генетическое исследование мокроты и менструальной крови, изучение уровня женских половых гормонов, ультразвуковое исследование органов малого таза, цитологическое и молекулярно-генетическое исследование вагинального отделяемого.
Результаты и обсуждение
Анализ возрастного состава показал, что в обеих группах преобладали пациентки активного репродуктивного возраста (26,0±0,42 и 28,0±0,6 года соответственно). Притом в 1-й группе количество социально адаптированных (с наличием постоянной работы, стабильного дохода, отдельной жилой площади и др.) женщин было достоверно меньше по сравнению с таковыми из 2-й группы (31 и 91,3% соответственно) (р≤0,0001). Это связано с социальной значимостью туберкулезной инфекции, которая обусловлена эпидемиологическими, клиническими, психологическими и юридическими аспектами данного заболевания.
У пациенток 1-й группы выявлены определенные особенности течения и клинических форм ТОД. Средняя продолжительность впервые выявленного туберкулеза легких до момента госпитализации в стационар ЦНИИТ РАМН составила 1,9±0,8 года. Такой временной интервал был обусловлен наличием тяжелых клинических форм, склонностью к генерализации процесса, лекарственной устойчивостью, неэффективностью лечения по месту жительства. Кроме того, среди общего числа пациенток зарегистрировано 32 (22,5%) случая рецидива ТОД, которые выявляли в среднем через 6,3±0,7 года, с индивидуальными колебаниями от 3 до 19 лет. В подавляющем большинстве случаев (24 – 75%) рецидивы случались на фоне беременности, лактации, выполнения программы ЭКО, что доказывает гормональную зависимость туберкулезного процесса.
Анализ клинических форм ТОД среди женщин 1-й группы показал преобладание деструктивных процессов – 85 (59,9%) с наличием полостей распада и каверн, сопровождающихся массивным выделением бактерий – 68 (47,9%) и формированием множественной лекарственной устойчивости – 72 (50,7%).
Нами изучено наличие соматической и сопутствующей инфекционной (ВИЧ, гепатиты) патологии. Установлено, что у женщин 1-й группы сопутствующую экстрагенитальную патологию регистрировали в 2,2 раза чаще, чем у пациенток 2-й группы – 69 (48,6%) и 28 (22,2% соответственно) (р≤0,001). ВИЧ/СПИД, гепатиты В и С среди пациенток 2-й группы не выявляли (0%), в то время как среди женщин 1-й группы зарегистрировано 9 (6,3%) человек (р≤0,01).
Исследование характера ритма менструаций до начала заболевания ТОД не выявило существенных различий между женщинами обеих групп. Средний возраст менархе среди пациенток 1-й и 2-й групп составил 13,4±0,6 года и 13,2±0,5 года, длительность менструального цикла – 27,4±1,5 дня и 27,2±1,4 дня, продолжительность менструального кровотечения – 5,1±0,8 дня и 4,9±0,5 дня соответственно.
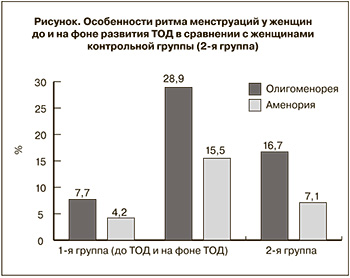
Нарушения ритма менструаций в анамнезе по типу олигоменореи – 21 (16,7%) и аменореи – 9 (7,1%) достоверно чаще имели женщины с ТОД – 11 (7,7%) и 6 (4,2%) соответственно выделенным группам (р≤0,01). Однако на фоне активной туберкулезной инфекции и длительной химиотерапии у пациенток 1-й группы частота олигоменореи возросла до 28,9% (р≤0,0001), аменореи – до 15,5% (р≤0,001). Эти данные свидетельствуют о токсическом влиянии активной туберкулезной инфекции и противотуберкулезных препаратов на функцию яичников (рисунок).
При исследовании особенностей гормонального статуса у 63 пациенток 1-й группы с расстройствами ритма менструаций установлено наличие гипоэстрогении – 68±0,8 пг/мл (референсные значения – 57–227 пг/мл), недостаточности лютеиновой фазы (уровень прогестерона в лютеиновую фазу – 1,8 ммоль/л (3–72 ммоль/л) и тенденции к повышению уровня пролактина до 872 мкМЕ/мл (136–999 мкМЕ/мл). Среди женщин 2-й группы показатели гормонального статуса не выходили за пределы референсных значений: эстрадиол – 134±2,8 пг/мл, прогестерон – 52,2±1,2 ммоль/л, пролактин – 338±2,6 мкМЕ/мл.
38 из 63 пациенток (60,3%) 1-й группы и всем пациенткам 2-й группы (43 – 100%) после получения информированного согласия были назначены лекарственные средства для регуляции ритма менструаций. У больных ТОД были назначены комбинированные оральные контрацептивы (КОК) – 13 (34,2%), гестагены – 18 (47,4%) или растительные аналоги женских половых гормонов – 7 (18,4%). Однако 25 (39,7%) пациенток из 1-й группы от регуляции менструального цикла отказались. Среди пациенток с нарушениями ритма менструаций из контрольной группы КОК получили 19 (44,2%), гестагены – 11 (25,6%) и растительные аналоги женских половых гормонов – 13 (30,2%) женщин. Через 3 месяца корригирующей терапии регулярный цикл и умеренный, безболезненный характер менструального кровотечения отметили 33 (86,8%) женщины 1-й и 40 (93%) женщин 2-й группы.
Анализ других репродуктивных нарушений показал наличие достоверно более высокой частоты воспалительных заболеваний наружных половых органов среди женщин 1-й группы – 91 (64,1%) по сравнению с пациентками группы сравнения – 52 (42,9%) (p≤0,0001). Все пациентки с воспалительными заболеваниями наружных половых органов были обследованы на наличие урогенитальных инфекций, которые были обнаружены как в 1-й – 68 (47,9%), так и во 2-й – 54 (42,9%) группах.
Длительное применение противотуберкулезной (антибактериальной) терапии вызывало среди женщин 1-й группы нарушение вагинальной микрофлоры, что подтверждалось достоверно высокой частотой обнаружения Candida albicans – 48 (70,6%) и Gardnerella vaginalis – 50 (73,5%) по сравнению с пациентками 2-й группы – 12 (22,2%) и 24 (44,4%) соответственно (р≤0,0001).
Всем пациенткам 1-й группы, у которых были обнаружены различные виды урогенитальных инфекций, проводили соответствующее лечение. Наибольшую трудность в лечении представляли собой рецидивирующие вагинальные кандидозы. У 29 (60,4%) из 48 женщин, страдающих воспалением наружных половых органов на фоне Candida albicans, мы наблюдали недостаточную эффективность проводимой противогрибковой терапии. Это объяснялось применением химиотерапии с использованием 4–6 противотуберкулезных препаратов на протяжении длительного периода времени (10–14 месяцев). Активное применение профилактических схем противогрибковой терапии, а также комплексного лечения вагинальных кандидозов с использованием пробиотических, системных и местных иммуномодулирующих средств, позволило нам добиться клинического эффекта в 44 (91,7%) случаях.
 Наличие тяжелых деструктивных форм ТОД, способствующих снижению иммунитета, стало одной из причин персистенции вирусных инфекций среди пациенток 1-й группы – Herpes simplex virus II типа – 22 (32,4%) и Human papillоma virus 16, 18, 31, 33-го типов – 28 (41,2%), в отличие от женщин 2-й группы – 8 (14,8%) и 3 (5,6%) соответственно (р≤0,0001), что позволило нам отнести их к группе высокого риска по развитию неопластических процессов шейки матки.
Наличие тяжелых деструктивных форм ТОД, способствующих снижению иммунитета, стало одной из причин персистенции вирусных инфекций среди пациенток 1-й группы – Herpes simplex virus II типа – 22 (32,4%) и Human papillоma virus 16, 18, 31, 33-го типов – 28 (41,2%), в отличие от женщин 2-й группы – 8 (14,8%) и 3 (5,6%) соответственно (р≤0,0001), что позволило нам отнести их к группе высокого риска по развитию неопластических процессов шейки матки.
Среди женщин 2-й группы преобладали другие виды урогенитальных инфекций: Ureaplasma urealiticum – 19 (35,2%), Chlamidia trachomatis – 28 (22,2%), Mycoplasma genitalium – 9 (16,7%).
Несмотря на высокую частоту обнаружения герпетической и папилломавирусной инфекций среди женщин с ТОД, при выявлении патологических состояний шейки матки мы не обнаружили статистически достоверной разницы между 1-й и 2-й группами – 70 (49,3%) и 52 (41,3%) соответственно. Однако в структуре патологии шейки матки пациенток 1-й группы преобладали более тяжелые гистологические формы по сравнению с женщинами 2-й группы: CIN I, II, III – 20 (47,6%) и 5 (9,6%) соответственно (р≤0,0001), лейкоплакия – 14 (33,3%) и 3 (5,8%) соответственно (р≤0,0001), карцинома in situ – 1 (1,4%) и 0 (0%) соответственно. Кроме того, у 42 (60%) женщин 1-й группы деструктивные патологические состояния шейки матки были выявлены впервые, в отличие от таковых из 2-й группы – 15 (28,8%) соответственно (р≤0,001), что может указывать на высокую скорость трансформации цилиндрического эпителия шейки матки у больных туберкулезом органов дыхания.
У 29 (41,4%) из 70 пациенток 1-й группы и у 35 (67,3%) из 52 пациенток 2-й группы после получения информированного согласия было проведено лечение патологических процессов шейки матки. Женщинам с ТОД применяли: радиоволновую коагуляцию – 14 (48,3%), лазерную коагуляцию – 7 (24,1%), химическую коагуляцию – 5 (17,2%), криодеструкцию – 2 (6,9%), диатермоконизацию – 1 (3,4%). 41 (58,6%) пациентка из 1-й группы от предложенного лечения отказалась. Пациенткам 2-й группы также проводили соответствующее лечение: радиоволновую коагуляцию – 21 (60%), химическую коагуляцию – 10 (28,6%), криодеструкцию и лазерную коагуляцию – 2 (5,7%). 17 (48,6%) женщин из 2-й группы от предложенного лечения отказались.
Через 1 и 3 месяца после проведенного лечения всем пациенткам проводили контрольный осмотр. У всех пациенток 1-й и 2-й групп – 29 (100%) и 35 (100%) соответственно нам удалось добиться полного излечения, подтвержденного методом расширенной кольпоскопии и цитологическим исследованием мазков (соскобов) шейки матки.
Поскольку в структуре клинических форм ТОД регистрировали высокую частоту деструктивных процессов со склонностью к генерализации, наиболее важным моментом нашего исследования было выявление диссеминации туберкулезной инфекции в брюшную полость и определение риска развития в последующем генитального туберкулеза. Проведенный анализ показал достоверно высокую частоту воспалительных заболеваний внутренних половых органов среди пациенток, больных туберкулезом легких, по сравнению с женщинами контрольной группы – 78 (54,9%) и 32 (25,4%) соответственно (p≤0,001). При этом у 36 (46,3%) пациенток 1-й группы воспалительные заболевания матки и придатков были впервые выявлены при госпитализации в специализированный стационар, в отличие от женщин 2-й группы – у 9 (28,1%) (p≤0,0001). У 6 (15,8%) женщин 1-й группы воспалительные заболевания внутренних половых органов были выявлены до начала половой жизни, в отличие от пациенток группы сравнения – 0 (0%) (p≤0,0001).
Необходимо отметить, что у большинства женщин с ТОД воспалительные заболевания матки и придатков имели острый и подострый характер. Напротив, у пациенток 2-й группы отмечали хроническое (многолетнее) течение воспалительного процесса – 3,8±0,1 года (р≤0,01), имеющего сезонный характер, который сопровождался развитием спаечного процесса – 27 (84,4%), в отличие от пациенток основной группы – 22 (28,2%) (p≤0,001).
Этот факт определял различный характер и степень выраженности клинической симптоматики воспалительного заболевания органов малого таза (ВЗОМТ). Так, среди женщин с туберкулезом органов дыхания регистрировали высокую частоту пахового лимфоаденита по сравнению с пациентками контрольной группы – 35 (44,9%) и 3 (9,4%) соответственно (p≤0,0001). ВЗОМТ у пациенток 1-й группы характеризовался наличием выраженного экссудативного компонента, вплоть до асцита, выявляемого при ультразвуковом исследовании – 15 (19,2%), в то время как среди женщин контрольной группы таковые обнаружены не были – 0 (0%) (p≤0,0001). Полученные данные позволяют предположить взаимосвязь активного туберкулеза органов дыхания с активным характером воспаления во внутренних половых органах как проявление системной воспалительной реакции с вовлечением лимфатической и кровеносной систем.
На фоне проводимой химиотерапии у 51 (65,4%) из 78 женщин 1-й группы, страдающих ВЗОМТ, отмечали уменьшение, вплоть до исчезновения, признаков воспалительного процесса. Регистрировали снижение выраженности болевого синдрома – 63 (80,8%); уменьшение, вплоть до исчезновения, пахового лимфоаденита – 59 (75,6%) и воспалительного экссудата в полости малого таза – 66 (84,6%). Положительная динамика течения воспалительных заболеваний внутренних половых органов на фоне противотуберкулезной терапии свидетельствует о возможной лимфо- и гематогенной диссеминации туберкулезной инфекции из легких (грудная полость) в брюшную полость и в органы малого таза, и позволяет нам отнести этих женщин в группу высокого риска по развитию в последующем генитального туберкулеза.
В связи с этим у 39 (50%) из 78 женщин 1-й группы с наличием сочетания тяжелого деструктивного процесса в легких и воспалительных заболеваний внутренних половых органов было проведено специализированное исследование для исключения генитального туберкулеза. Однако мы были ограничены диагностическим минимумом в связи с невозможностью проведения ряда исследований. Провокационные туберкулиновые пробы не проводили в связи с риском активации туберкулеза органов дыхания. Диагностическое выскабливание слизистой полости матки с последующим гистологическим исследованием эндометрия и гистеросальпингографию не применяли из-за инвазивного характера данных методик, угрозы диссеминации туберкулезной инфекции в брюшную полость и развития перитонита.
При проведении микробиологического и молекулярно-генетического исследования менструальной крови на наличие микобактерий туберкулеза (МБТ) и ДНК МБТ было обнаружено, что в 5 (12,8%) из 39 образцов выявлены МБТ и ДНК МБТ в менструальной крови. Однако по наличию ДНК МБТ оценить степень вирулентности патогена не представляется возможным, поэтому наши возможности в диагностике генитального туберкулеза были весьма ограниченными. Тем не менее, у 2 (5,1%) женщин 1-й группы на основании данных комплексного обследования был установлен туберкулез женских половых органов.
Заключение
Среди женщин, больных ТОД, наблюдается низкий уровень соматического и репродуктивного здоровья.
У 44,4% женщин, больных ТОД, выявлены нарушения ритма менструаций, которые возникают на фоне длительной, массивной химиотерапии, что свидетельствуют о токсическом влиянии противотуберкулезных препаратов на функцию яичников.
Длительный прием противотуберкулезных препаратов у женщин, больных ТОД, способствует изменению биоценоза слизистых наружных половых органов, которые клинически проявляются в виде воспалительных заболеваний (64,1%) рецидивирующего характера. У 70,6% выявлен вагинальный кандидоз, у 73,5% – бактериальный вагиноз, у 41,2% – вирус папилломы человека 16, 18, 31, 33-го типов и у 32,4% – вирус простого герпеса II типа.
У женщин, больных ТОД, частота патологических состояний шейки матки составляет 49,3%, что не превышает общепопуляционную частоту. Однако наблюдаются более тяжелые гистологические формы со склонностью к пролиферации, что позволяет их отнести в группу риска развития рака шейки матки.
Среди женщин, больных ТОД, отмечается высокая частота воспалительных заболеваний внутренних половых органов (54,9%), которые характеризуются острым течением, возможностью лимфо- и гематогенной диссеминации туберкулезной инфекции, что позволяют отнести их в группу риска по развитию генитального туберкулеза.
Своевременная диагностика и лечение репродуктивных нарушений у женщин с ТОД позволяет улучшить эффективность основного лечения, провести профилактику развития рака шейки матки, генитального туберкулеза, а также повысить в последующем возможность реализации репродуктивной функции.



