Современные международные экономические отношения неразрывно связаны с такими понятиями, как глобализация, миграция, урбанизация. Это влечет изменения социально-экономического и социально-культурного статуса населения планеты, определяя пищевое поведение и, как следствие, микробный пейзаж кишечника [1, 2], кожи, ротовой полости, влагалища [3] и др. Прогрессирующая глобализация, аккультурация мигрантов с принятием ими иной культуры питания, в частности «западного» типа, характеризующегося чрезмерным потреблением рафинированных сахаров, соли, насыщенных жиров, омега-6 жирных кислот и низким – омега-3 жирных кислот [4], привели к многократному увеличению частоты ожирения, сахарного диабета, гипертонической болезни и репродуктивным нарушениям [5–7].
Территория России лежит в пяти климатических зонах, включая зоны с суровым северным климатом (полярная и «особая» климатические зоны), в состав которых включены районы Крайнего Севера и территория за Полярным кругом с экстремальными климатическими условиями, требующими компенсации энергетических потерь [8]. У коренных малочисленных народов Севера (ханты и манси), проживающих в экстремальных климатических условиях, формируется так называемый полярный метаболический тип с повышением энергетической значимости белков и жиров в сравнении с углеводами [9, 10].
В период нефтегазового освоения Западной Сибири в 70–80-е гг. прошлого столетия миграция населения в ХМАО–Югре имела динамический прогресс. Крупномасштабное освоение нефтегазовых промыслов привело к приросту населения. В результате миграционных потоков [1, 11] увеличилось в сотни раз «пришлое» население – русские, украинцы, татары, башкиры и представители других национальностей, не адаптированные эволюционно к условиям Крайнего Севера, а также их потомки, родившиеся и выросшие здесь [12].
Малочисленные народы Западной Сибири, исторически ведущие традиционный кочевой образ жизни, в результате начавшегося промышленного освоения природных ресурсов, строительства новых городов, поселений и прокладки наземной инженерии были поставлены перед выбором: отказаться от привычного уклада и переселиться в города или оставаться кочевниками [13, 14].
Данные о состоянии здоровья населения коренных малочисленных народов Севера (КМНС) ханты и манси, мигрировавших в город и изменивших традиционный кочевой образ жизни, малочисленны. Учитывая, что нами в предыдущем исследовании было выявлено увеличение частоты осложнений беременности и неблагоприятных исходов (преждевременных родов и рождения маловесных детей) у КМНС, мигрировавших в город [15], целью настоящего исследования явилось изучение состояния биоценоза влагалища и желудочно-кишечного тракта, массо-ростовых показателей у КМНС, мигрировавших и проживающих в городе Ханты-Мансийске, Ханты-Мансийском автономном округе–Югре.
Материалы и методы
Проведен проспективный анализ жалоб, анамнестических, антропометрических (рост, масса тела, ИМТ, окружность талии) данных, а также оценка состояния биоценоза влагалища и кишечника у 125 пациенток, отобранных методом сплошной выборки.
В 1-ю группу вошли 39 женщин ханты и манси из числа КМНС, проживающих в п.г.т. Березово и на стойбищах в Березовском районе ХМАО–Югры, ведущих традиционный кочевой образ жизни. Во 2-ю группу вошли 25 женщин ханты и манси (КМНС), мигрировавших и проживающих в городе Ханты-Мансийске. Третью группу составила 61 женщина из числа «пришлого» населения (русские, украинцы, татары, башкиры и др.), проживающего в Ханты-Мансийске.
Измерение роста проводилось с помощью ростомера, массы тела – с использованием весов, ИМТ рассчитывали по формуле: массу тела в килограммах делили на рост в метрах, возведенный в квадрат. Комплексное микробиологическое исследование отделяемого влагалища с целью характеристики микробиоты влагалища у наблюдаемых женщин включало микроскопию окрашенных по Граму мазков и исследование методом полимеразной цепной реакции (ПЦР) в режиме реального времени («Фемофлор»). Состояние биоценоза влагалища оценивали по классификации Кира Е.Ф. [16]:
1. нормоценоз, характеризующийся доминированием лактобактерий, отсутствием грамотрицательной микрофлоры, спор и мицелия дрожжеподобных грибов, наличием единичных лейкоцитов и «чистых» эпителиальных клеток. Подобная картина отражает типичное состояние нормального биотопа влагалища;
2. промежуточный тип – умеренное или сниженное количество лактобактерий, наличие грамположительных кокков, грамотрицательных палочек. Обнаруживаются лейкоциты, моноциты, макрофаги, эпителиальные клетки. Является пограничным типом, часто наблюдается у здоровых женщин, редко сопровождается жалобами и клиническими проявлениями;
3. дисбиоз влагалища, характеризующийся незначительным количеством или полным отсутствием лактобактерий, обильной полиморфной грамотрицательной и грамположительной палочковой и кокковой микрофлорой, наличием «ключевых клеток». Количество лейкоцитов вариабельно, отмечается отсутствие или незавершенность фагоцитоза. Соответствует микробиологической картине бактериального вагиноза, по МКБ-10 – N89 Другие невоспалительные болезни влагалища;
4. вагинит (воспалительный тип мазка) – полимикробная картина мазка с большим количеством лейкоцитов, макрофагов, эпителиальных клеток, отмечается выраженный фагоцитоз. По МКБ-10 – N76 Другие воспалительные болезни влагалища и вульвы. При определении в мазках вагинального отделяемого грибов рода Candida и обнаружении по данным ПЦР в реальном времени в титре более 104 Candida spp. выставляли диагноз В37.3 Вульвовагинальный кандидоз (МКБ-10).
С целью оценки микробиоты кишечника проводилось исследование методом ПЦР в режиме реального времени («Колонофлор»).
Статистический анализ
Статистическая обработка выполнялась с помощью пакета программ SPSS, Statistica 8.0, а также пакета анализа Microsoft Exсel. Использовались программы дескриптивной статистики, сравнение показателей трех групп по χ2-квадрату Пирсона. Критерии считались значимыми при р<0,05 Для описания количественных данных использовались описание в виде Мe (Q1–Q3), однофакторный дисперсионный анализ множественных сравнений с поправкой по Бонферрони (р=0,05/n, где n – число сравнений). Число пар сравнения рассчитывается по формуле: m=n(n–1)/2, где n – количество групп (m=3(3–1)/2, m=3). Критерии считались значимыми при р=0,016 (р=0,05/3).
Результаты
Средний возраст в группе КМНС, проживающих в селе (группа 1), составлял 31,2 (25,16–36,31) года, в группе КМНС, проживающих в городе (группа 2), – 29,4 (23,34–35,21), у «пришлых» женщин (группа 3) – 33,8 (26,13–38,43) года.
Из антропометрических характеристик обследуемых женщин были проанализированы следующие показатели: рост – он составил 154,9 (153,14–157,11) см в группе КМНС, проживающих в селе, 159,6 (157,19–162,09) см в группе КМНС, проживающих в городе, и 165,3 (164,42–166,24) см у «пришлых» женщин (р<0,001). Масса тела у КМНС, проживающих в селе, была значительно ниже – 58,1 (55,63–60,93) кг, чем в группе КМНС, проживающих в городе, – 67,1 (62,61–71,63) кг и у «пришлого» населения – 71,2 (68,13–74,03) кг (p1–3<0,001).
Расчет ИМТ по G. Brey (1981) показал, что ИМТ достоверно ниже у КМНС, проживающих в селе, – 22,4 (21,62–23,76) в сравнении с группой КМНС, проживающих в городе, – 25,4 (23,91–26,57) и у «пришлого» населения – 26,2 (25,20–26,87). Следует отметить, что избыточная масса тела превалировала в группе «пришлого» населения и встречалась у 57,4% (35) обследуемых женщин (χ2 23,995; df 2, р<0,001) (табл. 1).
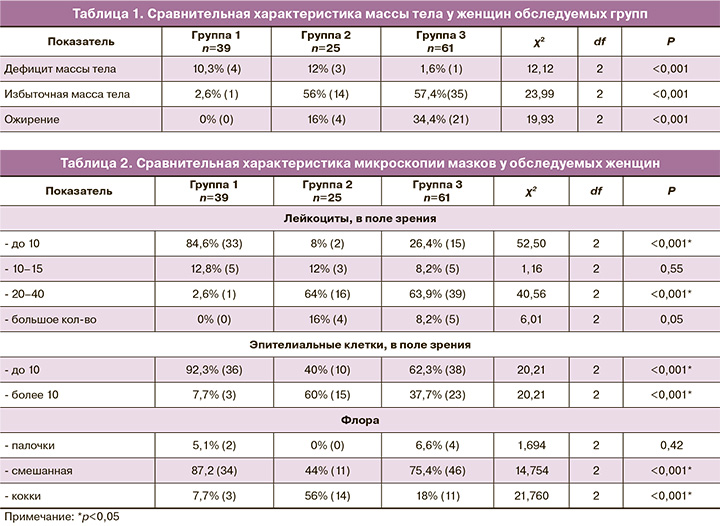
При анализе жалоб необходимо отметить, что в группе 1 лишь 5,1% (2) женщин жаловались на выделения из половых путей, однако в группах 2 и 3 более половины женщин предъявляли жалобы на зуд и патологические выделения из половых путей – 72% (18) и 67,2% (41) соответственно.
При микроскопии мазков лейкоцитоз был определен в 51,2% (в 64 образцах из 125). Из них в группе КМНС, проживающих в селе и на стойбищах, лейкоцитоз был выявлен у 2,6% (1) женщин, что имело отличие от группы КМНС, проживающих в городе, где у каждой четвертой пациентки – 80% (20) и у более половины «пришлого» населения – 72,1% (44) определялся «воспалительный» тип мазка (χ2 55,94; df 2; р<0,001). Количество эпителиальных клеток в группе КМНС, проживающих в селах, варьировало от 10,3 (6,7–19,5), в группе КМНС, проживающих в городе, –13,1 (5,4–23,1) и у «пришлого» населения – 9,8 (6,2–20,8). При этом смешанная микрофлора статистически значимо превалировала в группе КМНС, проживающих в селе, – у 87,2% (34) в сравнении с КМНС, проживающими в городе, – у 44% (11) и у 2/3 «пришлого» населения – 75,4% (46) (χ2 14,75; df 2; р<0,001). Кокковая микрофлора в мазках вагинального отделяемого чаще встречалась в группе КМНС, проживающих в городе, – у 56% (14) в отличие от «пришлого» населения – у 18% (11) и КМНС в селе – у 7,7% (3) (χ2 21,76; df 2; р<0,001) (табл. 2).
У всех женщин обследуемых групп исследовали микробиоту влагалища и кишечника методом ПЦР в режиме реального времени.
При анализе данных было выявлено, что во всех обследуемых группах отмечалось снижение Lactobacillus spp. <107. На этом фоне отмечался рост как факультативно-анаэробных, облигатно-анаэробных микроорганизмов, так и дрожжеподобных грибов, Mycoplasma genitalium.
У КМНС, проживающих на стойбищах и в селе, отмечался рост таких микроорганизмов, как Gardnerella vaginalis – у 12,8% (5), Clostridium spp. – у 10,3% (4), Eubacterium spp. – у 12,8% (5), Candida spp. – у 7,7% (3) в сравнении с группой КМНС, проживающих в городе, Gardnerella vaginalis в титре более 105 была определена у 48% (12), Clostridium spp. – у 16% (4), Eubacterium spp. – у 24% (6), Candida spp. – у 44% (11) женщин. У «пришлых» женщин Gardnerella vaginalis в титре более 105 была определена у 49,2% (30), Clostridium spp. – у 19,7% (12), Eubacterium spp. – у 59% (36), Candida spp. – у 9,8% (6). Следует отметить, что рост Eubacterium spp. превалировал у «пришлого» населения (χ2 8,96; df 2; р=0,01), Candida spp. встречалась чаще у КМНС в городе (χ2 18,31; df 2; р<0,001). По результатам «Фемофлор» такие микроорганизмы, как Mobiluncus spp. у 34,4% (21) и Fusobacterium spp. у 21,3% (13), определялись только в группе «пришлого» населения. Mycoplasma genitalium в титре более 103 чаще встречалась у КМНС, проживающих в городе, – у 16% (4) в сравнении среди «пришлых» женщин – у 8,2% (5) (χ2 6,01; df 2; р=0,05) (табл. 3).
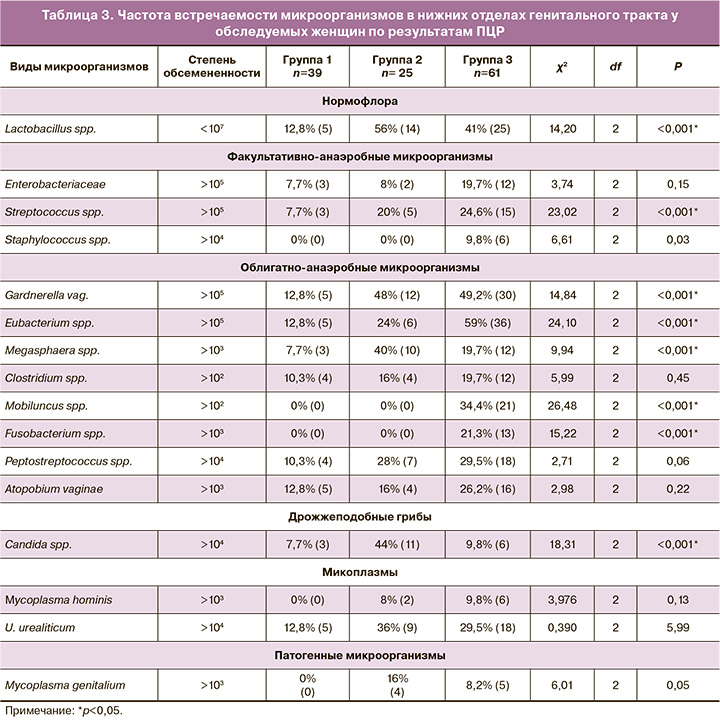
Анализ результатов исследования кишечной микрофлоры методом ПЦР в реальном времени показал, что у большинства обследуемых женщин отмечалось снижение количества Bifidobacterium spp. <109 и Lactobacillus spp. <107. У КМНС, проживающих в селе и на стойбище, отмечался рост условно-патогенной микрофлоры Enterococcus spp. – у 12,8% (5), Klebsiella oxytoca – у 7,7% (3) в сравнении с КМНС и «пришлым» населением, проживающим в городе, у которых данные микроорганизмы находились в пределах нормы. В группе КМНС в городе Candida spp. встречалась у 28% (7) в отличие от КМНС в селе – у 2,6% (1) и у «пришлого» населения – у 4,9% (3) (χ2 14,51; df 2; р<0,001) (табл. 4).
Вульвовагинальный кандидоз значимо чаще встречался у женщин из числа КМНС, проживающих в городе, – у 20% (4), в отличие от жительниц села и стойбищ – у 2,6% (1) и «пришлого» населения – у 3,3% (2).
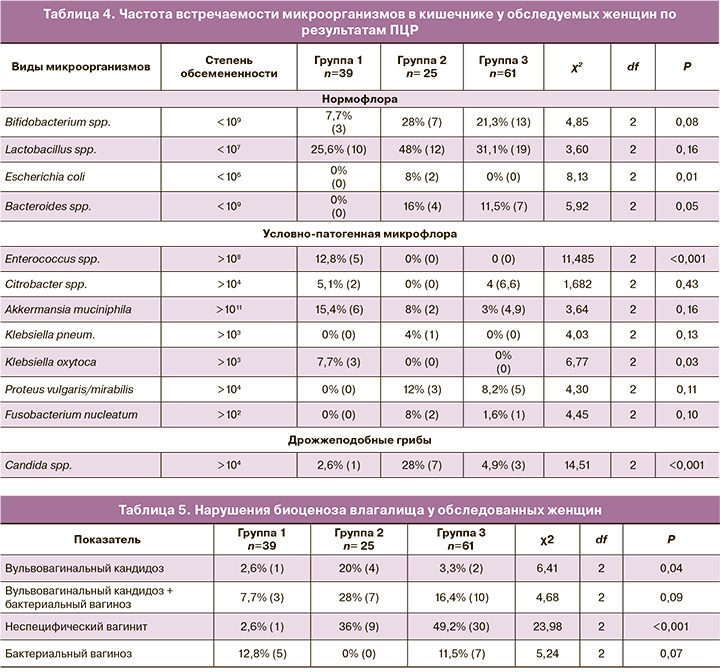
Неспецифический вагинит был установлен у половины пациенток из числа «пришлого» населения – у 49,2% (30) и у 36% (9) среди ханты и манси, проживающих в городе, в сравнении с КМНС в селе и стойбищах воспалительные изменения регистрировались крайне редко – у 2,6% (1). Невоспалительные изменения во влагалище – бактериальный вагиноз – встречались чаще у жительниц села (КМНС) – у 12,8% (5) в сравнении с «пришлым» населением – у 11,5% (7) и не встречался у ханты и манси, проживающих в городе. Сочетание вульвовагинального кандидоза и дисбиоза влагалища было диагностировано у каждой третьей женщины КМНС, проживающей в городе, – 28% (7), среди «пришлых» женщин – у 16,4% (10), среди КМНС, проживающих в селе и на стойбищах, – у 7,7% (3) (табл. 5).
Все женщины с нарушенным биоценозом кишечника были консультированы гастроэнтерологом и в дополнение к терапии бактериального вагиноза, неспецифического вульвовагинита или вульвовагинального кандидоза получили соответствующее лечение. Двадцати женщинам с бактериальным вагинозом и вульвовагинальным кандидозом был назначен «Клиндацин Б пролонг» по 1 аппликатору (5 г крема, содержащего 100 мг клиндамицина +100 мг бутоконазола нитрата). На втором этапе пациенткам назначались лактобактерии интравагинально в составе официнальных лекарственных форм. Контрольный осмотр через 4–6 недель выявил отсутствие жалоб, нормальные показатели (лейкоциты не более 10 в п/зр, эпителий 8–10–12 в п/зр, отсутствие Candida) в мазках вагинального отделяемого и содержание Lactobacillus spp. более 107 по данным ПЦР в реальном времени.
Обсуждение
Результаты исследования показали, что наименьшее количество отклонений в состоянии здоровья было у женщин из числа КМНС, проживающих в селе и на стойбищах, ведущих традиционный кочевой образ жизни. Дефицит массы тела наблюдался у 10,3%, у 2,6% пациенток была избыточная масса тела. Женщин с ожирением в данной группе выявлено не было. Анализ микробиоты влагалищного отделяемого показал, что у большинства женщин был нормоценоз – 87,2%, бактериальный вагиноз – у 12,3%, вульвовагинальный кандидоз – у 7,7%, вагинальный кандидоз и неспецифический вагинит – у 2,6% пациенток. В микробиоте кишечника не было выявлено существенных сдвигов в соотношении Bacteroides fragilis group и Faecalibacterium prausnitzii. Было также зарегистрировано значительное разнообразие кишечной флоры, характерное для жителей сельской местности в РФ [17]. По данным ряда авторов, это тормозит воспаление, снижает уровень оксидативного стресса и препятствует метаболическим нарушениям – ожирению [18], иммунным и воспалительным заболеваниям [19], а также репродуктивным нарушениям [20].
У более чем половины женщин из числа КМНС (56%), которые в первом или втором поколении мигрировали в город, наблюдалась избыточная масса тела, диагноз «ожирение» отмечался у 16% и дефицит массы тела – у 12%. Анализ состояния микробиоты влагалища показал, что лишь у 8% женщин был нормоценоз. У каждой третьей пациентки были выявлены воспалительные изменения во влагалище: неспецифический вагинит встречался у 36%, вульвовагинальный кандидоз – у 20%. Смешанная патогенная флора (бактериальный вагиноз и вульвовагинальный кандидоз) были у 28% женщин. Также часто обнаруживались дисбиотические нарушения кишечника – у 48% женщин были снижено содержание Lactobacillus, у 28% – Bifidobacterium, у 16% – Bacteroides и у 28% женщин было отмечено увеличение содержания грибов рода Candida. Микрофлора толстой кишки регулирует воспалительные процессы в организме и влияет на развитие метаболических нарушений. Некоторые представители патогенной кишечной флоры аккумулируют больше энергии из пищи, приводя к накоплению жира. Кишечная флора также регулирует синтез холестерина и триглицеридов, окисление жирных кислот в митохондриях, продукцию кетонов, поглощение глюкозы, производство инсулина и чувствительность тканей к нему. Эти процессы способствуют развитию метаболических нарушений и ожирения [21].
Ряд исследований свидетельствует также о транслокации микроорганизмов из одного биотопа в другой как в норме [22], так и при воспалительных заболеваниях нижнего отдела урогенитального тракта [23, 24].
Среди женщин из числа «пришлого» населения у 57,4% была выявлена избыточная масса тела, у 34,4% – ожирение. При оценке микробиоты влагалища нормоценоз был выявлен у 11,5% женщин. У 49,2% встречался неспецифический вагинит, бактериальный вагиноз был у 11,5%, вульвовагинальный кандидоз – у 3,3%, сочетание бактериального вагиноза и вульвовагинального кандидоза – у 16,4% пациенток. Анализ микробиоты кишечника показал дисбиотические нарушения, которые возникали на фоне снижения количества Lactobacillus, у 31,1%, Bifidobacterium – у 21,3%, Bacteroides – у 11,5% и увеличение содержания дрожжеподобных грибов Candida – у 4,9% пациенток.
У женщин из числа КМНС, проживающих в городе, и у «пришлого» населения было выявлено снижение Bacteroides, отвечающих за регуляцию местного иммунитета, что нередко наблюдается при воспалительных заболеваниях кишечника. Также была выявлена Fusobacterium nucleatum, появление данного микроорганизма является неблагоприятным прогностическим фактором в отношении развития злокачественных новообразований кишечника [25].
Таким образом, жительницы города – как «пришлые», так и из числа КМНС – имели наибольшее количество нарушений в состоянии биоценоза влагалища и толстого кишечника.
Полученные нами результаты применения «Клиндацин Б пролонг» у беременных женщин с привычным невынашиванием [26], у небеременных женщин из числа КМНС и «пришлого» населения позволяют рекомендовать с целью лечения как невоспалительных изменений во влагалище (бактериального вагиноза), так и неспецифического вагинита антибиотик широкого действия – клиндамицин (клиндамицина фосфат). Это антибактериальный препарат с широким спектром действия из группы линкозамидов. Клиндамицин нарушает внутриклеточный синтез белка в микробной клетке на уровне 50S-субъединицы рибосом. В отношении ряда грамположительных кокков возможно бактерицидное действие. Активен в отношении Staphylococcus spp. (в т.ч. Staphylococcus epidermidis, продуцирующих и не продуцирующих пенициллиназу), Streptococcus spp. (исключая Enterococcus faecalis), Streptococcus pneumoniae, Mycoplasma spp., анаэробных и микроаэрофильных грамположительных кокков (включая Peptococcus spp. и Peptostreptococcus spp.), Bacteroides spp. и др.
Нередко бактериальный вагиноз и аэробный вагинит сочетаются с ростом грибов рода Candida. Бутоконазол – производное имидазола, обладает фунгицидной активностью в отношении грибов родов Candida и некоторых грамположительных бактерий. Наиболее эффективен при кандидозах. Блокируя в клеточной мембране образование эргостерола из ланостерола, увеличивает проницаемость мембраны, что приводит к лизису клетки гриба. Сочетание клиндамицина и бутоконазола используют при бактериальном вагинозе и аэробном вагините.
Эффективность обоих компонентов препарата «Клиндацин Б пролонг» имеет большую доказательную базу. Препарат может быть использован как у беременных, так и небеременных женщин. Важное свойство препарата: гидрофильная кремовая основа обеспечивает ему гелеобразную консистенцию при температуре 35–40°С. При интравагинальном применении крем не плавится, и активные вещества находятся на слизистой оболочке влагалища в течение 1–3 дней. Таким образом, обеспечиваются его высокая биоадгезивность и пролонгированный характер действия, что важно для эффективности интравагинальных форм антимикробных препаратов. Выпускается в виде вагинального крема в тубе по 20 г в комплекте с 3 одноразовыми аппликаторами; курс лечения бактериальных, грибковых и смешанных вагинитов – ежедневно в течение 3 дней. Большинство исследователей как в РФ, так и в других странах подтвердили, что клиндамицин, назначаемый для местной терапии, был эффективен как для клинического выздоровления (эрадикация симптомов бактериального вагиноза), так и изменения микрофлоры влагалища в сторону физиологической нормы (снижение количества ассоциированных с бактериальным вагинозом бактерий и увеличение количества лактобацилл) [27, 28].
Заключение
Результаты проведенного исследования позволяют сделать вывод, что у КМНС, мигрирующих в город, и «пришлого» населения имеет место изменение качественного и количественного состава микрофлоры кишечника и влагалища, что может сопровождаться возникновением условий для роста и реализации патогенных свойств транзиторной микрофлоры, приводя к метаболическим нарушениям и к нарушениям в репродуктивной системе. «Клиндацин Б пролонг» может быть рекомендован для широкого использования с целью лечения бактериального вагиноза и аэробного вагинита в сочетании с кандидозом у женщин репродуктивного возраста.



