Идиопатический привычный выкидыш – акушерское осложнение, занимающее в структуре невынашивания от 5 до 20% случаев. Этиологию его на настоящий момент связывают с нарушениями функционирования материнской иммунной системы, развивающей неадекватный ответ на отцовские антигены плода, то есть с аллоиммунными причинами [1]. Такой диагноз ставится при исключении генетических, анатомических, гормональных, инфекционных, аутоиммунных факторов привычных потерь беременности. По данным зарубежных авторов, шанс доносить беременность без терапии после трех выкидышей, обусловленных аллоиммунными механизмами, составляет 30%, после четырех – 25%, после пяти – 5% [2, 3], и вероятность иммунологических нарушений в генезе привычного выкидыша растет с увеличением числа потерь беременностей [4].
Поэтому в настоящее время при постановке диагноза идиопатического привычного выкидыша требуется последующее иммунологическое обследование, оптимизация подготовки к беременности и комплексная терапия в ранние сроки беременности для ее пролонгирования с помощью иммунокорригирующей терапии [5]. Одним из вариантов такой терапии является иммуноцитотерапия (ИЦТ) – иммунизация женщин аллогенными лимфоцитами партнеров (аллоиммунизация). Считается, что использование ИЦТ способствует коррекции ответа иммунной системы женщины на аллоантигены полового партнера и формированию толерантности, сопровождающей нормальное течение беременности.
В формировании толерантности при беременности участвуют практически все типы иммунокомпетентых клеток. Существуют доказательства того, что субпопуляционный состав и активационное состояние клеток периферической крови беременных отражает состав и активационное состояние клеток маточно-плацентарного «интерфейса» [6]. Поэтому исследование особенностей субпопуляционного состава крови женщин во время беременности является актуальным в поиске показателей, значимых для диагностики акушерских осложнений. Исследование соотношений между основными субпопуляциями лимфоцитов (NК-клетками, В- и Т-лимфоцитами) у пациенток с идиопатическим привычным выкидышем в период предгестационной подготовки и в первом триместре беременности очень важны для поиска клинико-лабораторных критериев назначения иммунокорригирующей терапии, а также для понимания механизмов ее иммуномодулирующего действия.
Целью настоящей работы стал ретроспективный анализ особенностей субпопуляционного состава лимфоцитов периферической крови пациенток с идиопатическим привычным выкидышем с разными исходами беременности, наступившей на фоне аллоиммунизации лимфоцитами партнера.
Материал и методы исследования
Основную группу исследования составили 36 беременных с идиопатическим привычным выкидышем (две и более потери беременности от одного партнера, произошедшими в первом триместре беременности, с подтвержденным нормальным кариотипом плода), из которых у 30 пациенток беременность была пролонгирована до доношенного срока и завершилась рождением ребенка, а у 6 пациенток произошло самопроизвольное прерывание беременности в первом триместре.
Критериями включения женщин в исследование были: подписание формы информированного согласия на участие в исследовании, возраст женщин от 20 до 40 лет, самопроизвольное наступление беременностей, нормальный кариотип обоих партнеров, нормозооспермия у партнера, отсутствие анатомических, генетически обусловленных, аутоиммунных, гормональных нарушений, препятствующих наступлению и вынашиванию беременности, отсутствие тяжелых экстрагенитальных заболеваний. Все пациентки с привычным выкидышем прошли предгестационную подготовку, включающую аллоиммунизацию лимфоцитами полового партнера дважды с интервалом в один месяц на 5–9-й день менструального цикла. При этом пациенткам внутрикожно вводили 50 млн клеток в ладонную поверхность предплечья в 10–12 точек. В первом триместре беременности аллоиммунизацию проводили в сроке 5–6 недель и 8–9 недель беременности.
Кровь для анализа вне беременности забирали натощак из локтевой вены до иммунизации и после каждого введения клеток на 18–22-й день менструального цикла, у беременных – до иммунизации в 5–6 недель, в 8–9 недель и 12 недель гестации после введения клеток.
Поверхностный фенотип клеток периферической крови определяли с помощью стандартного набора моноклональных антител (мАт), меченных флуоресцеин-изотиоцианатом (ФИТЦ) или фикоэритрином (ФЭ), против антигенов CD3(ФИТЦ), CD4(ФЭ), CD5(ФИТЦ), CD8(ФЭ), CD16(ФЭ), CD19(ФЭ), CD56(ФЭ), CD200(ФЭ) (Becton Dickinson и eBioscience, США). Оценивали содержание основных субпопуляций иммунокомпетентных T-клеток (СD3+, CD4+, CD8+), В-клеток (CD19+), B1-клеток (CD19+CD5+), NK-клеток (СD56+, СD16+), а также оценивали содержание Трег как субпопуляцию с фенотипом СD4+CD25highCD127low/-. Лимфоцитарный гейт, позволяющий исключить из анализа другие клетки крови, выявляли с помощью мАт к СD45, меченных перидинин-хлорофилл протеином (Per-CP) (Dako, Дания). Для оценки позитивно окрашенных субпопуляций использовали соответствующие ФИТЦ или ФЭ-меченые изотипические IgG. Для оценки процентного содержания Трег использовали набор, содержащий моноклональные антитела к антигенам CD4, меченые Per-CP (eBioscience, США), CD25, меченые ФИТЦ (Becton Dickinson, США) и СD127, меченые ФЭ (eBioscience, США). Оценивали долю Трег среди CD4+-клеток. Моноклональные антитела добавляли непосредственно к цельной крови, затем лизировали с помощью раствора FACS Lysing Solution (Becton Dickinson, США). Анализ проводили с использованием проточного цитофлуориметра FACSСalibur (Becton Dickinson, США) с использованием программы CellQuest.
Статистическую обработку данных производили общепринятыми методами вариационной статистики. Данные представлены как среднее ± ошибка среднего. Соответствие расчетных выборок показателей нормальному распределению оценивали с помощью критерия Колмогорова–Смирнова с использованием пакета Statistica 6 для Windows XP.
Значимость наблюдаемых отклонений средних значений измеренных параметров оценивали с помощью двухвыборочного t-критерия Стьюдента с различными дисперсиями для средних значений с использованием пакета статистического анализа для Microsoft Office Excel 2007. Для оценки диагностической значимости тестов фенотипирования лимфоцитов периферической крови женщин с привычным беременности выкидышем использовали ROC-анализ пакета MedCalc12 для Windows 7.
Результаты исследования
Ретроспективный анализ субпопуляционного состава лимфоцитов проводили как до назначения аллоиммунизации в предгестационной подготовке, так и на фоне предгестационной аллоиммунизации и последующей беременности, а именно: до срока 12 недель у женщин с беременностью, завершившейся рождением живого ребенка (n=30), и до срока 5–6 недель у женщин с выкидышем (n=6).
В результате проведенного анализа обнаружено, что до назначения аллоиммунизации в предгестационной подготовке пациентки с пролонгированной беременностью и с выкидышем не отличались по содержанию Трег-клеток, CD200+, CD19+ и B1-клеток с фенотипом CD19+CD5+, однако содержание клеток с естественной киллерной активностью у пациенток с выкидышем оказалось значимо ниже. Динамика указанных субпопуляций лимфоцитов в процессе наблюдения от назначения аллоиммунизации до конца I триместра отражена на рис. 1 и 2.
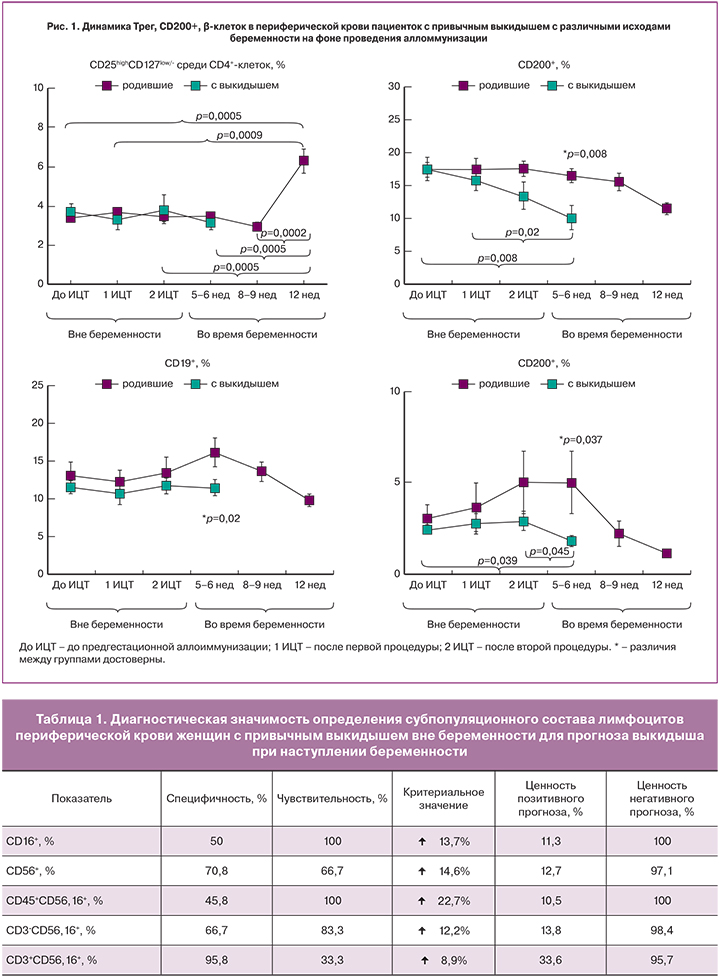
Как следует из рис. 1, в динамике Трег клеток до 5–6 недель гестации различий между группами не обнаружено. Рост количества Трег зарегистрирован только в 12 недель пролонгированной беременности (р=0,0002 по сравнению с содержанием в 8–9 недель), при этом содержание Трег выросло по сравнению с уровнем до предгестационной аллоиммунизации (р=0,0005).
В 5–6 недель беременности у пациенток с выкидышем, в отличие от пациенток с пролонгированной беременностью, содержание CD200+, B1 (CD5+CD19+) и B2 (CD5-CD19+) клеток стало значимо ниже не только между группами, но и по сравнению со значениями до назначения лечения.
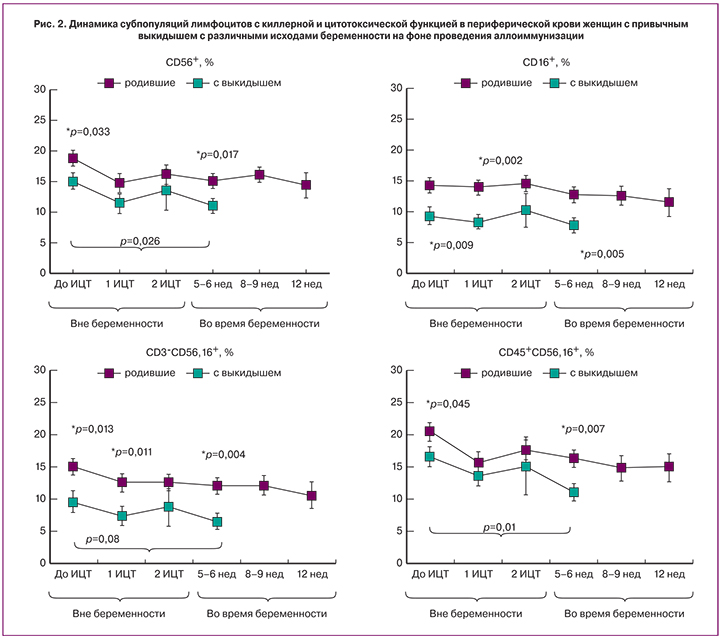
Динамика субпопуляций клеток с естественной киллерной активностью (CD56+, CD16+, CD56,16+, CD3-CD56,16+, CD3-CD16+), а также субпопуляции с цитотоксической активностью CD3-CD8+ и NKT-клеток (с фенотипом CD3+CD16+ и CD3+CD56,16+) у пациенток с разными исходами беременности представлена на рис. 2.
Как следует из рис. 2, уже до предгестационной подготовки содержание субпопуляций с киллерной активностью у женщин с выкидышем было ниже, чем у женщин с пролонгированной беременностью. В 5–6 недель гестации у женщин с выкидышем содержание субпопуляций CD56+, CD56,16+, CD3+CD56,16+, CD3-CD56,16+-лимфоцитов было значимо низким не только по сравнению с содержанием у пациенток с пролонгированной беременностью, но и по сравнению с исходными значениями.
При отсутствии различий между группами в содержании цитотоксических лимфоцитов с фенотипом CD3-CD8+ до начала лечения, в 5–6 недель гестации у пациенток с выкидышем содержание этой субпопуляции также стало ниже, чем у женщин с пролонгированной беременностью.
Различий в содержании NKT-лимфоцитов между двумя группами пациенток с привычным выкидышем до назначения лечения и в динамике наблюдения не обнаружено. Тем не менее, в группе пациенток с выкидышем показано значимое снижение в 5–6 недель гестации содержания лимфоцитов с фенотипом CD3+CD56,16+ по сравнению с исходными значениями (р=0,013), но при этом достигнутый уровень не отличался от содержания указанной субпопуляции в группе пациенток с пролонгированной беременностью.
Таким образом, в 5–6 недель беременности, наступившей после предгестационной аллоиммунизации, у пациенток с выкидышем регистрировали сниженное содержание NК-клеток, CD200+- и В-клеток по сравнению со значениями у пациенток с пролонгированной беременностью.

Для показателей, измеренных до наступления беременности и значимо различающихся между анализируемыми группами пациенток с привычным выкидышем, рассчитаны характеристики диагностической значимости для прогноза потери беременности (табл. 1).
Из данных табл. 1 следует, что вне беременности содержание в периферической крови пациенток с привычным выкидышем субпопуляций CD16+, CD56+, CD45+CD56,16+, CD3-CD56,16+, CD3+CD56,16+ ниже критериальных значений практически со 100% вероятностью позволяет прогнозировать выкидыш. Следовательно, для этой группы пациентов могут быть рекомендованы альтернативные методы иммунокорригирующей терапии вне беременности.
В табл. 2 представлены характеристики диагностической значимости определения субпопуляций с киллерной активностью, В-клеток и CD200+-клеток для прогноза выкидыша у пациенток с привычным выкидышем в 5–6 недель беременности, наступившей после предгестационной аллоиммунизации.
Как следует из данных табл. 2, лучшими характеристиками чувствительности, специфичности для прогноза потери беременности в I триместре обладают тесты определения содержания CD3-CD16+, CD56+, CD45+CD56,16+-клеток. Показано, что у пациенток с привычным выкидышем после аллоиммунизации в предгестационной подготовке, в 5–6 недель беременности при содержании указанных субпопуляций ниже критериальных значений со 100% вероятностью можно прогнозировать потерю беременности.
Обсуждение
Считается установленным, что субпопуляционный состав лимфоцитов периферической крови пациенток с идиопатическим привычным выкидышем имеет особенности, связанные с увеличенным содержанием субпопуляций с киллерной активностью и низким содержанием Трег-клеток [7, 8]. Ранее было показано, что вне беременности для пациенток с идиопатическим привычным выкидышем характерно превалирование субпопуляций с киллерной (CD56+, CD3-CD56,16+) и цитотоксической направленностью (CD3-CD8+, CD3+CD56,16+), CD200+- и В-клеток и низкое содержание Трег клеток [9, 10]. Указанные особенности сохранились и после аллоиммунизации вне беременности [11].
Также ранее было показано, что на фоне двух процедур аллоиммунизации у пациенток с беременностью, завершившейся рождением жизнеспособного ребенка, в I триместре при отсутствии динамики в содержании субпопуляций с киллерной активностью была обнаружена динамика в содержании субпопуляций Трег-, CD200+-клеток, В-клеток.
В результате в 12 недель гестации содержание Трег-, CD200+-клеток, В-клеток не отличалось от содержания в 12 недель у женщин с физиологическим течением беременности [12]. Однако при этом содержание NK-клеток (CD56+, CD3-CD56,16+, CD3-CD16+) также оказалось равным содержанию у женщин с физиологическим течением беременности. К сожалению, не удалось показать динамики субпопуляционного состава лимфоцитов в I триместре нормальной беременности. Тем не менее, представленные данные согласуются с данными других исследователей об увеличении содержания клеток с натуральной киллерной активностью в ранние сроки и в первом триместре физиологической беременности [13–15].
С одной стороны, изложенные результаты подтверждают выводы, полученные в экспериментах на модельных животных, что за развитие Трег, влияющих на формирование толерантности во время беременности, ответственны аллоантигены, которые экспрессируются именно во время беременности [16, 17].
С другой стороны, нормализации субпопуляционного состава могли способствовать процессы синтеза гормонов и белков ранней беременности. Например, события, происходящие сразу после имплантации, служат мощным эндогенным стимулом для увеличения секреции ПИБФ (прогестерон-индуцированного блокирующего фактора) – медиатора с антиабортивной активностью, который синтезируется активированными лимфоцитами периферической крови и децидуальными CD56+-клетками [18–20] и который способствует как переключению профиля цитокиновой продукции активированными лимфоцитами с Th1-направленности на Th2 [19, 21], так и стимулирует продукцию В-лимфоцитами характерных для беременности асимметричных антител с измененной структурой [19, 22]. Увеличению экспрессии рецепторов к прогестерону, а следовательно, и увеличению синтеза ПИБФ способствует экзогенный стимул, например, переливание крови [23, 24]. Не исключено, что аллоиммунизация пациенток с привычным выкидышем также является таким экзогенным стимулом.
Однако у 6 (16,7%) пациенток с привычным выкидышем аллоиммунизация во время беременности оказалась неэффективной. Ретроспективный анализ был предпринят с целью выявления различий в иммунологических показателях у этой категории пациенток по сравнению с показателями женщин, доносивших беременность на фоне аллоиммунизации.
Обнаружено, что в группе пациенток, потерявших данную беременность, содержание клеток с естественной киллерной активностью оказалось значимо ниже по сравнению с содержанием у пациенток с пролонгированной беременностью уже до назначения ИЦТ вне беременности, а в 5–6 недель беременности было значимо ниже и по сравнению с исходными значениями. Также в 5–6 недель гестации у пациенток с выкидышем стало значимо ниже содержание лимфоцитов с цитотоксической активностью (CD3-8+-клеток), В- и CD200+ – лимфоцитов.
Полученный результат подтверждает необходимость провоспалительного состояния иммунной системы женщины в ранние сроки гестации для успешного пролонгирования беременности.
Таким образом, выявление еще до наступления беременности сниженного уровня субпопуляций лимфоцитов с киллерной функцией позволяет прогнозировать ее потерю в первом триместре (табл. 1). Такая зависимость между низким содержанием киллерных субпопуляций и вероятностью потери беременности в первом триместре сохраняется также и в 5–6 недель беременности, наступившей после предгестационной аллоиммунизации. Более того, спектр субпопуляций, оценка которых в 5–6 недель беременности обладает высокой прогностической значимостью, расширяется и включает в себя субпопуляцию с цитотоксической активностью CD3-8+, В-клетки и CD200+-клетки (табл. 2).
Полученные данные позволяют формировать персонифицированный подход к выбору различных видов предгестационной иммуномодулирующей терапии, определяемый особенностями клеточного звена иммунитета пациенток с привычным выкидышем.
Заключение
Проведен ретроспективный анализ субпопуляционного состава лимфоцитов периферической крови пациенток с идиопатическим привычным выкидышем, потерявших беременность, и с пролонгированной беременностью, завершившейся рождением ребенка. Показано, что уже до назначения предгестационной аллоиммунизации у пациенток, потерявших беременность, содержание в периферической крови субпопуляций с киллерной активностью: CD56+, CD16+, CD45+CD56,16+, CD3-CD56,16+, CD3+CD56,16+ было достоверно ниже. Содержание субпопуляций CD3-CD16+, CD56+, CD45+CD56,16+-лимфоцитов в 5–6 недель беременности ниже порогового уровня с высокой диагностической значимостью прогнозирует ее потерю. Полученный результат подтверждает необходимость провоспалительного состояния иммунной системы женщины в ранние сроки гестации для успешного пролонгирования беременности и позволяет формировать подходы к выбору иммуномодулирующей терапии для пациенток с идиопатическим привычным выкидышем вне беременности.



