 В структуре гинекологической заболеваемости женщин постменопаузального возраста преобладают патологические процессы в эндометрии (ППЭ), которые включают в себя, в том числе, и злокачественные новообразования [1, 2].
В структуре гинекологической заболеваемости женщин постменопаузального возраста преобладают патологические процессы в эндометрии (ППЭ), которые включают в себя, в том числе, и злокачественные новообразования [1, 2].
Достаточно глубоко изучены гормональные, воспалительные, генетические механизмы развития ППЭ, роль процессов апоптоза и нарушений тканевой рецепции [3–10]. Однако, несмотря на большое количество исследований отечественных и зарубежных авторов, посвященных ППЭ, до настоящего времени этиология и патогенез данных процессов недостаточно ясны [11]. Учитывая длительное бессимптомное течение и высокий риск озлокачествления ППЭ у пациентов старших возрастных групп, остро стоит вопрос ранней диагностики и поиск скрининговых методов обследования [12]. Ведущим методом лучевой диагностики органов репродуктивной системы, в том числе эндометрия, признана ультрасонография [13, 14]. Но «золотым стандартом» верификации диагноза остается гистероскопия с биопсией эндометрия и последующим патоморфологическим исследованием полученного материала [5, 15–17]. В последние годы авторитетные американские и европейские общества акушеров-гинекологов (AAGL, ESGE, SCOG) указывают на отсутствие необходимости в скрининговом ультразвуковом исследовании в постменопаузальном периоде, так как выявлен высокий процент ложноположительных результатов и низкая положительная прогностическая ценность, что, как следствие, ведет к неоправданным инвазивным вмешательствам у «бессимптомных» пациенток пожилого возраста. Считается, что злокачественные новообразования эндометрия достаточно рано манифестируют анормальными маточными кровотечениями и это служит показанием для проведения гистероскопии и кюретажа полости матки [12, 18–20]. Таким образом, данный вопрос до настоящего времени остается дискутабельным.
 Целью исследования стало изучение патогенетических аспектов ППЭ у женщин пожилого и старческого возраста на основании исследования экспрессии молекулярно-биологических маркеров в железисто-фиброзных полипах эндометрия (ЖФПЭ) для оптимизации тактики ведения пациенток старших возрастных групп.
Целью исследования стало изучение патогенетических аспектов ППЭ у женщин пожилого и старческого возраста на основании исследования экспрессии молекулярно-биологических маркеров в железисто-фиброзных полипах эндометрия (ЖФПЭ) для оптимизации тактики ведения пациенток старших возрастных групп.
Материал и методы исследования
Обследованы 288 пациенток, поступивших в гинекологическое отделение ФГБУ «Клиническая больница» c подозрением на патологический процесс в эндометрии по результатам ультразвукового скрининга при отсутствии жалоб со стороны органов репродуктивной системы. Возраст пациенток колебался от 60 до 87 лет (средний возраст 67,6±5,56 года). Изучение анамнестических данных основывалось на анализе особенностей менструальной и репродуктивной функций (сроки наступления менархе и постменопаузы, начало половой жизни, число беременностей и их исход), перенесенных и сопутствующих гинекологических и экстрагенитальных заболеваний в различные периоды жизни. Полученные результаты соответствовали среднестатистическим значениям. Сроки наступления менопаузы варьировали от 38 до 56 лет, в среднем 44,9±6,8 года.
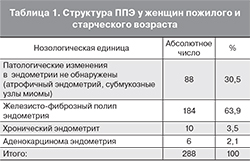
 Всем пациенткам выполнено раздельное диагностическое выскабливание с предварительной диагностической гистероскопией. Гистероскопическая картина полости матки характеризовалась наличием полипов различной величины и локализации, неоднородным локальным утолщением эндометрия, наличием субмукозных или интерстициально-субмукозных узлов миомы, синехий в полости матки, признаков атрофии эндометрия и хронического эндометрита. При гистологическом исследовании патологические изменения эндометрия были обнаружены у 200 из 288 пациенток (70,7%). Еще у 72 женщин из 288 (25,0%) гистологически была выявлена лишь атрофия эндометрия, а у 16 (5,5%) – субмукозные миомы матки. Структура изменений эндометрия представлена в табл. 1.
Всем пациенткам выполнено раздельное диагностическое выскабливание с предварительной диагностической гистероскопией. Гистероскопическая картина полости матки характеризовалась наличием полипов различной величины и локализации, неоднородным локальным утолщением эндометрия, наличием субмукозных или интерстициально-субмукозных узлов миомы, синехий в полости матки, признаков атрофии эндометрия и хронического эндометрита. При гистологическом исследовании патологические изменения эндометрия были обнаружены у 200 из 288 пациенток (70,7%). Еще у 72 женщин из 288 (25,0%) гистологически была выявлена лишь атрофия эндометрия, а у 16 (5,5%) – субмукозные миомы матки. Структура изменений эндометрия представлена в табл. 1.
Таким образом, ЖФПЭ являются наиболее часто встречающимся ППЭ у пациенток пожилого и старческого возраста (63,9%) (рис. 1, 2, см. на вклейке).
Обращает на себя внимание высокий процент атрофических процессов эндометрия (25%), что обусловлено постменопаузальными изменениями, а также высокая частота его злокачественных новообразований (2,1%) в пожилом и старческом возрасте. Представляет интерес и отсутствие гиперплазии эндометрия в изученной группе наблюдений.
 В рамках исследования патогенетических аспектов внутриматочных изменений у пациенток старше 60 лет, иммуногистохимическим методом изучено 19 ЖФПЭ, из них у 9 – в период постменопаузы в возрасте 64–81 лет (основная группа) и у 10 – в репродуктивном возрасте (группа сравнения). Применяли иммунопероксидазный метод с использованием 6 первичных специфических моноклональных антител к рецепторам эстрогенов, прогестерона, маркеру пролиферативной активности белку Ki-67, ингибитору апоптоза bсl-2, индуктору апоптоза Вах и ферменту ароматазе цитохрома Р450 (АЦР450).
В рамках исследования патогенетических аспектов внутриматочных изменений у пациенток старше 60 лет, иммуногистохимическим методом изучено 19 ЖФПЭ, из них у 9 – в период постменопаузы в возрасте 64–81 лет (основная группа) и у 10 – в репродуктивном возрасте (группа сравнения). Применяли иммунопероксидазный метод с использованием 6 первичных специфических моноклональных антител к рецепторам эстрогенов, прогестерона, маркеру пролиферативной активности белку Ki-67, ингибитору апоптоза bсl-2, индуктору апоптоза Вах и ферменту ароматазе цитохрома Р450 (АЦР450).
Результаты
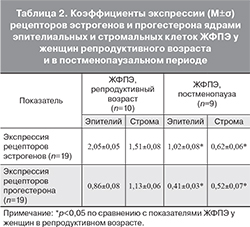
Результаты исследования показали, что у женщин в постменопаузальном периоде экспрессия как рецепторов эстрогенов, так и рецепторов прогестерона ядрами эпителиальных и стромальных клеток ЖФПЭ, статистически достоверно ниже (табл. 2, рис. 3–6, см. на вклейке).
Во всех изученных ЖФПЭ, независимо от возраста и периода жизни женщин, экспрессия маркера пролиферации в ядрах эпителия желез была сходной, и пролиферативная активность была значительно выражена в наблюдениях обеих групп. Однако, в отличие от ЖФПЭ в репродуктивном периоде, в полипах у женщин в постменопаузе экспрессия Ki-67 в ядрах стромальных клеток была более выражена (табл. 3, рис. 7, 8, см. на вклейке).
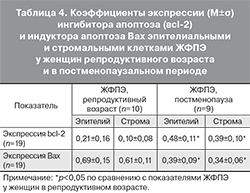
 По сравнению с ЖФПЭ в репродуктивном периоде, в полипах у женщин в постменопаузе экспрессия ингибитора апоптоза bcl-2 в эпителиальных и стромальных клетках более выражена, а экспрессия индуктора апоптоза, антигена Вах, наоборот, значительно подавлена (табл. 4, рис. 9–12, см. на вклейке).
По сравнению с ЖФПЭ в репродуктивном периоде, в полипах у женщин в постменопаузе экспрессия ингибитора апоптоза bcl-2 в эпителиальных и стромальных клетках более выражена, а экспрессия индуктора апоптоза, антигена Вах, наоборот, значительно подавлена (табл. 4, рис. 9–12, см. на вклейке).
Таким образом, процессы апоптоза в ЖФПЭ у женщин в постменопаузе значительно подавлены, что, с учетом сохраняющейся высокой пролиферативной активности их железистого и стромального компонентов, свидетельствует о повышенном риске малигнизации полипов эндометрия у пациенток старших возрастных групп.
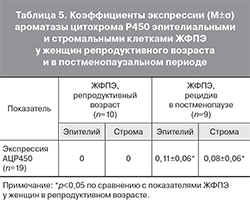
По сравнению с ЖФПЭ в репродуктивном периоде, в полипах у женщин в постменопаузе в разной степени, от минимальной до умеренной, выражена экспрессия АЦР450, в основном в эпителии желез. Это принципиальное отличие ЖФПЭ в постменопаузе, которое свидетельствует о локальном синтезе эстрогенов в таких полипах (табл. 5, рис. 13, 14, см. на вклейке), Как показало сравнительное иммуногистохимическое исследование экспрессии ряда молекулярно-биологических маркеров эпителиальными и стромальными клетками ЖФПЭ у женщин репродуктивного возраста и ЖФПЭ в постменопаузальном периоде, в полипах у пациенток в постменопаузе статистически достоверно ниже экспрессия рецепторов эстрогенов и прогестерона. Разница в экспрессии маркера пролиферации Ki-67 не выявлена (кроме ее повышения в стромальных клетках), но повышение экспрессии bcl-2 в сочетании со снижением экспрессии Вах свидетельствует о подавлении процессов апоптоза. Кроме того, появляется экспрессия АЦР450, что указывает на возможность локального повышения концентрации эстрогенов, усиливающих пролиферацию клеток. В условиях подавления апоптоза это повышает риск неопластической трансформации.
Заключение
Таким образом, обнаружены принципиальные молекулярно-биологические отличия ЖФПЭ у женщин в постменопаузе и в репродуктивном периоде, свидетельствующие о меньшей зависимости полипов от влияния эстрогенов и прогестерона и повышенном риске неопластической трансформации. Учитывая бессимптомное течение ППЭ и высокий риск малигнизации в пожилом и старческом возрасте, целесообразно скрининговое ультразвуковое исследование органов малого таза с целью ранней диагностики и своевременного лечения внутриматочных патологических изменений у пациенток старших возрастных групп.



