Ключевыми факторами успеха программы экстракорпорального оплодотворения (ЭКО) являются наличие эмбриона хорошего качества, эндометрия адекватной толщины и рецептивности, а также успешное их взаимодействие в период «окна имплантации» [1–4]. В настоящее время продолжает проводиться оценка фертильных возможностей женщин с так называемым «тонким» эндометрием, но нужно уточнить, что данное понятие не унифицировано. Разные ученые принимают во внимание не только лишь толщину эндометрия (ТЭ) меньше нижнего норматива к концу пролиферативной фазы менструального цикла (МЦ), но и значение ТЭ, при которой, по их данным, происходит достоверное падение частоты успешных имплантаций, и, соответственно, приводят различную частоту распространенности данного состояния. В литературе представлен ряд выраженно варьирующих данных о минимально необходимой ТЭ в период «окна имплантации» для успешного наступления беременности – от 5 до 8 мм [5–9]. Однако большинство исследователей на сегодня определяют ультразвуковые значения М-Эха 8–12 мм как оптимальные для нидации эмбриона [9–11].
Воспаление и ятрогения – наиболее распространенные факторы, воздействие которых на репродуктивную сферу может быть причиной «тонкого» эндометрия. Наиболее частой причиной функционально неполноценного эндометрия является хронический эндометрит (ХЭ) [12, 13].
У пациенток, проходящих лечение в программе ЭКО, ХЭ выявляется в половине случаев [3, 14].
Диагностика ХЭ в настоящее время основывается на ультразвуковых, гистероскопических, морфологических и иммуногистохимических данных [13, 15, 16].
Среди неинвазивных методов оценки ХЭ используется трансвагинальная ультрасонография, позволяющая оценивать ТЭ и эхогенность ткани. В настоящее время установлено, что ТЭ менее 7 мм в отсутствие его структурности на момент переноса бластоцисты является неоптимальной в протоколах ВРТ. Анализ гемодинамики сосудов матки с помощью цветного допплеровского картирования, так же, как и измерение ТЭ и ультразвуковая картина строения эндометрия (наличие или отсутствие трехслойной структуры), обладает прогностическим значением в отношении имплантации [5, 17]. В частности, при эхографической оценке маточного кровоснабжения особое внимание акцентируется на степени и симметрии васкуляризации миометрия, визуализации всех последовательных ветвей сосудистого дерева матки (маточных, аркуатных, радиальных, базальных, спиральных артерий), наличии как систолической, так и диастолической составляющей кровотока в исследуемых сосудах, уровнях показателей уголнезависимых индексов кривых скоростей кровотока: пульсационного индекса, индекса резистентности, систоло-диастолического соотношения [18, 19].
Скрининговая (офисная) гистероскопия позволяет уточнить наличие или отсутствие внутриматочных изменений, которые часто могут сопровождаться формированием «тонкого» эндометрия (признаки ХЭ, аномалии развития, перегородки, синехии) [13, 20, 21].
Золотым стандартом диагностики ХЭ являются морфологические критерии, которые включают наличие плазматических клеток и лимфоидных воспалительных инфильтратов, стромального фиброза, склероза стенок базальных артерий [22].
Материал для гистоморфологического исследования и верификации диагноза может быть получен при гистероскопии, сопровождающейся пайпель-биопсией эндометрия. При этом забор проводят в среднюю пролиферативную фазу – на 7–10-й день обычного 28-дневного МЦ.
В дополнение к морфологическим методам используются иммуногистохимические (ИГХ) методы. Наиболее значимыми для диагностики ХЭ являются увеличение числа моноцитов/макрофагов (CD14+) и NK-клеток (CD56+), а также появление плазматических клеток (CD138+) [23–25].
По данным отечественных и зарубежных авторов, основой патогенеза «тонкого» эндометрия при ХЭ является нарушение его созревания вследствие фиброзирования стромы и ухудшения васкуляризации, что с иммуноморфологической точки зрения проявляется очаговым склерозом стромы, уменьшением плотности расположения сосудов, снижением экспрессии многочисленных цитокинов, регулирующих процессы жизнеобеспечения клеток эндометрия, васкуло- и ангиогенез: лейкемия-ингибирующих факторов (Leukemia Inhibitory Factor – LIF), LIF-R, мембранного белка CD34, фактора роста эндотелия сосудов (Vascular Endothelial Growth Factor – VEGF), а также числа пиноподий на поверхности клеток слизистой матки. Все эти процессы интегрируются в понятие «остаточные явления ХЭ» [9, 13, 22, 25, 26].
В последнее десятилетие значительное внимание уделяется способам восстановления адекватной толщины и рецептивности слизистой оболочки матки у женщин с «тонким» эндометрием в результате его атрофии на фоне длительно протекающего ХЭ, приводящего к нарушению репродуктивной функции в виде инфертильности, многократных безуспешных попыток ЭКО из-за более низкой частоты имплантации, а также снижения доли вынашивания и донашивания беременности [7, 9, 22]. Недостаточная эффективность традиционных методов лечения ХЭ и «тонкого» эндометрия заставляет продолжать поиск более результативных терапевтических подходов и лечебных стратегий [3, 6, 21, 27–30]. Все чаще в дополнение к стандартному антимикробному и гормональному воздействию используются лечебные физические факторы (низкочастотная магнитотерапия, лазеротерапия, электроимпульсная терапия), не имеющие убедительной доказательной базы, однако хорошо себя зарекомендовавшие среди российских специалистов [31].
Одним из подобных немедикаментозных методов воздействия является ультразвуковая кавитация. Методика кавитации жидкости основана на образовании кавитационных пузырьков или холодного кипения. Когда ультразвуковая волна достаточной мощности (мощность выше так называемого «кавитационного порога») проходит через жидкость, в ней возникают пульсирующие микропузырьки, несущие электрический заряд на пограничной поверхности, заполненные паром, газом или их смесью. Данный процесс называется ультразвуковой кавитацией. Появление и последующее увеличение пузырьков в жидкой среде происходит в полупериоды разрежения низкочастотной ультразвуковой волны. В полупериод сжатия пузырьки стремительно «схлопываются» (взрываются), создавая микроскопическую ударную волну и микрообласти, в которых резко повышаются температура и давление. В растворе возникают полости с газом, включающие в себя перекись, а также ионы кислорода и водорода. Микроскопические по своему размеру кавитационные пузырьки попадают в пораженные участки, недоступные для традиционного воздействия. Наблюдаемые в озвучиваемой среде изменения обусловлены как прямым воздействием низкочастотного ультразвука, связанным с кавитацией, акустическими потоками, переменным движением частиц, так и вторичными эффектами ультразвуковых волн, проявляющимися в виде бактерицидных, фонофоретических, стимулирующих, иммуномодулирующих, тепловых и других процессов [21, 32].
Воздействие на эндометрий растворов, кавитированных ультразвуком, приводит к усилению кровоснабжения в слизистой оболочке матки и стимулирует ее рост [21, 32–34].
Материалы и методы
В настоящей работе проведен анализ эффективности терапии «тонкого» эндометрия у пациенток с использованием метода низкочастотной ультразвуковой кавитации перед циклом переноса криоконсервированных эмбрионов. В исследование нами были включены 46 пациенток репродуктивного возраста с первичным (28/46 – 60,9%) или вторичным (18/46 – 39,1%) бесплодием и наличием «тонкого» эндометрия, не поддающегося лечению другими методами: всем женщинам неоднократно осуществлялась стандартная терапия ХЭ (антибактериальная, гормональная, иммуномодулирующая, физиолечение) на протяжении не менее 6 предыдущих месяцев.
В период с февраля 2018 г. по февраль 2020 г. подавляющему большинству данных пациенток по результатам роста эндометрия в исходе курсов лечения с использованием кавитированных растворов в клинике «ВитроКлиник» ООО «ВИТРОМЕД» проведены программы ВРТ: ЭКО-криопротокол.
Возраст пациенток в среднем составлял 36,4±4,9 года (от 28 до 43 лет). Средняя продолжительность бесплодия – 5,1±3,3 года (от 2 до 14 лет). В анамнезе у всех пациенток были один или несколько безуспешных протоколов ЭКО. Повторяющаяся неудача имплантации (Recurrent Implantation Failure – RIF), относящаяся к случаям, в которых женщины перенесли три и более неудавшихся попытки ЭКО с эмбрионами хорошего качества, отмечена у 8/46 (17,4%) пациенток, а более 5 неудавшихся попыток – у 6/46 (6,5%).
Всем 46 пациенткам группы исследования в дни предполагаемого окна имплантации (5–6-й день после овуляции) проводилась ультразвуковая мультипараметрическая оценка органов малого таза на аппаратах Mindrey DC8 и Toshiba Aplio 500.
УЗИ проводилось в несколько этапов: исходно, в процессе и после лечения растворами, кавитированными низкочастотным ультразвуком.
При каждом виде сканирования совокупно применялись двухмерный В-режим (2D) с различными цветовыми картами, режим цветового допплеровского картирования (ЦДК), режим энергетического допплеровского картирования (ЭДК), режим улучшенного динамического потока (ADF), спектральная допплерография и допплерометрия, режимы объемной реконструкции (3–4D), дополненные режимом толстого среза и томографических срезов в комплексе с ЦДК. В отдельных случаях использования линейного датчика проводилась оценка структуры эндометрия в режиме MicroPure (при наличии фиброзных включений в базальном слое эндометрия). Такой широкий набор режимов сканирования в различных вариантах и сочетаниях позволил широко и максимально точно оценить индивидуальные особенности клинической ситуации в каждом конкретном случае.
Итоговое УЗ-резюме отображалось в виде биофизического профиля матки [35], дополненного авторами статьи спектральными характеристиками маточного кровотока, особенно микроциркуляторного русла, и оценкой васкуляризации матки в режимах 3D в комплексе с ЦДК.
У всех пациенток оценивались содержимое полости матки и качество эндометрия на 7–11-й день МЦ путем офисной гистероскопии по стандартной методике фиброгистероскопом OLYMPUS HYF type P с наружным диаметром дистальной части 3,0 мм и/или пайпель-биопсии эндометрия с последующим гистологическим и ИГХ-исследованиями биоптата [36, 37].
Эндоскопическими критериями верификации диагноза ХЭ являлись очаговая или диффузная гиперемия поверхности слизистой матки, ее отечность, выявление центрально расположенных белесоватых очагов [36].
Пайпель-биопсия эндометрия выполнялась в случае самостоятельной процедуры также на 7–11-й день МЦ.
ИГХ-исследование биоптата осуществлялось для выявления NK-клеток (CD56+) и плазматических клеток (CD138+).
После проведенного обследования всем пациенткам было проведено лечение с использованием метода ультразвуковой кавитации при помощи аппарата «ФОТЕК» в циклах, предшествующих переносу криоконсервированных эмбрионов.
Результаты
При эхолокации ТЭ на 13–15-й день МЦ до лечения составила в среднем 5,8±1,1 мм.
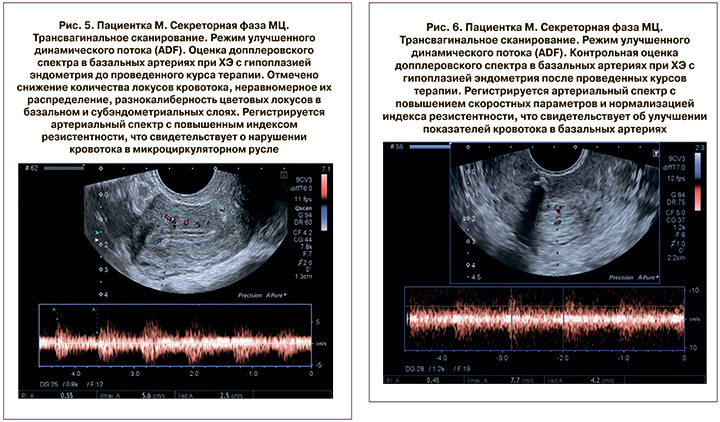
Анализ исходных сонографических данных показал, что в большинстве случаев имелись критические характеристики эндометрия и показателей кровотока в матке, характерные для ХЭ, эндомиометрита, с фиброзированием и микрокальцинозом базального слоя и субэндометриальных отделов миометрия, что отражалась и констатировалось во всех проводимых режимах и применяемых методиках исследования, особенно в показателях спектрального допплера. При допплерометрии выявились достоверное повышение сопротивления в маточных, базальных, радиальных и спиральных сосудах, увеличение систоло-диастолического отношения (S/D) и снижение конечной диастолической скорости в эндометриальных и субэндометриальных артериях (рис. 1, 3, 5).

Офисная гистероскопия была проведена 34 из 46 пациенток (73,9%). Гистероскопические признаки ХЭ были обнаружены у 18 из 34 (52,9%) пациенток, что продемонстрировало недостаточно высокую чувствительность метода. Критерием диагноза ХЭ чаще всего являлись локальная или диффузная гиперемия слизистой эндометрия с мелкоточечными кровоизлияниями, неравномерная ТЭ и его отечность. Выявленные при обследовании у 4/34 (11,8%) женщин единичные «нежные» синехии были разрушены механически.
У всех пациенток при проведении гистероскопии была проведена пайпель-биопсия эндометрия. У 12/46 (26,1%) пациенток, включенных в исследование, была произведена только пайпель-биопсия эндометрия. Морфологическими критериями ХЭ был подтвержден у 36/46 (78,3%) пациенток.
При ИГХ-исследованиях в 42 случаях из 46 (91,3%) также выявлены признаки ХЭ.
Изменения слизистой оболочки матки, обнаруженные у обследованных нами женщин, указывали на снижение процессов пролиферации функционального слоя эндометрия и подтверждали присутствие реактивных поствоспалительных трансформаций в строме непосредственно под поверхностным эпителием, что проявлялось развитием отека, разрастанием соединительной ткани и нарушениями микроангиоархитектоники.

Всем пациенткам осуществлялось локальное воздействие на эндометрий лекарственным раствором, кавитированным низкочастотным ультразвуком. Для данной манипуляции нами использовался аппарат ультразвуковой хирургический АУЗХ-100-«ФОТЕК» по ТУ 9444-014-41747567-2009 (Регистрационное удостоверение на медицинское изделие от 23.10.2014 г. № РЗН 2014/2028; производитель ООО «ФОТЕК», Екатеринбург, РФ) с внутриматочным акустическим узлом.
Начало проведения процедур – 5–9-й день МЦ.
Ультразвуковое лечение проводили в амбулаторных условиях 2–3 курсами (число курсов определялось оценкой ТЭ в процессе терапии): во время 1-го и 2-го курсов процедур пациентки получали орошение слизистой матки 0,05% водным раствором хлоргексидина; во время 3-го курса – стерильным 0,9% раствором хлорида натрия. Все лечебные растворы были обработаны низкочастотным ультразвуком. Курсы процедур, включающие ежедневное воздействие на слизистую матки в течение 5 суток, проводились без перерыва в каждом МЦ. Время обработки составляло 5 минут.
Оценка эффективности осуществлялась путем УЗ-мониторинга с измерением ТЭ и допплерометрии кровотока матки в процессе терапии и по завершении курса лечения по вышеуказанной схеме (рис. 2, 4, 6).
Дополнительно пациентки получали заместительную гормональную терапию. Препараты эстрогенов назначались с 5-го по 15-й день МЦ (трансдермальный 17β-эстрадиол по 1 г 2 раза в сутки или эстрадиола валерат по 2 мг внутрь 2 раза в сутки). С 16-го по 25-й день МЦ назначались препараты прогестерона (микронизированный прогестерон по 200 мг интравагинально 2 раза в сутки или дидрогестерон по 10 мг внутрь 2 раза в сутки).
На 13–15-й день следующего МЦ после проведенного лечения кавитированными растворами проводилось контрольное УЗИ органов малого таза с допплерометрией маточных сосудов, продемонстрировавшее достоверное увеличение среднего показателя М-эха до 8,7±0,9 мм. У 22/46 (47,8%) пациенток ТЭ составила 8,0–9,5 мм, у 5/46 (10,8%) пациенток – 9,6–10,5 мм, у 15/46 (32,6%) пациенток – 7,0–7,9 мм. У 4/46 (8,7%) пациенток ТЭ не изменилась относительно состояния до лечения и не превышала 6,9 мм.
Перенос эмбрионов проведен 42/46 (91,3%) пациенткам. У 4/46 (8,7%) пациенток с недостаточной ТЭ процедура произведена не была.
Эффективность терапии с использованием кавитированных растворов с последующим проведением программы ЭКО оценивалась по восстановлению генеративной функции и частоте наступления беременности. Клиническая беременность была зарегистрирована у 17/42 (40,5%) пациенток, вступивших после лечения в протокол ВРТ. Из них срочные роды произошли у 13/17 (76,5%) пациенток, выкидыш в сроке 7 недель беременности – у 1/17 (5,9%), неразвивающаяся беременность – также у 1/17 (5,9%). Случаев поздних выкидышей (13–22 недели) и преждевременных родов зарегистрировано не было. Кроме того, у 1 пациентки зафиксирована биохимическая беременность.
2/17 (11,8%) пациентки на момент написания статьи продолжали вынашивать беременность.
Заключение
Таким образом, применение метода ультразвуковой кавитации у пациенток с «тонким» эндометрием позволяет добиться увеличения толщины слизистой матки и восстановления ее структуры, улучшить гемодинамические показатели маточного кровотока, а главное – повысить эффективность программы ЭКО. Частота наступления беременностей свидетельствует об эффективности воздействия растворов, кавитированных низкочастотным ультразвуком, на патогенез ХЭ как причину бесплодия.



